Margaret K. Kyle
Comentario del Blog:
Este texto explora el complejo panorama de la regulación de precios de medicamentos en el mundo, enfocándose especialmente en las lecciones que puede extraer Estados Unidos de las experiencias internacionales.
Contexto y particularidades del mercado farmacéutico
Los precios de los medicamentos en Estados Unidos destacan por ser considerablemente más altos que en otras economías avanzadas, como Francia, Alemania, Japón o el Reino Unido. Esta situación ha generado consenso entre los partidos políticos estadounidenses sobre la necesidad de tomar medidas regulatorias.
El mercado farmacéutico es singular debido a que los medicamentos son bienes cuya calidad es difícil de evaluar antes y después de su consumo. Por ello, la intervención estatal es habitual, tanto para asegurar la calidad mediante agencias regulatorias (como la FDA en EE. UU. y la EMA en Europa) como para proteger la innovación a través de patentes y exclusividades. Estas protecciones buscan incentivar la inversión en nuevos medicamentos, pero también limitan la entrada libre al mercado.
Otro rasgo particular es que los seguros de salud distorsionan la relación entre paciente y precios, generando un consumo potencialmente excesivo (riesgo moral). Además, los médicos suelen prescribir sin ser sensibles al precio y los pacientes no pagan el costo real debido al seguro. Todo esto, sumado al poder de mercado que otorgan las patentes, eleva los precios, especialmente en productos innovadores.
Desafíos de la intervención estatal
Dadas estas características, la determinación eficiente de precios es compleja. La intervención del gobierno puede ayudar a mejorar resultados, pero debe equilibrar el incentivo a la innovación, la contención de gastos y el acceso a los tratamientos. Las políticas pueden distorsionar el mercado si no se basan en una buena valoración del beneficio real de los medicamentos.
Modelos internacionales de regulación
Muchos países tienen políticas para regular precios, especialmente para medicamentos innovadores. Algunos fijan precios máximos directamente, otros negocian precios o deciden qué medicamentos serán reembolsados por el sistema público.
- Regulación basada en costos: ejemplos como el Reino Unido imponen límites a las ganancias de las farmacéuticas en ventas al sistema de salud. Sin embargo, este modelo puede incentivar el gasto ineficiente en I+D y no necesariamente vincula los precios al valor terapéutico del medicamento.
- Precios basados en valor: cada vez más países buscan relacionar el precio con el valor terapéutico real del medicamento, aunque esto requiere evaluaciones complejas y costosas.
- Evaluaciones de costo-efectividad: sistemas como los de Reino Unido y Alemania reembolsan solo medicamentos cuyo precio se justifica mediante coste-efectividad, midiendo el costo por año de vida ajustado en calidad (AVAC). Esta metodología también tiene retos, como la variabilidad entre países y la dificultad de establecer umbrales adecuados.
- Precios de referencia: tanto internos (comparando con productos similares locales) como externos (comparando con otros países). Si bien los precios de referencia pueden limitar los precios, también inducen a demoras estratégicas en el lanzamiento de medicamentos en mercados menos rentables, afectando el acceso.
El caso de Estados Unidos y recientes reformas
En EE. UU., el sector privado tiene un rol mayor y la cobertura no es universal, lo que genera una amplia dispersión de precios para el mismo medicamento. Sin embargo, hay cambios: la Ley de Reducción de la Inflación de 2022 permite negociar precios para ciertos medicamentos cubiertos por Medicare, aunque los descuentos se basan en el tiempo desde la aprobación del medicamento, no en el valor terapéutico. Esto podría tener consecuencias estratégicas, como demoras en el lanzamiento de nuevas presentaciones.
Se han considerado propuestas como la reimportación de medicamentos de mercados más baratos o vincular precios a los existentes en otros países, pero el impacto sería limitado, y podría reducir el acceso en mercados de referencia como Canadá.
Enfoques alternativos y experimentaciones
La innovación en mecanismos de fijación de precios incluye:
- Premios y compromisos anticipados de mercado (AMC): consisten en recompensar la innovación con pagos fijos por el desarrollo de tratamientos que cumplan ciertos criterios, desvinculando el precio del volumen de ventas. Ejemplo: el financiamiento de vacunas neumocócicas por la Fundación Gates.
- Modelos de suscripción («modelo Netflix»): el pagador paga una tarifa fija a la farmacéutica por acceso ilimitado durante un periodo. Australia lo ha implementado para tratamientos de hepatitis C, y algunos estados de EE. UU. lo han intentado con resultados moderados.
- Contratos basados en resultados o riesgo compartido: el precio o el reembolso dependen del desempeño del medicamento en la práctica clínica real. Si bien su potencial es alto para alinear incentivos y mejorar el acceso, la falta de transparencia y la complejidad en su implementación han limitado su adopción.
Implicacancias económicas y comparación internacional
El gasto en medicamentos es solo una parte del gasto sanitario total, que en EE. UU. es mayor que en cualquier otro país desarrollado. Sin embargo, dentro del gasto en salud, el porcentaje destinado a medicamentos es relativamente bajo. Además, los precios de los genéricos en EE. UU. son, en promedio, más bajos que en otros países, lo que compensa en parte los altos precios de los medicamentos patentados.
Las políticas que buscan limitar los precios pueden afectar la inversión en I+D y, por tanto, la innovación futura. Estudios muestran que el tamaño y la rentabilidad del mercado estadounidense han sido fundamentales para el desarrollo global de nuevos medicamentos.
Retos y recomendaciones
El diseño de una política óptima de precios debe equilibrar incentivos para la innovación y el acceso, evitando distorsiones y tomando en cuenta el valor terapéutico real. La experiencia internacional muestra que no hay una única solución y que cada modelo tiene ventajas y desventajas, así como efectos secundarios no deseados.
La transparencia, la mejora en la evaluación de tecnologías sanitarias y la experimentación con modelos alternativos pueden ayudar a mejorar el sistema. Sin embargo, cualquier reforma tendrá repercusiones globales, dada la importancia de EE. UU. en el mercado farmacéutico mundial.
Artículo:
Los políticos estadounidenses de todo el espectro ideológico han encontrado un raro punto de acuerdo: los precios de los medicamentos en Estados Unidos son demasiado altos y el gobierno debería hacer algo al respecto. La Figura 1 presenta los resultados de un estudio de fármacos precios en diferentes países, lo que encuentra que los precios farmacéuticos generales patente., y en particular los precios de los medicamentos con patente, son varias veces más altos que los de otros países de altos ingresos como Francia, Alemania, Japón y el Reino Unido (Mulcahy, Schwam y Lovejoy 2024). Tales comparaciones refuerzan los argumentos de quienes abogan por controles de precios u otras intervenciones gubernamentales en los Estados Unidos.
¿Por qué son necesarias las políticas en torno a los precios de los medicamentos? En otras palabras, ¿por qué la mayoría de los países desarrollados rara vez dejan los precios de los medicamentos al «mercado» sin la intervención del gobierno? En todos los países, los mercados farmacéuticos operan en condiciones que difieren sustancialmente de los supuestos detrás de un mercado competitivo que equilibraría la oferta y la demanda en función del precio. Estas condiciones reflejan problemas de información, las especificidades de los mercados de atención médica y la estructura de costos del desarrollo de medicamentos.
En primer lugar, los productos farmacéuticos son «bienes de credibilidad»: no solo es difícil para los consumidores determinar su calidad antes del consumo, sino que sus efectos son difíciles de identificar incluso después del consumo. La regulación de entrada, administrada por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) y reguladores similares como la Agencia Europea de Medicamentos (EMA), tiene como objetivo reducir esta asimetría de información. Los consumidores pueden ser
Margaret K. Kyle es profesora de Economía, Centro de Economía Industrial (CERNA), Mines Paris-PSL (Ecole des Mines), París, Francia. Su dirección de correo electrónico es margaret.kyle@ minesparis.psl.eu.
Para obtener materiales complementarios, como apéndices, conjuntos de datos y declaraciones de divulgación del autor, consulte la página del artículo en https://doi.org/10.1257/jep.20241418. El autor ha recibido apoyo financiero de una parte interesada.

Precios de EE. UU. frente a precios de otros países (porcentaje)
Fuente: Mulcahy, Schwam y Lovejoy (2024).
Precios brutos de los medicamentos recetados de los fabricantes de EE. UU. como porcentaje de los precios en otros países seleccionados, todos los medicamentos, 2022
Nota: «Todos los países» se refiere a los 33 países de comparación de la OCDE combinados. Los precios de otros países se establecen en 100. Los productos biológicos se excluyeron de los genéricos sin marca. Solo algunas presentaciones vendidas en cada país contribuyen a las comparaciones bilaterales. Los originadores de marca y los genéricos sin marca reflejan la asignación de productos farmacéuticos de IQVIA en países individuales. Razonablemente seguros de que la pequeña píldora rosa que tragan es lo que dice en la etiqueta, y que los ensayos clínicos han demostrado la seguridad y eficacia del producto. En ausencia de tal regulación de la calidad, el mercado puede reducirse o colapsar por completo (mientras que los fabricantes podrían señalar la calidad a través de otros medios, como la reputación de marca o el uso de la certificación por parte de terceros, esto también probablemente aumentaría los costos y limitaría la entrada). Sin embargo, una consecuencia de la regulación es que los mercados farmacéuticos no tienen libre entrada, incluso cuando la estructura de la industria ha evolucionado con la entrada de muchas empresas más pequeñas de biotecnología y genómica.
Demostrar calidad a los reguladores requiere la provisión de información detallada de los ensayos clínicos, así como de los procesos de fabricación. Los costos de desarrollo son muy altos para un nuevo medicamento (DiMasi, Grabowski y Hansen 2016). Sin embargo, la imitación de un medicamento cuya seguridad y eficacia se han establecido es relativamente fácil, especialmente si la información detallada proporcionada a los reguladores es pública. Es posible que los innovadores no puedan apropiarse de los beneficios si se produce una entrada rápida de los competidores. Estas condiciones hacen que la inversión en el desarrollo de nuevos medicamentos sea poco atractiva y explican una segunda intervención en los mercados farmacéuticos: la protección de patentes y otras formas de exclusividad. Al proteger un nuevo medicamento de la competencia directa durante algún período de tiempo, estas políticas buscan fomentar la inversión en innovación. Pero esta protección regulatoria es otra razón por la que la entrada libre no existe en los productos farmacéuticos.
Por lo tanto, si tomamos la regulación de entrada y la protección de patentes como dadas, la intervención del gobierno produce mercados farmacéuticos que no son perfectamente competitivos. Pocos mercados lo son, por supuesto, pero como bien sanitario, la compra de productos farmacéuticos tiene lugar en un contexto particular. Específicamente, muchos medicamentos están cubiertos, al menos en parte, por el seguro médico.
Debido a que los pacientes con seguro no enfrentan el verdadero precio de la, atención pueden consumir demasiado. Einav y Finkelstein (2018) proporcionan una evaluación de los estudios empíricos sobre el riesgo moral y el seguro de salud, y concluyen que la evidencia es consistente con el riesgo moral. Este riesgo moral aumenta los costes para las aseguradoras, incluso cuando los tratamientos se suministran en un mercado perfectamente competitivo, al aumentar la cantidad consumida. Sin embargo, cuando los proveedores tienen poder de mercado como resultado de patentes u otra exclusividad, el problema se agrava aún más. Frente a pacientes con una demanda menos elástica por el seguro, los proveedores pueden establecer precios más altos.
Otra complicación es que los prescriptores median la demanda de productos farmacéuticos. Al igual que muchos bienes y servicios en el cuidado de la salud, se supone que los expertos (generalmente médicos) tienen mejor información sobre el tratamiento adecuado que el consumidor (paciente). Para los medicamentos recetados, el prescriptor selecciona el medicamento y la dosis. En los países occidentales, los prescriptores no suelen vender medicamentos a los pacientes. Es posible que no conozcan los precios relativos o que no sean sensibles a ellos. Esto se debe en parte a su diseño: un mayor afán de lucro podría introducir problemas problemáticos para la agencia (para evidencia sobre este punto, ver Jacobson et al. 2006; Iizuka 2007). Sin embargo, la separación de los medicamentos que prescriben y dispensan limita la elasticidad precio de los prescriptores, aunque hay evidencia de que los prescriptores responden a la información sobre el precio cuando está disponible (Epstein y Ketcham 2014).
Dadas todas las dificultades de información y regulación en la atención médica, los precios determinados en un mercado sin regulación de precios pueden no proporcionar un resultado eficiente o ganancias que incentiven correctamente la innovación y la provisión. Si bien las regulaciones reducen la información asimétrica, no la eliminan. Incluso si los ensayos clínicos proporcionan una estimación de la efectividad de un medicamento en promedio, los pacientes y los médicos pueden tener dificultades para identificar el efecto causal de un tratamiento en el individuo. Los efectos placebo pueden desempeñar un papel, por ejemplo, u otras intervenciones o comportamientos de los pacientes pueden ser importantes. Es posible que los médicos no estén bien informados sobre los desarrollos e innovaciones recientes de medicamentos, o que sus prácticas clínicas evolucionen muy lentamente; éste puede retrasar la adopción de productos terapéuticamente beneficiosos (Kyle y Williams 2017). Los esfuerzos de publicidad y marketing también pueden influir en la demanda, con efectos ambiguos y heterogéneos (Leffler 1981; Azoulay 2002; David, Markowitz y Richards-Shubik 2010; Ching e Ishihara 2012). Debido a los reembolsos secretos y otros factores que reducen la transparencia, el precio de un producto farmacéutico puede transmitir poca información sobre su calidad.
En resumen, con las barreras regulatorias a la entrada, los seguros y los prescriptores sin «piel en el juego», las condiciones están maduras para precios muy altos en los productos farmacéuticos patentados. Esto presenta un desafío presupuestario para los pagadores que actúan como tomadores de precios. Pueden responder restringiendo el acceso, con consecuencias negativas para el bienestar del paciente. Si los precios farmacéuticos no están relacionados con la importancia de un medicamento (es decir, el valor terapéutico y la eficacia), el mercado no está enviando señales adecuadas para la dirección de nuevas inversiones (Kyle 2018).
La intervención del gobierno en la fijación de precios puede, en teoría, mejorar los resultados. En las siguientes secciones se analizan estas intervenciones con más detalle. Estados Unidos es un caso atípico entre las naciones desarrolladas al tener un papel más limitado del gobierno en la atención médica en general y en los precios farmacéuticos específicamente. Si bien los precios de los medicamentos en EE. UU. son más altos, el gasto en atención médica también es mucho mayor en los Estados Unidos. Además, el gran tamaño del mercado estadounidense le da a sus políticas un papel más importante en los incentivos globales a la innovación.
Si un mercado descentralizado tiene deficiencias, diseñar un mercado centralizado para productos farmacéuticos que funcione bien plantea numerosos desafíos. Algunos de estos son comunes a otros bienes y servicios de atención médica, como tener en cuenta el costo de oportunidad de gastar en medicamentos versus otros tratamientos, o salud versus otros programas gubernamentales. Los costos administrativos y el potencial de juego también son problemas al establecer tasas de reembolso para procedimientos, visitas al consultorio y otras áreas. Numerosos estudios han examinado las respuestas estratégicas a las tasas de reembolso reguladas, como la «codificación» o un cambio en los servicios prestados (Dafny 2005; Fang y Gong 2017; Batty e Ippolito 2017). Cuando estas tarifas son vulnerables a la manipulación por parte de los proveedores, pueden establecerse en niveles ineficientes (Milcent 2021).
Otros problemas son más destacados cuando se interviene en la fijación de precios farmacéuticos que para la mayoría de los bienes o servicios de atención médica. La fijación de precios de los medicamentos es implícitamente una herramienta de la política de innovación. Si la innovación no es recompensada, deberíamos esperar niveles más bajos de inversión. Las patentes son instrumentos políticos ineficaces para atraer la inversión en innovación si los precios se determinan maximizando solo el bienestar estático. La estructura de costos de los productos farmacéuticos es importante aquí, porque los precios generalmente se determinan después de que se hayan incurrido en los costos de desarrollo. Si las empresas venden a compradores monopsonistas, están sujetas a retenciones. Los compradores deben comprometerse con precios que superen lo que es óptimo a corto plazo. Además de proporcionar incentivos para el nivel de innovación, los precios también deben proporcionar información sobre la dirección deseada de la innovación. Es decir, deben alinear el valor social y las recompensas privadas para que los inversores persigan una innovación que sea socialmente valiosa.
Por supuesto, medir el valor social de un producto farmacéutico está lejos de ser simple. Los ensayos clínicos requeridos para la autorización de comercialización por parte de US Food y La Administración de Medicamentos o sus contrapartes en otros países proporcionan información sobre la seguridad y eficacia de un medicamento en condiciones cuidadosamente controladas; Sin embargo, no evalúan el valor terapéutico general o el valor social de manera más amplia. Por ejemplo, un ensayo clínico puede mostrar que un tratamiento cardiovascular reduce los ataques cardíacos en un 10 por ciento. Pero eso no nos dice si el tratamiento es más efectivo en un sentido absoluto que los tratamientos existentes, o si es más rentable, o si esa reducción conduce a un menor gasto en atención de emergencia o intervenciones quirúrgicas, o días más productivos en el empleo. El diseño del mercado para la regulación de precios farmacéuticos debe crear incentivos para el suministro de esta información, o incurrir en los costos administrativos de producirla.
Finalmente, a diferencia de la mayoría de los servicios en el cuidado de la salud, los productos farmacéuticos son productos comercializados a nivel mundial que son muy similares en todos los países. La posibilidad de arbitraje de precios entre mercados puede dar lugar a que las empresas opten por renunciar a mercados más pequeños con precios bajos para preservar las ganancias en los países grandes (Kyle 2007; Maini y Pammolli 2023). Además, los incentivos a la innovación creados por un solo país se extienden a todos los demás países que podrían beneficiarse de los resultados de ese esfuerzo innovador. Los mercados pequeños que representan una pequeña parte de los ingresos mundiales pueden ver pocas razones para crear incentivos a la innovación mediante el pago de precios altos, ya que es poco probable que el sector privado responda con fuerza a un pequeño aumento de los ingresos previstos. Los grandes mercados como Estados Unidos, que tienen el potencial de cambiar los incentivos a la innovación a través de los precios, están sujetos a parasitismo (Grossman y Lai 2008). La inclusión de un nivel mínimo de protección de la propiedad intelectual en los acuerdos comerciales busca limitar ese parasitismo, pero no lo elimina si los países utilizan controles de precios. Estas externalidades internacionales introducen una complejidad importante en el diseño del mercado.
El panorama para establecer los precios de los medicamentos
Los países desarrollados de todo el mundo han introducido una serie de políticas para controlar los precios de los productos farmacéuticos. Me centro aquí en los que se utilizan para medicamentos con patente o de marca, aunque también tienen implicaciones para el mercado genérico. Algunos países intervienen directamente en los mercados fijando un precio máximo de un producto, a cualquiera o a todos los niveles de fabricante, mayorista o minorista. Otros permiten a los fabricantes fijar precios en respuesta a las políticas gubernamentales sobre cobertura y reembolso. Los países varían en la forma en que evalúan los productos; por ejemplo, de forma absoluta o comparativa, y en si consideran solo las características clínicas u otros factores, como los costos de investigación y desarrollo o la producción local. No intento un estudio exhaustivo aquí; el Commonwealth Fund (2020) y la OCDE (2008) proporcionan resúmenes útiles.
Tipos y bases de intervención
Como compradores monopsonistas en la mayoría de los países, los pagadores gubernamentales tienen una influencia considerable sobre el precio de los medicamentos, pero han adoptado enfoques diferentes. En
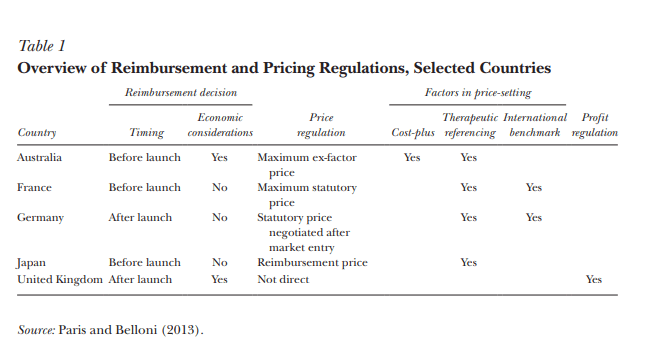
Descripción general de las regulaciones de reembolso y fijación de precios, países seleccionados
En algunos países, los precios son el resultado de una negociación directa entre el gobierno y el fabricante. Otros países toman el precio del fabricante y deciden si el gobierno lo reembolsará. Con cualquiera de los dos enfoques, los gobiernos utilizan una variedad de criterios para valorar un nuevo medicamento; La Tabla 1 ofrece una visión general de varios países de la OCDE.
Criterios de evaluación
Enfoques basados en costos. Las regulaciones de «costo plus» o «tasa de retorno», como las que alguna vez se extendieron en los mercados eléctricos, atraen a quienes creen que las empresas farmacéuticas obtienen ganancias excesivas. La propia industria farmacéutica utiliza los altos costos de investigación y desarrollo como justificación para su fijación de precios. Tales políticas se pueden aplicar a nivel de producto, fijando el precio de un medicamento a sus costos de desarrollo estimados más un margen de beneficio, o a nivel de empresa o cartera de productos, en el que la tasa de rendimiento general de la empresa es limitada.
El Plan de Regulación de Precios Farmacéuticos del Reino Unido (PPRS), ahora conocido como el Esquema Voluntario para la Fijación de Precios de Medicamentos de Marca, es un ejemplo de regulación de la tasa de rendimiento. En uso desde 1957, es un acuerdo entre el gobierno del Reino Unido y la «industria farmacéutica basada en la investigación», miembros del grupo comercial Asociación de la Industria Farmacéutica Británica (ABPI), y se renegocia cada cinco años. Los fabricantes participantes están sujetos a una ganancia máxima (actualmente del 21 por ciento) permitida en sus ventas al Servicio Nacional de Salud (NHS); también acuerdan limitar el crecimiento del gasto total del NHS en productos cubiertos por este esquema. Las ganancias que excedan este límite se devuelven al NHS como reembolsos. Tenga en cuenta que no hay una garantía de ganancia mínima y que los controles de ganancias se evalúan en una cartera de productos en lugar de medicamento por medicamento. Existe poca evidencia empírica sobre los efectos de esta política. Borrell (1999) evalúa los resultados hasta 1994 y concluye que el PPRS tuvo poco efecto sobre los precios. El ABPI (2014) documentó una disminución en los precios relativos de los medicamentos de marca en el Reino Unido en comparación con a otros países entre 2003 y 2011. Las implicaciones para el nivel y la dirección de la inversión en investigación y desarrollo son aún más difíciles de identificar porque el mercado del Reino Unido es un pequeño porcentaje de los ingresos globales.
Los economistas son generalmente escépticos sobre la regulación del costo más o la tasa de rendimiento en este contexto, particularmente si se aplica a medicamentos individuales en lugar de a los portóficos de productos. El costo adicional, en particular, corre el riesgo de recompensar el gasto en investigación y desarrollo que puede ser ineficiente. Las empresas están dispuestas a gastar más para desarrollar productos con mayores ingresos esperados, y el gasto adicional puede resultar en un mejor perfil clínico. Sin embargo, más dinero gastado en el desarrollo de un producto no siempre produce un mayor valor terapéutico, por la misma razón que los millones gastados en la producción de una película no garantizan ni su éxito comercial ni su valor artístico. Establecer un precio más alto para un medicamento que era costoso de desarrollar pero que tiene los mismos efectos clínicos que uno con bajos gastos de desarrollo aumenta los costos para el pagador y distorsiona los incentivos. La regulación de la tasa de rendimiento aplicada a una cartera de productos no crea ningún incentivo para que las empresas reduzcan los costos de desarrollo; estos han aumentado sustancialmente con el tiempo (DiMasi, Hansen y Grabowski 2003; DiMasi, Grabowski y Hansen 2016), lo que también podría representar una barrera de entrada importante. Con la regulación tanto del costo más como de la tasa de rendimiento, el precio no está necesariamente vinculado al valor terapéutico o social. En el primer caso, como se acaba de discutir, el costo de desarrollo y el valor terapéutico pueden no estar relacionados. En este último, si las empresas pueden fijar libremente el precio, el vínculo con el valor social puede debilitarse debido a las fricciones del mercado discutidas en la sección anterior. Una segunda preocupación es la necesidad de datos internos detallados de las empresas sobre sus gastos para determinar los costos. La Organización Mundial de la Salud recomienda no reglamentar el costo más margen en sus Directrices de 2020, principalmente para los desafíos de implementación, señalando que la «aplicación de precios de costo más margen a los medicamentos requiere importantes recursos técnicos y humanos, particularmente para obtener y validar estimaciones confiables de los costos de los componentes». La dificultad de estimar los costos puede ser una de las razones por las que las políticas de costo más incrementado no están muy extendidas en los países desarrollados. Los recientes llamamientos a una mayor transparencia en el gasto en investigación y desarrollo, como el gasto por producto en lugar de las cifras agregadas que suelen informar, se centran en esta dificultad. Las políticas de tasa de rendimiento a nivel de empresa tienen una carga de información menor, pero aún importante.
Criterios basados en el valor. En los últimos años, la industria ha abogado por la adopción de precios «basados en el valor», en los que los costos de investigación y desarrollo y fabricación no juegan ningún papel. Más bien, en este enfoque, los productos más valiosos (terapéuticamente superiores) reciben precios más altos. Debido a que un producto puede ser más efectivo para ciertas poblaciones de pacientes, o puede tratar varias enfermedades con efectividad variable, un precio basado en el valor puede diferir para el mismo medicamento según la indicación terapéutica o el subgrupo de pacientes, al menos en teoría. Hay al menos dos desafíos para la implementación de precios basados en el valor. En primer lugar, si bien no requiere información sobre los costos de investigación y desarrollo, sí requiere evaluaciones del valor terapéutico de un medicamento que van más allá de lo que es normalmente se requiere para la autorización de comercialización. Estas evaluaciones de tecnologías sanitarias a menudo incluyen estudios comparativos, en los que un ensayo prueba un nuevo producto frente a otros tratamientos disponibles en lugar de un placebo. Los criterios de valoración clínicos pueden diferir y estos estudios pueden explotar la «evidencia del mundo real» para examinar el uso de un producto fuera del entorno de ensayo clínico cuidadosamente controlado. Estas evaluaciones suelen ser costosas y requieren mucho tiempo. Si bien las agencias reguladoras han armonizado en gran medida los requisitos para la autorización de comercialización, hay menos coordinación entre los países en el diseño de evaluaciones de tecnologías sanitarias, y esto puede llevar a diferentes conclusiones sobre el valor de un medicamento. En parte, eso se debe a la variación en el estándar de atención o la importancia de los productos de la competencia, que no son los mismos en todos los países. Satisfacer las diferentes demandas de evaluaciones de tecnologías sanitarias aumenta los costos del fabricante, aunque los fabricantes pueden preferir una diversidad de puntos de vista sobre el valor de un medicamento si les permite discriminar los precios entre países. Un segundo desafío es que si se puede establecer la superioridad terapéutica, aún queda por determinar cuánto está dispuesto a pagar un pagador por esa mejora clínica.
En Francia, el proceso de fijación de precios y reembolso comienza con una determinación inicial de si un producto es lo suficientemente importante como para ser reembolsado (su «service médical rendu» (SMR)) y sus ventajas terapéuticas sobre los tratamientos existentes (ASMR o «amélioration de service médical rendu»). Estas evaluaciones son oficialmente independientes del precio; el ASMR es un insumo para las negociaciones de precios posteriores, que generalmente establecen un precio para un período de tres años. Los productos que se considera que agregan valor terapéutico tienen derecho a un precio superior al de los competidores, mientras que otros deben tener un precio igual o inferior al de los productos existentes. Sin embargo, tal vez en previsión de esas negociaciones, el organismo que asigna los ASMR ha juzgado históricamente que muy pocos productos agregan un valor terapéutico significativo, y los ingresos de los productos solo están vagamente relacionados con sus puntajes de ASMR (Kyle 2018). Aunque un medicamento puede tener varios ASMR, que varían según la indicación o los subgrupos de pacientes, existe un precio único establecido para todo el mercado, lo que ilustra la dificultad práctica de los precios basados en indicaciones vinculados al valor. Umbrales de costo-efectividad. Un enfoque que evita regatear directamente sobre el precio hace que los pagadores ejerzan su poder para rechazar la cobertura del seguro. Por las razones expuestas anteriormente, en la mayoría de los sistemas de salud, el seguro reduce la elasticidad de los precios de los pacientes, y los prescriptores desconocen o son insensibles al precio de los medicamentos. Si los fabricantes son libres de fijar el precio, el reembolso completo de todos los medicamentos es ineficiente e imposible desde un punto de vista presupuestario. Por lo tanto, los pagadores pueden optar por limitar la cobertura reembolsando solo aquellos productos cuyos precios son menores que la disposición del pagador a pagar por una mejora de la salud. El Reino Unido y Alemania utilizan las evaluaciones de costo-efectividad como el principal instrumento de política para abordar el precio. Los fabricantes pueden fijar libremente los precios de sus productos en el Reino Unido; estos productos están sujetos a una evaluación de costo-efectividad por parte del Instituto Nacional para la Excelencia Clínica (NICE), que decide si recomienda un producto para su reembolso por parte del Servicio Nacional de Salud. Alemania permite al fabricante establecer un precio en el momento del lanzamiento del producto y, seis meses después, evalúa si el país reembolsará el producto a ese precio o al precio de un producto competidor. Por supuesto, el fabricante determina su precio a la sombra de la decisión de reembolso.
Dado el precio elegido por el fabricante, una evaluación de tecnología sanitaria evalúa el coste del producto por año de vida ajustado por calidad (AVAC) y determina si el producto debe ser reembolsado. Un AVAC se basa en una combinación de expectativas y calidad de vida, donde la calidad de vida se mide en una escala de cero a uno, desde la muerte hasta la salud perfecta. El AVAC calculado para un medicamento determinado puede variar entre países según los datos y métodos utilizados. Esta disposición a pagar puede anunciarse explícitamente, o los gobiernos pueden proporcionar orientación sobre una serie de umbrales. Los precios no se negocian directamente con los pagadores, pero los fabricantes anticipan la necesidad de ajustar el precio en respuesta a los umbrales de rentabilidad.
La evaluación de la tecnología sanitaria (como la que se realiza para la fijación de precios basada en el valor) es una gran carga de información. Las políticas de costo-efectividad también requieren consenso sobre el valor de una vida estadística. Permitir diferentes valoraciones por enfermedad o población objetivo es teóricamente posible, pero puede ser difícil de justificar políticamente. Los umbrales utilizados en la práctica varían según el país; el King’s Fund del Reino Unido estima que el umbral de la relación coste-efectividad incremental en el Reino Unido es inferior al utilizado en Irlanda y los Países Bajos, por ejemplo (Collins 2020).
El caso de Ocrevus (ocrelizumab) ilustra la variación en las evaluaciones de tecnología de la salud entre países, con implicaciones para el precio, el reembolso y el acceso. La evaluación francesa concluyó que ofrecía beneficios terapéuticos moderados para la esclerosis múltiple progresiva primaria (EMPP) y beneficios menores para la esclerosis múltiple remitente-recurrente (EMRR), y el fármaco se reembolsa para ambos. La evaluación alemana también determinó beneficios menores para la EMRR, pero encontró que la evidencia era insuficiente para la EMPP. En el Reino Unido, el National Institute for Clinical Excellence lo ha recomendado para la EMPP, pero solo para la EMRR si otro tratamiento está contraindicado o no es adecuado. Cada país puede dar un peso diferente a la solidez de la evidencia, valorar algunos subconjuntos de pacientes más que otros, elegir diferentes productos de comparación o centrarse en diferentes resultados clínicos.
Estas opciones políticas, con sus variadas cargas informativas y administrativas, tienen implicancias para la velocidad del acceso a nuevos medicamentos. Los fabricantes lanzan nuevos productos en Alemania casi inmediatamente después de obtener la autorización de comercialización. Los pasos administrativos en países como Francia, Italia y España contribuyen a retrasos de meses en el lanzamiento del producto. Es ciertamente posible que el proceso de negociación pueda simplificarse o acelerarse. Sin embargo, los retrasos en el lanzamiento también pueden ser estratégicos, como se analiza a continuación.
Otros factores. Otros criterios también son factores en las negociaciones sobre el precio o el nivel de reembolso. Paris y Belloni (2013) proporcionan una excelente descripción de cómo los diferentes países de la OCDE abordan esto. Por ejemplo, algunos gobiernos pueden recompensar a los fabricantes por invertir en investigación y desarrollo o fabricar localmente. Los medicamentos huérfanos, que tratan a pequeñas poblaciones de pacientes, pueden estar sujetos a diferentes reglas de reembolso. A menudo, tanto el precio como las cantidades se negocian simultáneamente. Por ejemplo, las empresas pueden comprometerse a reducir los precios si los volúmenes superan un cierto nivel. En las evaluaciones que consideran más que el desempeño clínico, los pagadores deben considerar qué costos o beneficios compensatorios tener en cuenta. Una terapia que reduce el ausentismo o aumenta la productividad genera beneficios sociales, pero puede no reducir los costos directamente incurridos por el sistema de salud. Valorar tales beneficios puede favorecer los tratamientos para pacientes más jóvenes, en lugar de ancianos. Cada vez más, los países están experimentando con enfoques alternativos, como los que se describen más adelante en este documento.
Puntos de referencia de precios y comercio paralelo
En mercados que funcionan bien, los precios transmiten información. Las intervenciones gubernamentales en la fijación de precios de los medicamentos a menudo utilizan otros precios como puntos de referencia, como complemento de los procedimientos discutidos anteriormente. Estas comparaciones pueden ser con otros medicamentos que tratan la misma afección o con el precio del mismo medicamento en otros mercados. Sin embargo, estos dos tipos de «precios de referencia» tienen efectos muy diferentes. Los gobiernos también pueden permitir que los precios en otros países afecten los precios locales a través de políticas sobre comercio paralelo o reimportación.
Precios de referencia internos. La fijación interna de precios de referencia establece el nivel de reembolso de un nuevo producto como igual al de un producto competidor, o producto de referencia, dentro del mismo país. En algunos países, los fabricantes son libres de establecer un precio más alto, pero los pacientes deben pagar la prima sobre el precio del producto de referencia. Esto tiene algunas similitudes con los precios de formulario escalonados en el contexto de los EE. UU. Introduce cierta sensibilidad al precio y permite que el mercado recompense la calidad. Por ejemplo, si los pacientes valoran una mejora en la dosis (por ejemplo, una vez a la semana en lugar de diariamente, o una formulación oral en lugar de una inyección) o tienen una fuerte preferencia por los productos de marca sobre los genéricos, entonces los fabricantes deben llegar a un precio que refleje esa valoración. Sin embargo, la eficacia de esta política depende de la información de los pacientes y los prescriptores sobre las características clínicas de los productos de la competencia y de la elección adecuada de un producto de referencia.
Las experiencias con el uso de precios de referencia internos varían de un país a otro. Si bien Brekke, Holmas y Straume (2011) y Kaiser et al. (2014) encuentran que su introducción en Noruega y Dinamarca aumentó el uso de sustitutos genéricos y redujo los precios promedio, la política condujo a copagos más altos para los pacientes y un aumento en el precio de los productos sin patente en Portugal (Costa y Santos 2022). Dependiendo de cómo se calcule el precio de referencia, los efectos son teóricamente ambiguos (Miraldo 2009). Debido a que estas políticas tienen el potencial de afectar los ingresos, y en particular, la distribución de los ingresos entre productos innovadores y genéricos, o a través de recompensas a la calidad, también podrían afectar los incentivos a la innovación. Sin embargo, aislar el efecto de la adopción de una política de este tipo por parte de un solo país en la inversión global es un desafío.
Precios de referencia externos. Por el contrario, la fijación de precios de referencia externa compara el precio de un medicamento con el mismo producto en otros países. Muchos países europeos
Utilice alguna forma de esta política. Por ejemplo, en 2012, los Países Bajos limitaron el precio de un nuevo medicamento a no más que el promedio en Bélgica, Francia, Alemania y el Reino Unido.1
Una justificación económica para esta evaluación comparativa podría ser que si los países referenciados tienen evaluaciones útiles de tecnologías sanitarias de un nuevo producto y esa información se refleja en sus precios, no hay necesidad de que otro país realice una, sino que puede confiar en la información generada por otros pagadores. Este es un argumento para la coordinación en una sola evaluación de tecnologías sanitarias. Debido a que los precios de referencia externos se utilizan a menudo junto con la propia evaluación de tecnologías sanitarias de un país, otro argumento económico es que es como un metaanálisis de estudios comparativos, filtrados a través de la fijación de precios. Sin embargo, es probable que el precio en el país de referencia sea una función de algo más que la evaluación de la tecnología sanitaria. Finalmente, los países pequeños pueden hacer referencia a los precios en mercados más grandes para contrarrestar su menor poder de negociación con los fabricantes, pero los países más grandes a menudo hacen referencia a mercados pequeños como Bélgica, Dinamarca e Irlanda. Por lo tanto, tal como se implementó, la principal motivación para los precios de referencia externos parece ser la percepción de equidad: ¿por qué un país debería pagar precios más altos que sus vecinos?
Un argumento importante contra los precios de referencia externos es que crean incentivos para el lanzamiento estratégico de nuevos productos en detrimento de los países con precios relativamente bajos, si esos países se utilizan como referencias externas. Si los mercados fueran completamente independientes y los fabricantes no enfrentaran restricciones de suministro, las empresas farmacéuticas deberían estar dispuestas a vender a cualquier precio que cubra sus costos marginales y los costos fijos específicos de cada país. Sin embargo, la mayoría de los medicamentos no se lanzan inmediatamente en todos los países, ni siquiera en todos los mercados desarrollados. Además de las demoras burocráticas asociadas con la fijación de precios y el reembolso, existe un incentivo para que los fabricantes retrasen el lanzamiento (o nunca lo hagan) en los países referenciados que negocian precios bajos. Debido a que el precio en un país referenciado afecta el precio en los países referenciantes, los fabricantes favorecen un lanzamiento más rápido en países con precios más altos. En la práctica, esos son a menudo los países más ricos; estos retrasos estratégicos en el lanzamiento son costosos para aquellos con niveles de ingresos más bajos y cuyos precios se referencian (Kyle 2007; Maini y Pammolli 2023).
El comercio paralelo de productos farmacéuticos (o la reimportación, como a veces se le llama en los Estados Unidos) crea incentivos similares. Si se permite, los medicamentos vendidos en otros países a un precio más bajo pueden importarse para competir con los productos locales. Este arbitraje de las diferencias de precios entre países hace que el lanzamiento en mercados de precios bajos sea menos atractivo, junto con otras consecuencias como la escasez (Kyle 2011). Tanto los precios de referencia externos como el comercio paralelo limitan la capacidad de las empresas para discriminar precios entre países. Sin embargo, los economistas a menudo ven la discriminación de precios como un resultado relativamente eficiente, particularmente si el acceso a nuevos productos en los países más pobres es importante.Ni los precios de referencia externos ni el comercio paralelo han eliminado por completo las diferencias de precios entre países. Es importante destacar que los precios no son simplemente una función de Para más detalles, véase la Figura E.3 de Maini y Pammolli (2023). PIB per cápita, pero reflejan las opciones de política, las preferencias y el poder de negociación de los países. Por ejemplo, la semaglutida inyectable (Ozempic) tenía un precio de $ 83 en Francia, pero $ 103 en Alemania; en forma de tablilla (Rybelsus), fue de 203 dólares en los Países Bajos, frente a 103 dólares en Suecia (Amin et al. 2023). Los retrasos en el lanzamiento y el acceso también son marcados. De los medicamentos aprobados por la Agencia Europea de Medicamentos de 2019 a 2022, el 88 por ciento estaba disponible en Alemania a principios de 2024, pero menos del 20 por ciento para los países bálticos y Rumania (EFPIA 2024).
¿Puede Estados Unidos importar políticas similares?
Si bien los gobiernos son los principales pagadores de salud en otros países desarrollados, el sector privado tiene un papel más importante en los Estados Unidos y la cobertura de medicamentos no es universal. En otros países desarrollados, la mayoría de los pacientes enfrentan aproximadamente el mismo precio por un medicamento. Sin embargo, en el sistema descentralizado de EE. UU., la misma droga puede venderse a precios muy diferentes a diferentes compradores. Los administradores de beneficios de farmacia o las compañías de seguros que los utilizan negocian los precios farmacéuticos con los fabricantes. Si bien ningún administrador de beneficios de farmacia es monopsonista, sí controla el acceso a grandes poblaciones de pacientes y no es tomador de precios (Guardado 2024). Los fabricantes negocian tanto el precio como el reembolso (o la colocación en el formulario) con los administradores de beneficios de farmacia. Al igual que con los pagadores del gobierno, es importante que los administradores de beneficios de farmacia actúen como buenos agentes para los pacientes. Una diferencia crítica con los pagadores nacionales es que incluso si los pacientes estadounidenses enfrentan costos de cambio al cambiar de aseguradora, es menos probable que los residentes de un país «voten con los pies» al mudarse al extranjero si no están satisfechos con los precios y el acceso farmacéutico. Es decir, los administradores de beneficios de farmacia enfrentan cierta competencia y pueden perder participación de mercado si se niegan a cubrir un medicamento importante. Una segunda diferencia importante es que los administradores de beneficios farmacéuticos tratan de maximizar las ganancias, no el bienestar social. La influencia de un solo administrador de beneficios de farmacia en el nivel y la dirección de la innovación es limitada, pero es posible que tampoco se den cuenta de los beneficios a largo plazo de la innovación en la misma medida que un pagador del gobierno. Por ejemplo, los beneficios de una vacuna infantil se acumulan para un pagador del gobierno durante toda la vida de un individuo, en forma de reducción de enfermedades y costos de atención médica asociados. Pero es poco probable que esa persona sea el cliente del administrador de beneficios de farmacia durante toda su vida, ni el administrador de beneficios de farmacia es necesariamente sensible a la reducción de los costos de atención médica asociados.
El gobierno federal de EE. UU. también es un pagador importante, pero sus intervenciones en los precios de los medicamentos hasta hace poco eran limitadas. Si bien el Departamento de Asuntos de Veteranos puede negociar directamente, es una parte muy pequeña del gasto gubernamental en medicamentos. El precio que paga Medicaid está vinculado al del sector privado, pero no se negocia directamente. La Ley de Modernización de Medicare de 2003 prohibió al gobierno federal negociar los precios de los medicamentos reembolsados bajo la Parte D de Medicare. En cambio, el sector privado (aseguradoras que ofrecen la Parte D de Medicare y administrador de beneficios de farmacia) asume ese papel.
Esto ha cambiado recientemente. La Ley de Reducción de la Inflación de 2022 introdujo el Programa de Negociación de Precios de Medicamentos de Medicare, que establece un Precio Justo Máximo (MFP) para productos de una sola fuente con grandes proporciones de gasto de Medicare cuyos ingredientes activos se aprobaron por primera vez hace al menos siete años (u once en el caso de los productos biológicos). Destacados economistas de la salud argumentan que esta negociación debe basarse en el valor, vinculando los precios a las medidas de beneficios clínicos y económicos (Conti, Frank y Gruber 2021). Sin embargo, tal como se adoptó, la ley exige descuentos de precios basados en el número de años desde el lanzamiento en Estados Unidos. Pueden producirse muchas consecuencias no deseadas debido a las respuestas estratégicas de los fabricantes. Por ejemplo, aunque un plazo de patente limitado generalmente alienta a las empresas a lanzarse lo más rápido posible, algunos han sugerido que las empresas pueden evitar lanzarse temprano en una sola indicación para evitar activar el «reloj» para las negociaciones de Medicare (Patterson, Motyka y O’Brien 2024). Los descuentos obligatorios en los precios antes de la entrada de genéricos o biosimilares tienen el efecto de reducir los incentivos para esa entrada, que generalmente responde al tamaño de los ingresos de un medicamento (Danzon y Chao 2000). Las empresas también pueden tener más incentivos para el «salto de producto», que se refiere a la introducción de una nueva versión de un medicamento existente antes del vencimiento de la patente. Durante mucho tiempo una preocupación para las autoridades de competencia (Comisión Federal de Comercio 2022), esto puede llevar a la sustitución del producto sujeto a negociación de Medicare hacia un producto más caro, reduciendo los ahorros de costos esperados de la póliza. Un punto crucial es que, a diferencia de la mayoría de los países discutidos anteriormente, Estados Unidos es un mercado lo suficientemente grande como para que sus opciones políticas «muevan la aguja» en la inversión en investigación y desarrollo. El gasto total en productos farmacéuticos en Estados Unidos es casi cuatro veces mayor que en China, cinco veces mayor que en Japón y diez veces mayor que en Alemania (IQVIA Institute 2024). Por lo tanto, el equilibrio de los efectos estáticos y dinámicos es más importante que en el caso de un país del tamaño de Bélgica o Irlanda. Es probable que un objetivo explícito de política para reducir el gasto total reduzca la inversión, y las evaluaciones imperfectas del valor (por ejemplo, a través de supuestos erróneos utilizados en una evaluación de tecnología sanitaria o descuentos que son independientes del valor) pueden distorsionarlo. La magnitud de estos efectos es objeto de un intenso debate.
Los incentivos creados por Estados Unidos históricamente han permitido que los mercados más pequeños se aprovechen gratis, al menos hasta cierto punto. Esto ha dado lugar a propuestas para vincular los precios de Estados Unidos a los de otros mercados. Se ha propuesto la reimportación de medicamentos de Canadá u otros mercados desarrollados, pero aún no se ha implementado, a nivel federal. En 2019, la administración Trump propuso crear vías para la reimportación de productos farmacéuticos (FDA 2019). Algunos estados se han movido en esta dirección, incluidos Florida y varios estados del noreste. Su autoridad legal para hacerlo ha sido cuestionada, pero la Administración de Alimentos y Medicamentos de EE. UU. aprobó un plan para permitir la reimportación a principios de 2024. Las consecuencias del comercio paralelo en Europa sugieren que la reducción del acceso a nuevos medicamentos en Canadá es un riesgo grave. Es probable que Canadá también tome medidas para limitar la exportación con el fin de proteger el acceso de los pacientes canadienses. El tamaño relativo del mercado canadiense (aproximadamente una décima parte del de los Estados Unidos) implica que incluso si todos los productos se reimportaran en el mercado estadounidense, el cambio en el nivel general de precios de los Estados Unidos sería pequeño (Kyle 2011).
Vincular los precios de Estados Unidos a los precios de otros países, es decir, los precios de referencia externos, también es una propuesta de política con apoyo bipartidista. Aunque no se implementó, el programa piloto de la Nación Más Favorecida de Medicare habría limitado los precios a los más bajos pagados por otros países con al menos el 60 por ciento del PIB per cápita de EE. UU. (Centros de Servicios de Medicare y Medicaid 2021). Una visión optimista de esto aplica las ideas de Grossman y Lai (2008), cuyo modelo predice que los precios en otros países aumentarían (al igual que la investigación y el desarrollo y las ganancias de las empresas) como resultado de este vínculo. Sin embargo, los grupos comerciales de la industria se oponen firmemente a esta política, sugiriendo que los fabricantes esperan un efecto negativo en las ganancias de las empresas.
Una evaluación menos optimista de los precios de referencia externos considera la experiencia europea. Como se señaló anteriormente, los precios de referencia externos como este inducirían una serie de respuestas estratégicas de otras partes interesadas. Estos incluyen retrasos en el lanzamiento y/o limitaciones de suministro a mercados de precios más bajos, así como esfuerzos para hacer que los productos sean menos comparables entre países (Kyle 2007, 2011; Maini y Pammolli 2023). Otra respuesta es similar al enfoque adoptado por los administradores de beneficios de farmacia, que negocian reembolsos secretos con los fabricantes. Es decir, el verdadero precio pagado por los administradores de beneficios de farmacia no se observa fácilmente; Hay un precio de lista, pero el reembolso o descuento ofrecido por el fabricante no es público. Algunos países europeos también utilizan reembolsos ocultos. Por ejemplo, el uso de Francia como referencia por parte de otros países finalmente condujo a acuerdos entre los fabricantes y el gobierno para establecer un precio público, así como reembolsos secretos pagados por los fabricantes al gobierno (Kanavos et al. 2017). Esto permite que el precio oficial (el que hacen referencia otros países) sea más alto, como el precio de lista en los Estados Unidos, de lo que realmente se paga. Estos precios no públicos han provocado llamados a una mayor transparencia de precios, pero los efectos de una mayor transparencia aquí son ambiguos. Cuando los precios (verdaderos) son secretos, un fabricante puede bajar más fácilmente su precio en un país, porque no ve consecuencias negativas de que otros países hagan referencia a ese precio secreto. En los mercados concentrados, los precios transparentes también podrían facilitar la colusión de los fabricantes. Sin embargo, los precios no públicos hacen que las evaluaciones económicas sean mucho más desafiantes.
La evidencia sugiere que la adopción por parte de los Estados Unidos de la reimportación o de los precios de referencia externos tendría solo efectos modestos en los precios de los medicamentos en los Estados Unidos (pero probablemente reduciría el acceso o la transparencia de los precios en otros países). La negociación de los precios pagados por Medicare tiene mayores efectos potenciales en el nivel de los precios estadounidenses, dependiendo de los criterios que se utilicen. Es importante destacar que, a diferencia de las intervenciones de precios en la mayoría de los países, esta política también podría tener grandes efectos en la investigación y el desarrollo globales debido al tamaño del mercado estadounidense. Numerosos estudios han demostrado que la investigación y el desarrollo responden a los aumentos en el tamaño del mercado que resultan de las compras o mandatos del gobierno de EE. UU. sin controles de precios, aunque la innovación no es necesariamente socialmente valiosa (Finkelstein 2004; Dranove, Garthwaite y Hermosilla 2022). La nueva política de Medicare podría, en teoría, alinear mejor las ganancias con el bienestar social que el sistema actual y mejorar los incentivos. Sin embargo, como se discutió anteriormente, las evaluaciones confiables de tecnologías sanitarias son esenciales para este propósito. Los efectos también dependen de cómo respondan los pagadores privados.
Enfoques alternativos
Muchas partes interesadas, tanto en los Estados Unidos como en otros países, no están contentas con el statu quo de los precios de los medicamentos. Los pagadores enfrentan desafíos presupuestarios que son más agudos cuando posiblemente las terapias más valiosas llegan al mercado. Sovaldi (sobos-fivir) en 2013 es un ejemplo: lanzado a un precio inicial de más de $ 80,000 en los Estados Unidos, fue un gran avance en el tratamiento (de hecho, cura) de la hepatitis C (VHC). Si bien fue rentable incluso a su precio de lista, el tamaño de la población potencial de pacientes provocó un aumento abrupto en los gastos de los pagadores en el tratamiento del VHC. Aunque tanto los pagadores privados en los Estados Unidos como los pagadores públicos en otros lugares negociaron precios sustancialmente más bajos, el impacto en el gasto farmacéutico fue grande. Iyengar et al. (2016) calcularon que proporcionar Sovaldi o antivirales similares a todos los pacientes con VHC equivaldría a un aumento de más del 10 por ciento del gasto farmacéutico total en 30 países estudiados; para algunos países, tratar a todos los pacientes con VHC requeriría duplicar el gasto total en medicamentos. En los Estados Unidos, los programas públicos también experimentaron un gran aumento en los desembolsos. Medicare gastó $ 8.2 mil millones (antes de los reembolsos) en tratamientos contra el VHC en los 18 meses posteriores al lanzamiento de Sovaldi, seis veces más que el gasto anterior en el VHC. La reciente introducción de tratamientos efectivos para la obesidad para una población potencial más grande podría presionar aún más los presupuestos públicos. Según Deese, Gruber y Cummings (2024), «bajo suposiciones razonables y a los precios actuales, hacer que esta clase de medicamentos esté disponible para todos los estadounidenses obesos podría eventualmente costar más de $ 1 billón por año».
Algunos países están considerando o experimentando con alternativas a los enfoques reglamentarios descritos anteriormente. Muchos de ellos se basan principalmente en las patentes como herramienta política para crear incentivos a la innovación. Las desviaciones más significativas del statu quo implicarían compromisos ex ante (es decir, antes de que se haya desarrollado un tratamiento).
Contratación antes que innovación
En general, los países se enfrentan a una disyuntiva entre proporcionar incentivos para la innovación a través de precios altos y proporcionar acceso a esa innovación. Como se discutió anteriormente, las muchas fricciones para establecer los precios de los medicamentos y garantizar el uso adecuado, ya sea en los Estados Unidos u otros países desarrollados, producen ganancias que no están alineadas con el valor social, distorsionando los incentivos. Desvincular las recompensas por innovación de las ventas de alto margen y, en su lugar, utilizar pagos fijos para una innovación exitosa, es un intento de evitar esta compensación.
Kremer y Williams (2010) sugieren experimentar con alternativas a los derechos de propiedad intelectual, incluidos los premios o los compromisos anticipados de mercado (AMC). Estos mecanismos hacen que los pagadores anuncien una recompensa por desarrollar un tratamiento que cumpla con los criterios específicos y tienen muchas características atractivas. Debido a que el precio no se negocia después de que el producto llega al mercado, el fabricante enfrenta un riesgo reducido de demora y los financiadores tienen más certeza sobre los presupuestos. No es necesario racionar los tratamientos a los pacientes, como fue el caso de los medicamentos contra la hepatitis C, o para la fabricantes para fomentar el uso inadecuado. Si bien el sistema de patentes es una herramienta de política contundente, ya que la duración de la protección no es una función del valor o la importancia terapéutica y los precios pueden ser difíciles de predecir, un sistema de premios proporciona incentivos de innovación mucho más claros. Un ejemplo destacado de un compromiso anticipado del mercado es el financiamiento piloto de $ 1.5 mil millones de la Fundación Gates para vacunas contra el neumococo en 2009. Más recientemente, la Operación Warp Speed utilizó AMC para el desarrollo de vacunas COVID-19 (Slaoui y Hepburn 2020). Las evaluaciones de estos proporcionan lecciones valiosas para su diseño y despliegue en el futuro. En particular, ambos requirieron una serie de supuestos, con una incertidumbre considerable en el momento en que se comprometieron los fondos, y algunos de los cuales fueron criticados posteriormente (GAVI 2021; D’Souza et al. 2024). De hecho, esta carga informativa probablemente explica mejor por qué los AMC son raros. Las preocupaciones sobre los desafíos de implementar AMC o premios también han sido un factor en la falta de adopción de la Ley del Fondo de Premios a la Innovación Médica, propuesta por el senador Bernie Sanders (I-Vermont) muchas veces.
El uso de premios o compromisos anticipados de mercado también adolece del mismo riesgo de parasitismo internacional que el statu quo. En teoría, las contribuciones para financiar un premio o AMC podrían estar vinculadas al PIB per cápita. Sin embargo, ¿podrían los financiadores comprometerse de manera creíble a negar el acceso a un tratamiento resultante a países que no contribuyeron?
Contratación después de la innovación
Es probable que los cambios de política que dejan el sistema de patentes en gran medida en su lugar sean más fáciles de implementar, porque los acuerdos comerciales como el Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual relacionados con el Comercio requieren que los signatarios proporcionen un nivel mínimo de protección para la propiedad intelectual. Las patentes alinean el valor privado y social cuando las ganancias están vinculadas a la calidad y la necesidad terapéutica. Las regulaciones de precios (o la limitación de las cantidades vendidas a través de restricciones de acceso) que rompen este vínculo distorsionan los incentivos de innovación y el consumo a corto plazo.
Como alternativa a las negociaciones o a las ofertas de «tómalo o déjalo», las subastas se utilizan habitualmente en la contratación pública. De hecho, muchos pagadores utilizan subastas de adquisiciones como esta para mercados con competencia intramolecular. En los Estados Unidos, por ejemplo, el Departamento de Asuntos de Veteranos y las Organizaciones de Compras Grupales utilizan licitaciones competitivas para adquirir suministros de medicamentos genéricos. Para los productos con patente, este enfoque es factible cuando existen varios tratamientos molecularmente distintos que, sin embargo, son sustitutos razonablemente cercanos. Este es el caso de muchas vacunas, pero rara vez se observa en otras situaciones de competencia intermolecular. En teoría, el fabricante de un producto con patente podría subastar el acceso a su tratamiento o a la propiedad intelectual asociada. Kremer (1998) propone los usos de las compras de patentes, utilizando subastas para obtener información sobre el valor del tratamiento. En la propuesta de Kremer, el gobierno pondría la propiedad intelectual en el dominio público. Los fabricantes pueden dudar en participar en la compra de patentes si existe incertidumbre sobre la capacidad de hacer cumplir las normas de propiedad intelectual.
derechos de propiedad en otros países donde no hubo compra; Organizar una compra global de patentes presenta los mismos desafíos que la financiación internacional de premios. Si bien la administración Biden presionó recientemente a los Institutos Nacionales de Salud para que ejercieran los derechos de «marcha» (Departamento de Salud y Servicios Humanos 2023), incluso estos rara vez se ejercen, y no tengo conocimiento de que el gobierno compre una patente farmacéutica.
Al menos dos ajustes incrementales a los enfoques de fijación de precios existentes podrían ser bienvenidos tanto por la industria como por los pagadores. Sood et al. (2018) brindan una descripción general del llamado modelo de Netflix, los precios de suscripción o los precios de todo lo que pueda comer. En este escenario, hay un pago fijo al fabricante por suministrar cualquier cantidad demandada a precio cero (o cercano). Es similar, por lo tanto, a comprar los derechos de patente por un período de tiempo; La diferencia con una compra de patente es que el comprador no pone la propiedad intelectual en el dominio público. Este enfoque proporciona una mayor certeza para la planificación de presupuestos, tanto para los pagadores como para los fabricantes. El pago podría escalonarse durante varios años, con el fin de suavizar los desembolsos. Debido a que la ganancia del fabricante no depende de la cantidad de unidades vendidas, existe un incentivo reducido para comercializar el producto o fomentar su uso en pacientes que es poco probable que se beneficien de él. El pagador también debe tratar de maximizar el acceso del paciente.
La información imperfecta en el momento del lanzamiento de un medicamento es la misma para el precio de suscripción que para los enfoques más tradicionales descritos anteriormente. Si bien un acuerdo de varios años brinda certeza a ambas partes, también dificulta los ajustes a la llegada de nueva información o la llegada de nuevos competidores. Este contrato también limita el incentivo para que un fabricante difunda información: si bien el marketing a menudo se critica, puede desempeñar un papel importante en la educación tanto de los médicos como de los pacientes sobre la existencia de tratamientos. Los fabricantes también pueden tener menos interés en encontrar nuevos usos terapéuticos o formulaciones mejoradas, si no esperan un aumento en las ganancias bajo el modelo de suscripción.
Australia implementó este enfoque en 2015, pagando 766 millones de dólares a cuatro fabricantes de tratamientos para la hepatitis C por acceso ilimitado a estos medicamentos durante cinco años. El análisis de la experiencia australiana sugiere que el acceso aumentó, con un costo por paciente muy por debajo del precio estimado que resultaría de las negociaciones. Los programas de Medicaid de algunos estados de EE. UU., incluidos Louisiana y Washington, también negociaron precios de suscripción para HCV. Sus experiencias ilustran que, si bien el acceso ha mejorado, el precio no es la única barrera (Conti, Frank y Gruber 2021). Por ejemplo, la detección de pacientes que necesitan tratamiento es en sí misma un desafío. Ninguno de los estados logró sus objetivos iniciales para el número de pacientes tratados.
Los contratos de pago por desempeño, basados en resultados o de riesgo compartido2 son otra mejora potencial con respecto a los precios tradicionales. En lugar de vincular el precio al valor terapéutico demostrado en ensayos o estudios disponibles en el momento en que se comercializa un medicamento, estos contratos vinculan los pagos a la realización de futuras referencias clínicas u otras métricas. La importancia de la información revelada después del mercado
La aprobación es clara. Prasad et al. (2013) concluyen que «la inversión de la práctica médica establecida es común y ocurre en todas las clases de práctica médica». Muchos estudios de seguimiento de tratamientos oncológicos, que se aprueban cada vez más en función de criterios de valoración secundarios o indirectos, no confirman los beneficios sugeridos por los resultados de ensayos clínicos anteriores (Prasad et al. 2013; Haslam et al. 2021; Mooghali et al. 2024). Boyle et al. (2021) encuentran que los «datos del mundo real» que se proporcionan actualmente sobre el uso de medicamentos contra el cáncer son demasiado escasos o de muy poca calidad para ser útiles en las decisiones de reembolso.
El atractivo de los contratos de pago por desempeño es obvio para los economistas. Si están bien diseñados, abordan la información imperfecta disponible en el lanzamiento, pero no retrasan el acceso mientras se produce información adicional; refuerzan los incentivos para que los fabricantes desarrollen tratamientos con ganancias demostrables para los pacientes; y reducen los incentivos para que los fabricantes fomenten el uso de un medicamento en pacientes que es poco probable que se beneficien. Los medicamentos de mejor rendimiento generan mayores ganancias, lo que envía las señales correctas para la inversión en innovación.
Por supuesto, los detalles de los contratos de riesgo compartido son importantes. Barros (2011) argumenta que el tratamiento excesivo de los pacientes es un riesgo, y que los efectos en el bienestar son ambiguos, para el contrato específico que modela. Los contratos que están teóricamente bien especificados pueden ser imposibles de redactar en la práctica. De hecho, existe una heterogeneidad sustancial en el diseño de contratos, en la medida en que dicha información esté disponible. (En una encuesta de la literatura sobre contratos basados en resultados de 2000 a 2019, Antonanzas et al. (2019) señalan una falta de transparencia). La medida de rendimiento puede ser a nivel de un paciente individual o más agregada. Si bien tienen la ventaja de permitir un acceso más temprano a pesar de la falta de información completa sobre el valor terapéutico, ambas partes deben acordar medidas de resultado apropiadas. Debe ser posible monitorear el desempeño, así como los factores de confusión que podrían afectar esa medida. Por ejemplo, si un paciente ajusta el comportamiento en respuesta a la creencia de que un medicamento es efectivo, esa respuesta conductual podría interferir con el rendimiento medido. En 2002, el Servicio Nacional de Salud del Reino Unido estableció un plan de riesgo compartido para cuatro tratamientos de esclerosis múltiple que se consideraron no rentables. Bajo este programa, 5000 pacientes fueron monitoreados durante un período de diez años. El acuerdo era que el fabricante de un medicamento que no lograra los beneficios sugeridos por los ensayos clínicos iniciales reembolsaría al NHS. Los resultados iniciales fueron decepcionantes e ilustraron las dificultades para monitorear los resultados de los pacientes (Boggild et al. 2009). Sin embargo, los resultados posteriores confirmaron que los tratamientos eran rentables y son recomendados por NICE (Instituto Nacional para la Excelencia en Salud y Atención 2018). Otros ejemplos de riesgo compartido incluyen el tratamiento contra el cáncer Velcade (bortezomib) en el Reino Unido y Rasilez (aliskiren) para la hipertensión en Italia (Garrison et al. 2013). Los desafíos de negociar estos contratos han obstaculizado su adopción. Los pagadores también pueden ser reacios porque la evidencia sobre los resultados de los contratos de pago por desempeño es escasa (Antonanzas et al. 2019). Neumann et al. (2011) también señalan la falta de infraestructura de datos y las dificultades
en medición. La ausencia de un registro nacional de pacientes y los pagadores fragmentados también pueden dificultar su uso en los Estados Unidos. Los avances en las tecnologías que permiten el monitoreo en tiempo real del cumplimiento y los resultados del paciente deberían reducir los costos de implementar el pago por desempeño, si se pueden superar las preocupaciones de privacidad.
Encuestas recientes realizadas por firmas consultoras en los Estados Unidos sugieren interés y adopción de contratos basados en resultados (Chatterjee et al. 2017; Avalere 2023). También se observa un aumento en el uso de contratos de riesgo compartido, tanto en los Estados Unidos como en otros lugares, en Carlson, Chen y Garrison (2017), Yu et al. (2017) y Piatkiewicz, Traulsen y Holm-Larsen (2018). Sin embargo, hay poca documentación pública de los resultados de estos acuerdos. En particular, carecemos de evidencia sistemática sobre si los ahorros de costos o las mejoras en salud realizadas compensan las dificultades de negociarlos.
El contexto más amplio del gasto farmacéutico
A pesar de la atención que reciben los precios de los medicamentos, los productos farmacéuticos no parecen ser un factor importante de los aumentos en los costos de atención médica en general, en los Estados Unidos u otros países de altos ingresos. Los medicamentos son solo un insumo en la función más amplia de producción de atención médica. El panel superior de la Figura 2, basado en datos de la OCDE, muestra que el gasto per cápita en medicamentos recetados es mucho mayor en los Estados Unidos que en otros países de altos ingresos, aunque esta brecha es menor que la de los precios de los medicamentos, como se muestra en la Figura 1. Sin embargo, el gasto de Estados Unidos en salud en general también es mucho mayor: como ilustra el segundo panel de la Figura 2, el gasto en atención médica es de casi el 18 por ciento del PIB en los Estados Unidos, pero más cerca del 11-12 por ciento en Canadá, Francia, Alemania y Japón. La proporción de productos farmacéuticos dentro del gasto en salud es, de hecho, la más baja en los Estados Unidos. Si bien el gasto en atención médica como porcentaje del PIB se mantuvo esencialmente sin cambios durante el período prepandémico de 2015 a 2019, la participación de los productos farmacéuticos en ese gasto disminuyó.Una interpretación es que los precios de otros bienes y servicios de atención médica en los Estados Unidos son relativamente más caros que los productos farmacéuticos. Por ejemplo, una encuesta reciente sobre los salarios de los médicos en todos los países en 2021 informó un promedio de $316,000 en los Estados Unidos frente a $183,000, $138,000 y $98,000 en Alemania, el Reino Unido y Francia, respectivamente (Medscape 2021). Del mismo modo, según las estadísticas de salud de la OCDE, el salario promedio de las enfermeras hospitalarias en los Estados Unidos en 2018 fue de $ 77,760, frente a $ 56,157 en Canadá, $ 55,302 en Alemania, $ 42,925 en el Reino Unido, $ 42,099 en Japón y $ 41,713 en Francia. Estados Unidos tiene un PIB per cápita más alto que otros países, y los umbrales de rentabilidad basados en el valor de una vida estadística naturalmente permitirán un precio estadounidense más alto que en Alemania, por ejemplo. Si un tratamiento farmacéutico sustituye a otro tipo de atención (por ejemplo, cirugía) o reduce el uso de otras intervenciones que son más costosas en los Estados Unidos, entonces los ahorros del sistema asociados con los medicamentos también son mayores. Dados los otros precios en el sistema de atención médica de EE. UU.,
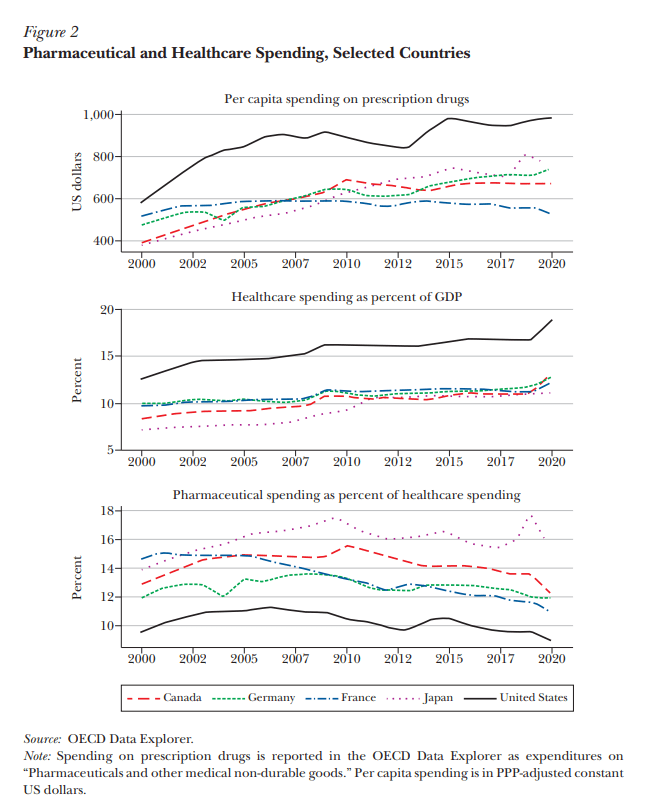
Gasto farmacéutico y sanitario, países seleccionados
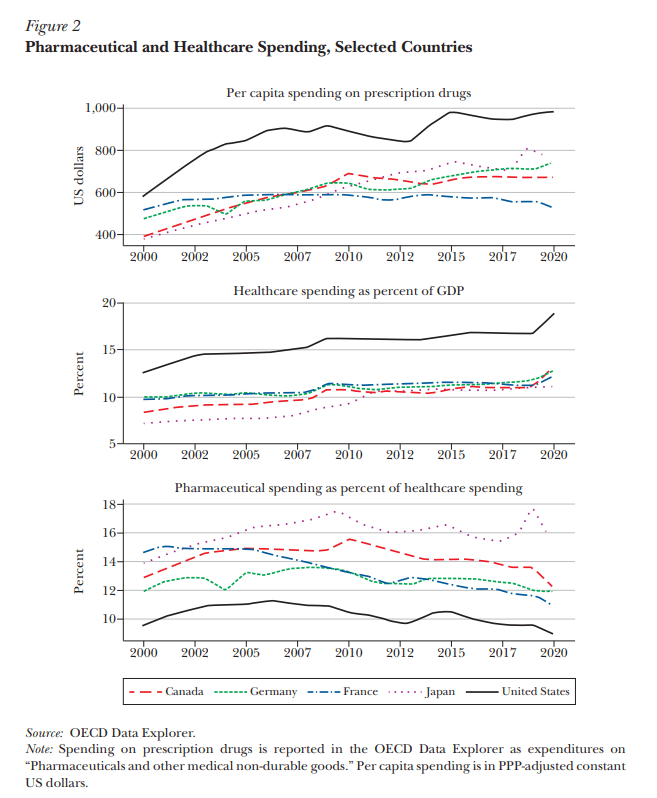
Gasto farmacéutico como porcentaje del gasto en atención médica
Fuente: Explorador de datos de la OCDE.
Nota: El gasto en medicamentos recetados se informa en el Explorador de datos de la OCDE como gastos en «Productos farmacéuticos y otros bienes médicos no duraderos». El gasto per cápita se expresa en dólares estadounidenses constantes ajustados por la PPA.
Quizás los precios de los medicamentos no sean excepcionalmente altos. Dicho de otra manera, el mercado de productos farmacéuticos puede no ser más problemático que otros insumos, y las intervenciones en el mercado de un insumo pueden introducir distorsiones inesperadas.
Las asimetrías de información y otras imperfecciones del mercado pueden dar lugar a precios distorsionados y, por lo tanto, a incentivos para la investigación y el desarrollo. La intervención de los gobiernos puede, en teoría, abordar estos problemas. Pero el desafío fundamental de valorar nuevos tratamientos permanece. Para los pagadores, los costos son visibles y
Inmediato; los beneficios pueden acumularse durante un largo período de tiempo. Los pagadores del gobierno pueden introducir distorsiones al romper el vínculo entre el valor social y las ganancias. Investigaciones anteriores han identificado distorsiones resultantes de las políticas de precios de medicamentos de Medicaid; por ejemplo, véase Duggan y Scott Morton (2006) y Alpert, Duggan y Helmerstein (2013). Esto es particularmente un riesgo cuando los presupuestos se ven presionados por la alta demanda de un producto novedoso: puede ser difícil distinguir entre productos con alta demanda porque producen resultados terapéuticamente importantes de aquellos con alta demanda debido al riesgo moral o defensores de pacientes bien organizados. Negar la cobertura también puede ser políticamente tenso. Después de que el Instituto Nacional para la Excelencia Clínica recomendara no reembolsar varios medicamentos contra el cáncer, el Reino Unido estableció el Fondo de Medicamentos contra el Cáncer para pagarlos en respuesta a las protestas de los pacientes y los desafíos legales (Aggarwal, Ginsburg y Fojo 2014). Los análisis posteriores generalmente concluyen que esta financiación no proporcionó valor a los pacientes con cáncer del Reino Unido (Aggarwal et al. 2017). Presiones políticas similares pueden influir en las decisiones de Medicare en los Estados Unidos, donde las advertencias sobre los «paneles de la muerte»3 (comités de burócratas que determinan si los pacientes tendrán acceso a la atención) han resonado durante mucho tiempo. La competencia de medicamentos genéricos en los Estados Unidos es generalmente sólida, con una rápida entrada y descensos de precios después del vencimiento de la patente. Esto es exactamente lo que predice la teoría económica: las altas ganancias se eliminan cuando se reducen las barreras de entrada y los productos no se diferencian. Los márgenes de muchos productos genéricos son muy pequeños (tan pequeños que la salida de los fabricantes ha creado escasez, particularmente en algunos mercados de productos inyectables). De hecho, como se señaló en la introducción, los precios de los genéricos en los Estados Unidos son más bajos que en los países pares. Los altos precios pagados por los consumidores estadounidenses durante el plazo limitado de la patente se compensan al menos en parte con el beneficios de precios bajos más adelante.
La Oficina de Contabilidad General estimó que el margen de beneficio promedio de las compañías farmacéuticas más grandes fue del 15 al 20 por ciento de 2006 a 2015, frente al 4 al 9 por ciento en las 500 empresas más grandes (Oficina de Responsabilidad del Gobierno 2017). La Oficina de Presupuesto del Congreso informó que las empresas farmacéuticas que cotizan en bolsa con sede en EE. UU. gastaron un promedio de más del 19 por ciento de los ingresos netos en investigación y desarrollo entre 2000 y 2019, mucho más alto que el promedio del 3 por ciento para el Índice de Mercado Total de S&P e incluso por encima de otros sectores innovadores como software y semiconductores (Oficina de Presupuesto del Congreso 2021). Los grupos de presión de la industria a veces justifican los precios de los medicamentos señalando estos grandes gastos de investigación y desarrollo. Esas inversiones se realizan con la expectativa de ganancias futuras; no deben ser una justificación después del hecho. Sin embargo, las políticas que reducen las ganancias esperadas reducen el gasto en investigación y desarrollo y, por extensión, la innovación (Acemoglu y Linn 2004; Filson 2012; Blume-Kohout y Sood 2013; Dubois et al. 2015). El tamaño y la importancia del mercado estadounidense hacen que estos cambios de política sean mucho más significativos que en la mayoría de los demás países. Tenemos poca evidencia sobre el valor de la investigación y el desarrollo marginales que se sacrifican, aunque Dranove, Garthwaite, Sarah Palin, ex candidata republicana a la vicepresidencia, usó por primera vez este término durante el debate sobre la Ley del Cuidado de Salud a Bajo Precio. y Hermosilla (2022) y Finkelstein (2004) sugieren que los aumentos en el tamaño esperado del mercado inducidos por los cambios de política en los Estados Unidos no desencadenaron una innovación científicamente novedosa. Las políticas que dirigen las recompensas a productos más innovadores a través de una exclusividad más prolongada, como para los medicamentos huérfanos, o a través de una aprobación regulatoria más rápida, como la designación de terapia innovadora de la Administración de Alimentos y Medicamentos de los Estados Unidos, parecen haber tenido más éxito en este sentido (Yin 2008; Chandra et al. 2024).
Las propias empresas pueden tener dificultades para identificar qué productos pueden ser los más rentables. No solo enfrentan riesgos técnicos durante el proceso de desarrollo de medicamentos, sino que también enfrentan riesgos de mercado si un producto completa los ensayos clínicos. Wouters, McKee y Luyten (2020) no encuentran correlación entre los costos de investigación y desarrollo asociados con productos específicos y sus precios. Los informes de las firmas consultoras encuentran que los lanzamientos de nuevos medicamentos a menudo no cumplen con las expectativas de los analistas (McKinsey & Company 2013; Deloitte Center for Health Solutions 2020), con una mala colocación en el formulario o exclusiones del formulario como explicación en muchos casos. Una mayor claridad de los pagadores podría reducir esta incertidumbre y permitir a las empresas dirigir sus esfuerzos de manera más eficiente.
Para lograr mejores resultados que en el sistema actual, los formuladores de políticas deben centrarse en algo más que reducir el precio promedio pagado o el gasto total. Aceptar precios más altos en medicamentos efectivos (compensados por la reducción de las recompensas a terapias ineficaces) y valorar los beneficios a largo plazo acumulados con el tiempo, debería resultar en un uso más eficiente e incentivos de innovación. A diferencia de muchas otras innovaciones en salud, los productos farmacéuticos tienen bajos costos de transporte, son fáciles de adoptar y entregar, y ven grandes reducciones de precios dentro de los 10 a 15 años posteriores a su introducción. Su potencial en el tratamiento de enfermedades como el Alzheimer, la obesidad y otras justifica al menos mantener, si no aumentar, los incentivos para la inversión. Sin embargo, los desafíos informativos y políticos no son triviales. Abordar algunas de las fricciones o imperfecciones descritas aquí también debería aumentar la eficiencia.
