- Alex Pace ,Weston Roda ,Corrina Poon ,Hugh J. McMillan ,María Oskoui ,Alex MacKenzie ,Pranesh Chakraborty yJeff Round

Abstracto
Fondo
La atrofia muscular espinal (AME) es un trastorno neuromuscular causado por la pérdida del gen SMN1 , con una prevalencia estimada al nacer de aproximadamente 1 por 10 000. La intervención temprana con terapias modificadoras de la enfermedad (TME) mejora significativamente los resultados. Este estudio evalúa las implicaciones económicas y los beneficios para la salud del cribado neonatal (CNS) para la AME en Canadá desde una perspectiva social.
Métodos
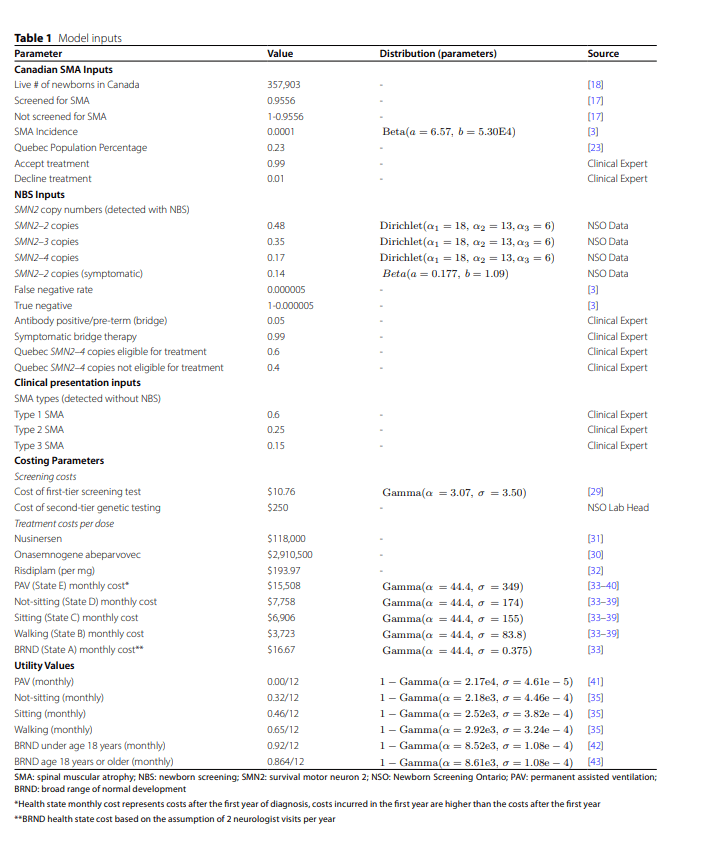
Se desarrolló un modelo analítico de decisiones que combinó un árbol de decisiones para el algoritmo de cribado y un modelo de Markov para los resultados de salud a largo plazo. El modelo de Markov incluyó estados de salud basados en los hitos motores de la OMS. La cohorte poblacional de 357.903 recién nacidos vivos refleja los nacimientos de 2022 a 2023 en Canadá. El cribado se realiza mediante análisis de sangre seca que evalúa las deleciones bialélicas en SMN1 . Los costos incluyeron los costos del tratamiento y del estado de salud, mientras que los valores de utilidad reflejaron la calidad de vida en cada estado de salud.
Resultados
Se espera que el NBS para la AME identifique 37,1 (IC del 95 %: 15,0; 70,7) recién nacidos anualmente en Canadá. Nuestro análisis a lo largo de la vida y una tasa de descuento del 1,5 % muestra que el NBS y el tratamiento temprano tienen un coste incremental de -146 187 000 USD (IC del 95 %: -249 773 777 a -17 890 034 USD) y un beneficio incremental de 872 (IC del 95 %: -193; 2329 USD) años de vida ajustados por calidad (AVAC), en comparación con la ausencia de NBS y el tratamiento tardío. Esto resultó en un valor medio de RCEI de -173 572 USD/AVAC.
Conclusión
El modelo de análisis de decisiones indicó que, en general, la atención en la red permite ahorrar costos y es más eficaz que no realizarla y que el tratamiento tardío en el sistema de salud canadiense.
Fondo
La atrofia muscular espinal (AME) es un trastorno neuromuscular autosómico recesivo grave causado por la pérdida del gen SMN1 (supervivencia de la neurona motora 1 ). Este defecto genético provoca la degeneración progresiva de las neuronas motoras, causando debilidad y atrofia muscular significativas. Se estima que la deleción homocigótica de SMN1 causa el 95 % de los casos de AME, mientras que el 5 % restante se debe a mutaciones patogénicas de sentido erróneo o sin sentido en SMN1 [ 1 ].
La AME se clasifica en varios tipos según la gravedad y la aparición de los síntomas. La forma más grave, la AME tipo 1, se manifiesta durante los primeros seis meses de vida y provoca una rápida progresión de debilidad muscular, insuficiencia respiratoria y, a menudo, la muerte si no se trata durante los dos primeros años de vida. La AME tipo 2 se caracteriza por la aparición de los síntomas durante los primeros 18 meses de vida. Los pacientes con AME tipo 2 suelen poder sentarse sin ayuda, aunque, sin tratamiento, no se espera que caminen sin ella. Los síntomas de la AME tipo 3 suelen comenzar después de los 18 meses de vida, y los niños finalmente logran caminar [ 1 , 2 ].
La incidencia de AME es de aproximadamente 1 en 10.000 nacidos vivos, con una prevalencia de 1 a 2 por 100.000 individuos [ 3 , 4 ]. Aunque estudios piloto canadienses recientes han informado tasas de incidencia variables de AME, que van desde 1 en 9.000 a 1 en 27.000, la corta duración de estos programas de detección dificulta determinar la verdadera incidencia de AME en Canadá [ 5 , 6 ]. Los avances recientes en terapias modificadoras de la enfermedad (DMT) han alterado significativamente el pronóstico para individuos con AME. Tres DMT: nusinersen (Spinraza), onasemnogene abeparvovec (Zolgensma) (OA) y risdiplam (Evrysdi) han sido aprobados para su uso y reembolso en Canadá. Los ensayos clínicos han demostrado que una intervención temprana con estas terapias conduce a mejores resultados, incluida una mejor función motora y el logro de los hitos del desarrollo [ 7 , 8 , 9 ]. Estos ensayos clínicos también demostraron que el tratamiento presintomático tiene el mayor impacto en la supervivencia y el desarrollo de los hitos motores, y el mayor beneficio se produce cuando el tratamiento se inicia antes del primer síntoma [ 10 ].
En Canadá, la detección de la AME se ha adoptado cada vez más, y diez de las trece provincias y territorios implementan el programa, que cubre al 95,56 % de los recién nacidos canadienses hasta la fecha [ 11 ]. A pesar de los evidentes beneficios clínicos, actualmente se desconocen las implicaciones económicas del cribado neonatal generalizado (CND) para la AME en Canadá. Para abordar esta deficiencia, este estudio exploró los costos a lo largo de la vida y los efectos en la salud del CND para la AME con tratamiento temprano, en comparación con la ausencia de CND y el tratamiento tardío, en el contexto canadiense.
Métodos
Objetivo del estudio
Este estudio tuvo como objetivo estimar los costos de por vida y los efectos en la salud del NBS para la AME con tratamiento temprano versus ningún NBS y tratamiento tardío, dentro del contexto canadiense desde la perspectiva social.
Estructura del modelo
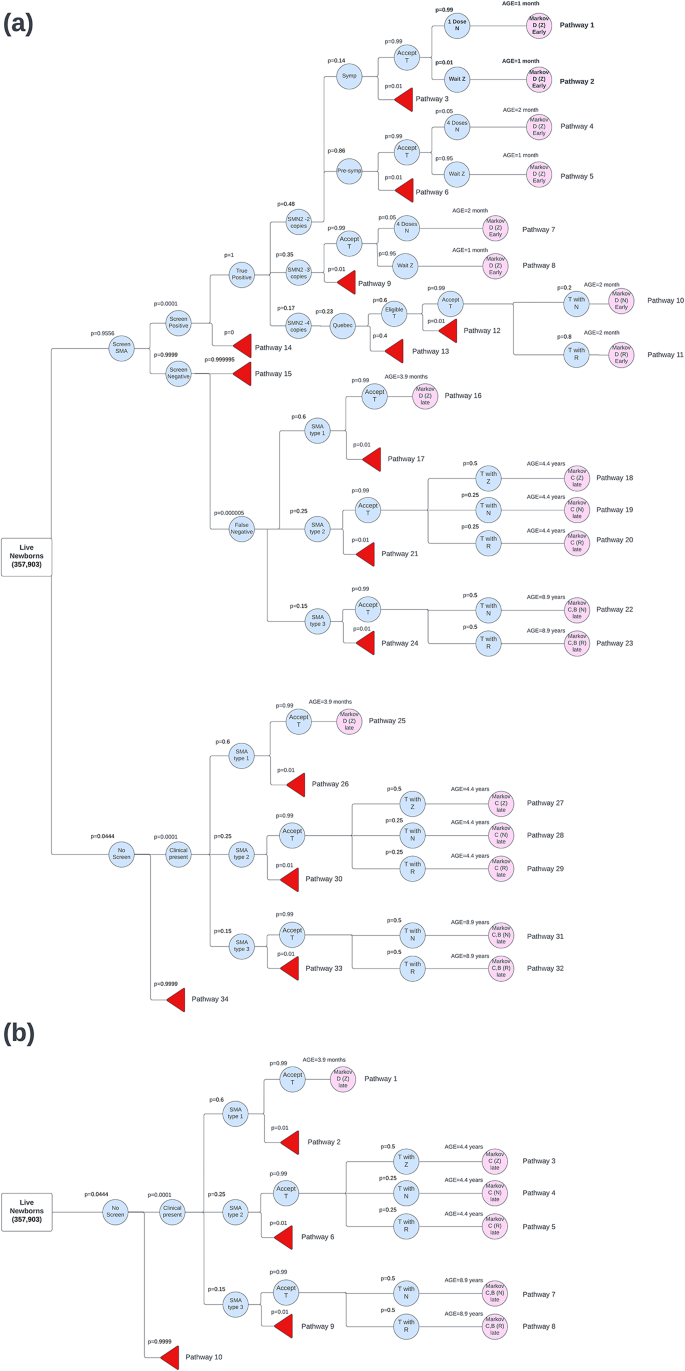
Desarrollamos un modelo analítico de decisiones para estimar la relación coste-utilidad del cribado neonatal para la AME. La estructura del modelo es una combinación de árbol de decisión y modelo de Markov. El componente de árbol de decisión representa el algoritmo de cribado neonatal en Canadá, capturando los costes asociados. El componente de Markov es un modelo de transición de estado para estimar los resultados de salud a largo plazo y los costes de vida de las personas con AME.
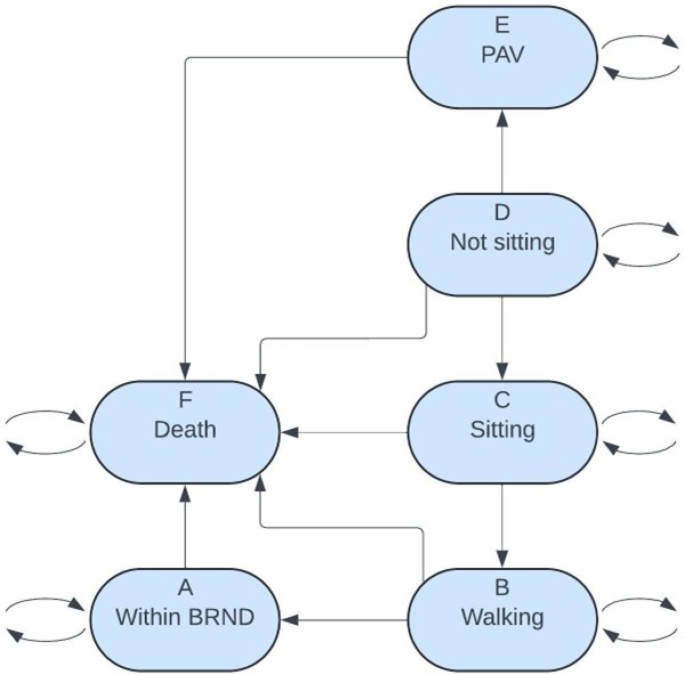
Los estados de salud del modelo de Markov se desarrollaron utilizando los logros de los hitos motores de la Organización Mundial de la Salud (OMS) de bebés sanos [ 12 ]. El modelo incluye los siguientes estados de salud: ventilación asistida permanente (PAV) (Estado E), no sentado (Estado D), sentado (Estado C), caminando (Estado B), amplio rango de desarrollo normal (BRND) (Estado A) y muerte (Estado F). Estos estados de salud son consistentes con los modelos de Markov de SMA anteriores [ 13 , 14 ]. Los pacientes identificados a través de NBS ingresan al modelo en el estado no sentado al mes de edad, ya que no han alcanzado ningún hito motor hasta la fecha; este es el momento en que serían elegibles por primera vez para recibir tratamiento. Los costos aplicados en el estado no sentado dependen de la edad del paciente. Se espera que un paciente se siente a los 9 meses de edad, según el percentil 99 de logro del hito motor de la OMS [ 12 ]. Si el paciente tiene menos de 9 meses, se aplican los costos y la utilidad de BRND (Estado A), ya que se considera un desarrollo normal. Si el paciente tiene más de 9 meses, se aplican los costos de no estar sentado, que incluyen las visitas médicas y los costos del cuidador, y la utilidad. De igual manera, dado que se espera que un paciente camine a los 18 meses, en los estados de estar sentado y caminar, se aplican los costos y la utilidad de BRND si el paciente tiene menos de 18 meses. Quienes no fueron evaluados, o no fueron evaluados, ingresan al modelo en diferentes estados según la gravedad de su enfermedad.
Los pacientes con AME tipo 1 que se presentan clínicamente entran al modelo en el estado no sentado a los 3,9 meses de edad. Los pacientes con AME tipo 2 que se presentan clínicamente entran al estado sentado a los 4,4 años de edad. Los pacientes con AME tipo 3 que se presentan clínicamente entran al estado de caminar (76%) o sentado (24%) a los 8,9 años de edad. Las edades de presentación clínica se determinaron a partir de ensayos clínicos [ 15 , 16 ]. La evidencia de ensayos clínicos también se utilizó para estimar las probabilidades de transición a través del modelo de Markov. Los detalles de la estimación de las probabilidades de transición se describen con más detalle en la sección de Entradas Clínicas. Se utilizó una longitud de ciclo de 1 mes en el modelo de Markov para capturar con mayor precisión los cambios de los hitos motores de los niños a lo largo del tiempo. Se modeló un horizonte de vida para el análisis del caso base, con el modelo funcionando durante 80 años (960 meses). Los costos y los resultados de salud se descontaron al 1,5% [ 17 ].
Cohorte de población
La cohorte poblacional consistió en 357,903 recién nacidos vivos, según el número de nacimientos en Canadá durante el período 2022-2023 [ 18 ]. En el momento del análisis, 10 provincias de Canadá realizaban pruebas de detección de AME, lo que abarcaba el 95,56% de la población neonatal [ 19 ]. Nuestro modelo incluye recién nacidos sometidos a pruebas de detección y no sometidos a ellas, y la gran mayoría (95,56%) se sometió a pruebas de detección de AME. Los recién nacidos identificados mediante pruebas de detección podrían ser presintomáticos o sintomáticos en el momento de la prueba. Aquellos no identificados mediante NBS fueron diagnosticados clínicamente y presentaban síntomas en el momento del diagnóstico.
Parámetros del árbol de decisión/selección
Se toma una muestra de detección de gota de sangre seca (GDS) dentro de las 48 h posteriores al nacimiento y se analiza utilizando tecnología MassArray para detectar la deleción homocigótica del gen SMN1 , que representa el 95% de los casos de AME. Los resultados positivos de la detección se confirman utilizando una prueba de reacción en cadena de la polimerasa de gotas digitales (ddPCR), que se enfoca en diferencias de secuencia específicas únicas para cada gen y las cuantifica, lo que permite la determinación del número de copias de SMN2 [ 20 ]. Algunas mutaciones puntuales de SMN1 pueden no identificarse a través de la detección inicial de GDS, que se estima que ocurre en el 5% de los casos de AME [ 3 ]. Por lo tanto, asumimos una tasa de falsos negativos del 5%, y estos casos no detectados por NBS se identifican a través de la presentación clínica. Dado que el NBS para AME en Canadá se ha implementado recientemente, utilizamos la tasa de incidencia comúnmente referenciada de 1 en 10,000 recién nacidos para aquellos diagnosticados con AME [ 3 ]. Después de la implementación de la detección de AME en Ontario en enero de 2020, Newborn Screening Ontario (NSO) no ha informado de falsos positivos. Esto se sustenta en la alta especificidad del algoritmo de dos niveles y el requisito de confirmación molecular antes del diagnóstico o tratamiento. El uso de esta estrategia de pruebas secuenciales reduce sustancialmente la probabilidad de falsos positivos, un resultado que ha sido consistente con informes de programas similares a nivel internacional [ 3 , 14 ].
La supervivencia y la gravedad de la enfermedad varían ampliamente según el tipo de AME y el número de copias del gen SMN2 [ 1 ]. Los pacientes que se sometieron a la detección se clasifican por su número de copias del gen SMN2 y pueden ser sintomáticos o presintomáticos. Según los datos de NSO sobre la detección de AME en el momento de este estudio que comenzó en 2020, la distribución del número de copias de SMN2 entre los pacientes con AME de Ontario es la siguiente: el 48% tiene 2 copias, el 35% tiene 3 copias y el 17% tiene 4 copias. Entre estos, el 14% presentó síntomas en la detección. La distribución de los tipos de AME para aquellos que se presentan clínicamente se determinó a partir de las opiniones de expertos clínicos, con porcentajes del 60%, 25% y 15% para los tipos de AME 1, 2 y 3, respectivamente.
Tras revisar los datos de la NSO y consultar con expertos clínicos, observamos casos en los que los padres de pacientes con diagnóstico de AME habían rechazado el tratamiento. Por consiguiente, incorporamos un grupo al árbol de decisión donde el 1% de los pacientes rechazaría el tratamiento, tanto en el grupo de cribado como en el de no cribado.
También incluimos el tratamiento de terapia puente en el árbol de decisión, una técnica que se está implementando actualmente en el tratamiento de pacientes canadienses con AME diagnosticados a través de NBS [ 21 ]. Hay dos escenarios distintos para la implementación del tratamiento puente. En primer lugar, cuando un paciente tiene 2 copias del gen SMN2 y es sintomático al nacer, recibe una dosis de nusinersén en el primer mes de vida, seguida de tratamiento con OA. Se estimó que esto ocurre en el 99% de los pacientes con NBS que se presentan como sintomáticos en la selección, según la consulta con expertos. El segundo escenario involucra a pacientes con AME nacidos prematuros o que son positivos para anticuerpos contra el vector del serotipo 9 adenoasociado (AAV9) [ 21 , 22 ]. En este caso, reciben cuatro dosis de nusinersén antes del tratamiento con OA. En el grupo de NBS, se estimó que este escenario ocurre en el 5% de los pacientes presintomáticos, mientras que el 95% restante de los pacientes presintomáticos en el grupo de NBS fueron tratados solo con OA. Sin embargo, la terapia puente no se aplicó al grupo sin detección, ya que estos pacientes se presentan clínicamente más tarde en la vida.
Para los pacientes con 4 copias del gen SMN2 , su tratamiento en el modelo sigue el protocolo vigente en Canadá, basado en las aprobaciones de medicamentos. Los pacientes con 4 copias de SMN2 no están aprobados para el tratamiento en las provincias o territorios canadienses, excepto en la provincia de Quebec. Por lo tanto, en el grupo de 4 copias de SMN2 , el 23 % de los pacientes fueron elegibles para el tratamiento, lo que representa la población de Quebec [ 23 ]. Según la opinión de expertos, el 60 % de esta población recibiría tratamiento: el 80 % con risdiplam y el 20 % con nusinersén.
Para los pacientes en la rama de diagnóstico clínico del árbol de decisión, el protocolo de tratamiento varía. En el modelo, todos los pacientes con AME tipo 1 reciben tratamiento con OA. En el caso de los pacientes con AME tipo 2, el 50 % recibió tratamiento con OA, el 25 % con nusinersén y el 25 % con risdiplam. En el caso de los pacientes con AME tipo 3, el 50 % recibió nusinersén y el 50 % recibió risdiplam. Estos porcentajes se basaron en consultas con neurólogos pediátricos. Los resultados del progreso a través del árbol de decisión determinan el estado de salud inicial de los individuos al ingresar al modelo de Markov (Fig. 1 ).
Aportes clínicos
El modelo de Markov se desarrolló utilizando datos de ensayos clínicos a corto plazo y estimaciones de supervivencia a largo plazo. Se utilizaron datos de ensayos clínicos sobre el tratamiento de la AME con DMT aprobados por Health Canada para estimar la efectividad clínica. Las probabilidades de transición entre los estados de Markov, que representan el desarrollo de los hitos motores, se calcularon utilizando los resultados de ensayos relevantes [ 7 , 8 , 15 , 16 ]. Derivamos las tasas de riesgo de los datos de ensayos clínicos y de supervivencia a largo plazo y estas tasas de riesgo son entradas en la matriz de tasa de transición, , donde es el tiempo en meses. Esta matriz de tasa de transición, , se encuentra en la Tabla A1 . Usamos la fórmula para obtener la matriz de probabilidad de transición, . es la matriz de probabilidad de transición pasos de tiempo hacia adelante y es la matriz exponencial de la matriz . Un paso de tiempo de un mes en el modelo de Markov está dado por , donde es la cadena de Markov con los 6 estados: A (dentro de BRND), B (caminando), C (sentado), D (no sentado), E (PAV) y F (muerte). El modelo de Markov y los estados de salud se muestran en la Fig. 2 . Los datos de los ensayos clínicos informaron el estado inicial en el que los pacientes ingresaron al modelo de Markov, y estos ensayos determinaron el logro de los hitos motores durante la vida de un paciente. Se utilizaron estudios de la historia natural de la AME y tablas de vida canadienses para determinar la supervivencia a largo plazo de los pacientes del modelo. Debido a que los ensayos solo incluyeron pacientes con SMN2 de 3 copias, se utilizaron los datos de pacientes con SMN2 de 3 copias a falta de datos de pacientes con SMN2 de 4 copias.
El tratamiento posterior a la detección temprana entre pacientes con SMN2 de 2 y 3 copias se modeló utilizando datos del ensayo SPR1NT [ 8 ]. Este ensayo investigó el tratamiento temprano en niños con SMN2 de 2 y 3 copias dentro del primer mes de vida, que recibieron tratamiento con OA. Con base en la consulta con expertos clínicos, se asumió que todos los niños con SMN2 de 2 y 3 copias diagnosticados por NBS serían tratados con OA durante el primer ciclo del modelo (primer mes de vida). Para los pacientes con SMN2 de 4 copias, se utilizaron datos del ensayo NURTURE [ 7 ]. El ensayo NURTURE evaluó el tratamiento temprano en niños con SMN2 de 2 y 3 copias, tratados con nusinersen. Asumimos datos de SMN2 de 3 copias para los pacientes con SMN2 de 4 copias. Hasta la fecha, no existen ensayos clínicos de risdiplam que describan completamente el logro de hitos motores para pacientes individuales; por lo tanto, asumimos que la eficacia de nusinersen es equivalente a risdiplam.
Los pacientes del NBS ingresaron al modelo de Markov en el estado de salud D (no sentado), ya que no estaban sentados en el momento del diagnóstico. Este enfoque es consistente con estudios previos [ 13 , 14 ]. Para estimar con mayor precisión la tasa de mortalidad, los costos de por vida y los años de vida ajustados por calidad (AVAC) en el estado de salud D, si la edad de un paciente dentro del estado de salud D estaba dentro del percentil 99 del logro del hito motor para sentarse (aproximadamente 9 meses), entonces se aplicaron la tasa de mortalidad, los costos y los AVAC del estado de salud A (BRND) [ 12 ]. Si la edad de un paciente dentro del estado de salud D estaba fuera de este percentil, entonces se aplicarían la tasa de mortalidad, los costos y los AVAC del estado de salud D no sentado. De manera similar para el estado de salud C, si la edad de un paciente dentro del estado de salud C estaba dentro del percentil 99 del logro del hito motor para caminar (aproximadamente 18 meses), entonces se aplicaron la tasa de mortalidad, los costos y los AVAC del estado de salud A [ 12 ]. Si estaba fuera de este percentil, entonces se aplicarían la tasa de mortalidad, los costos y los AVAC del estado de salud C. Dado que el estado de salud A es el estado BRND de caminar, si un paciente permanece en el estado de caminar B después de los 18 meses de edad, se aplican los costos y los AVAC del estado de salud B del estado de salud B. De lo contrario, si la edad es menor de 18 meses en el estado B, entonces se aplicaron los costos y los AVAC del estado de salud A. Se asume que la tasa de mortalidad del estado de salud A y B es la misma. Un diagrama que ilustra la tasa de mortalidad, los costos y los AVAC asumidos dentro de los estados de salud basados en la edad del paciente y el logro esperado del hito motor se incluye en el apéndice complementario, artículo 2.
Los pacientes que se presentan clínicamente en el modelo (no evaluados o no detectados por el NBS) son tratados según su subtipo de AME. Todos los pacientes con AME tipo 1 reciben tratamiento con OA, utilizando datos de ensayos clínicos del ensayo STR1VE, e ingresan al modelo de Markov en el estado de salud D (no sentado) [ 16 ]. El ensayo STR1VE reclutó a pacientes diagnosticados con AME tipo 1, con una edad media de 3,9 meses. Para los pacientes con AME tipo 2 y tipo 3, los datos de ensayos clínicos se tomaron del estudio CS2/CS12. El ensayo CS2/CS12 reclutó a pacientes con AME tipo 2 y 3 de entre 2 y 15 años, que fueron tratados con nusinersén [ 13 ]. No hubo datos de logro de hitos motores para pacientes individuales de ensayos clínicos que evaluaron el tratamiento tardío con OA o risdiplam; por lo tanto, asumimos que los resultados del tratamiento de nusinersén son iguales para OA y risdiplam. La edad promedio de inicio del tratamiento con nusinersen es de 4,4 años para la AME tipo 2 y de 8,9 años para la AME tipo 3 en el ensayo CS2/CS12. Estas edades se utilizan como edades de inicio para el primer ciclo en el modelo de Markov para pacientes con AME tipo 2 y tipo 3. Todos los pacientes con AME tipo 2 ingresaron en el estado de salud C (sentado), y el 24% de los pacientes con AME tipo 3 ingresaron en el estado de salud C (sentado) y el 76% de los pacientes con AME tipo 3 ingresaron en el estado de salud B (caminando), respectivamente, según los datos de hitos motores del ensayo clínico CS2/CS12. Siguiendo el mismo procedimiento que el grupo NBS, el grupo de presentación clínica también tiene los costos de vida y los AVAC ajustados en función de su edad y el percentil 99 de la información de logro de hitos motores. Para los pacientes con AME tipo 1 que se presentan clínicamente, la utilidad BRND (Estado A) se aplica durante los primeros 3,9 meses antes de que el paciente con AME tipo 1 entre en el modelo de Markov en el estado no sentado. Para los pacientes con AME tipo 2 que se presentan clínicamente, la utilidad BRND (Estado A) se aplica durante los primeros 18 meses y luego la utilidad Sentado (Estado C) se aplica durante los siguientes 35 meses antes de que el paciente con AME tipo 1 entre en el modelo de Markov en el estado sentado. Para los pacientes con AME tipo 3 que se presentan clínicamente, la utilidad BRND (Estado A) se aplica durante los primeros 18 meses y luego durante los siguientes 89 meses el 24% de la utilidad proviene de Sentado (Estado C) y el 76% de la utilidad proviene de Caminando (Estado B) antes de que el 24% de los pacientes con AME tipo 3 entren en el modelo de Markov en el estado sentado y el 76% de los pacientes con AME tipo 3 entren en el modelo de Markov en el estado caminando. Se determinaron datos de supervivencia a largo plazo para cada estado de salud, incluyendo pacientes con riesgo de transición a PAV o fallecimiento. Para los estados de salud BRND y de marcha, la transición a fallecimiento se determinó con base en las tablas de mortalidad canadienses de Statistics Canada [ 24 ]. La transición del estado de sedestación a fallecimiento se basó en la historia natural de pacientes con AME tipo 2/3, según lo publicado por Zerres et al. [ 25].]. La transición de no estar sentado a la muerte se deriva de dos estudios de historia natural de pacientes con AME tipo 1, según lo informado por Finkel et al. y Kolb et al. [ 26 , 27 ]. Por último, la transición de “PAV” a la muerte se obtuvo de Gregoretti et al. [ 28 ].
Entradas de costos
El costo del NBS para la AME se divide en costos de tratamiento y costos del estado de salud. Los costos del tratamiento incluyen la prueba de detección mediante DBS, cualquier prueba genética adicional para pacientes con AME positiva y los costos asociados con los TME.
El costo de la prueba de detección de DBS se obtuvo de la Lista de Beneficios de Ontario para Servicios de Laboratorio, con un costo listado de $10.76 CAD por neonato [ 29 ]. La mayor parte de este costo se atribuye a la documentación y recolección del paciente. La prueba genética utilizada para confirmar una prueba de DBS anormal en NSO es ddPCR, que cuesta $250 CAD por prueba, según la opinión experta del jefe de Laboratorio de NSO. Los costos de los DMT se obtuvieron de las revisiones de reembolso de la Agencia Canadiense de Medicamentos (CDA): OA a $2,910,500 CAD por dosis única, nusinersen a $118,000 CAD por dosis y risdiplam a $193.97 CAD por miligramo [ 30 , 31 , 32 ].
Los costos del tratamiento con nusinersén incluyeron las cuatro dosis de carga dentro de los primeros 63 días tras la dosis inicial, seguidas de una dosis cada cuatro meses durante la vida del paciente. Además, incorporamos el costo de la terapia puente, que incluye una dosis única de nusinersén antes del tratamiento posterior con OA, como se demostró en pacientes con AME con resultado positivo en la prueba de detección que presentaron síntomas al nacer. Los costos de la terapia puente también se aplicaron a un pequeño porcentaje (5%) de pacientes con anticuerpos positivos o nacidos prematuros, que recibieron cuatro dosis de carga antes del tratamiento con OA [ 21 , 22 ].
Los costos del tratamiento con risdiplam varían durante los dos primeros años. Para quienes recibieron risdiplam antes de los dos años, el costo anual fue de $93,456 CAD. Para los mayores de dos años que requirieron una dosis mayor, el costo anual fue de $354,000 CAD [ 32 ]. Los parámetros completos de evaluación y costos del tratamiento se incluyen en la Tabla 1 .
Los costos del estado de salud se estructuraron utilizando los cinco estados de salud incluidos, reflejando los logros de los hitos motores de la OMS en niños y el estado de muerte. Estos costos se determinaron mediante una búsqueda bibliográfica sobre la utilización de recursos por parte de pacientes con AME y se desglosaron en costos mensuales por estado de salud, para reflejar la duración del ciclo del modelo.
El estado de salud más grave es el Estado E (PAV) que incluye los costos relacionados con los pacientes con AME tipo 1 que requieren ventilación mecánica durante más de 16 h diarias. El siguiente estado de salud es el Estado D (no sentado) donde se aplicaron los costos de AME tipo 1, ya que este estado representa el resultado esperado del hito motor de la historia natural de los pacientes con AME tipo (1) El tercer estado de salud es el Estado C (sentado) donde se aplicaron los costos de AME tipo 2, ya que este estado representa el logro esperado del hito motor de la historia natural para los pacientes con AME tipo (2) El cuarto estado de salud es el Estado B (caminando) donde se aplicaron los costos de AME tipo 3, ya que este estado representa el logro esperado del hito motor de los pacientes con AME tipo 3. El estado de salud final es el estado A BRND donde asumimos, con base en la opinión de expertos, el costo de dos visitas al neurólogo por año.
Los costos incluidos en los estados de salud se dividieron en costos directos del sistema de salud, costos directos de bolsillo pagados por los pacientes o cuidadores y costos indirectos. Los costos del sistema de salud consistieron en visitas al médico, hospitalización en el primer año y años posteriores, atención ambulatoria, visitas al departamento de emergencias, nutrición artificial y ventilación asistida permanente [ 33, 34, 35, 36, 37, 38, 39, 40 ] . Los costos para los pacientes y cuidadores incluyen viajes a citas de AME, servicios profesionales de salud aliados y dispositivos de asistencia [ 35 ]. Los costos indirectos consideraron la pérdida de ingresos potenciales debido al diagnóstico de AME, incluida la pérdida de productividad del cuidador durante la duración del modelo y la pérdida de productividad del paciente a partir de los 18 años de edad [ 35 , 40 ]. Los costos mensuales y anuales por estado de salud se pueden encontrar en la Tabla 1. El desglose completo de los costos del estado de salud se puede encontrar en el apéndice complementario.
Valores de utilidad
A cada estado de salud incluido en el modelo se le asignó un valor de utilidad para reflejar la calidad de vida asociada con el tiempo transcurrido en ese estado de salud. Los pacientes acumulan beneficios de salud por el tiempo transcurrido en un estado de salud, donde un AVAC es igual a un año completo vivido en plena salud. Los valores de utilidad para cada estado de salud se obtienen de la literatura canadiense sobre la calidad de vida de los pacientes con AME y se informan en la Tabla 1 [ 35 , 41 , 42 , 43 ]. Los valores de desutilidad se distribuyen Gamma para permitir la posibilidad de valores de utilidad negativos, lo que indica una condición de estado de salud peor que la muerte. El estado PAV, No sentado y el estado Sentado son los estados de salud que principalmente tienen la posibilidad de valores de utilidad negativos de las distribuciones enumeradas en la Tabla 1 .Tabla 1 Entradas del modelo
Incertidumbre
La incertidumbre en las entradas del modelo se abordó mediante análisis de sensibilidad probabilísticos y deterministas. Los resultados del análisis de sensibilidad probabilístico (ASP), basado en 1000 simulaciones del modelo, se presentan como análisis del caso base. Se realizó un análisis de sensibilidad determinista adicional para los parámetros clave, variando sistemáticamente los parámetros de entrada clave para identificar los que tuvieron el mayor impacto en el modelo [ 44 ].
Software
El análisis se completó utilizando RStudio versión 2023.12.0. El paquete ‘juicr’ y el método GUI_juicr se utilizaron para extraer los datos de los ensayos clínicos relevantes [ 7 , 8 , 15 , 16 ]. El método flexsurvreg en el paquete ‘flexsurv’ se utilizó para ajustar seis funciones de supervivencia diferentes (exponencial, Weibull, Gompertz, log-logística, log normal, gamma generalizada) a los datos del ensayo clínico. El método AICc en el paquete ‘gamlr’ se utilizó para determinar cuál de los seis resultados de ajuste de funciones de supervivencia diferentes tenía el valor AIC corregido mínimo. El valor AIC corregido se utilizó ya que el número de parámetros a ajustar en las funciones de supervivencia era menor que el número de observaciones dividido por 40 [ 45 ]. La función de supervivencia que tenía el valor AIC corregido mínimo se seleccionó como la función de supervivencia de mejor ajuste a los datos. El algoritmo afín invariante de conjunto MCMC se utilizó para ajustar una función de supervivencia de Weibull a los estudios de supervivencia a largo plazo [ 46 ]. La función de riesgo correspondiente a la función de supervivencia ajustada se utilizó como tasa de transición. El método rdirichlet en el paquete ‘extraDistr’ se utilizó para generar muestras aleatorias de la distribución de Dirichlet para la probabilidad de que los pacientes sean copias SMN2 -2, copias SMN2 -3 y copias SMN2 -4. El método expm en el paquete ‘expm’ se utilizó para . El método progress en el paquete ‘svMisc’ se utilizó para mostrar el nivel de progreso de las tareas de larga duración en RStudio. Cada uno de los parámetros dentro de la función de riesgo de mejor ajuste tenía una media y una matriz de covarianza estimadas. El método mvrnorm en el paquete ‘MASS’ se utilizó para generar muestras aleatorias normales multivariadas para los parámetros dentro de la función de riesgo dado el vector de media estimada y la matriz de covarianza de los parámetros.
Resultados
Resultados de la evaluación
Estimamos que 37,1 (IC del 95 %: 15,0 a 70,7) recién nacidos serán identificados por el NBS, con base en la cohorte 2022-2023 de 357 903. Mientras que los 3,3 restantes (IC del 95 %: 3,3 a 3,3) se presentarán clínicamente cada año.
Resultados del análisis de sensibilidad probabilístico
El análisis de PSA se realizó con 1000 iteraciones. Las distribuciones que variaron en el modelo se derivaron de la literatura existente sobre detección y tratamiento de la AME, y se pueden consultar en las Tablas 1 y A1 .
Los resultados del PSA indicaron que el NBS y el tratamiento temprano son dominantes en comparación con la ausencia de NBS y el tratamiento tardío, con una diferencia media de coste incremental de CAD -146.187.000 (IC del 95 %: -249.773.777 a -17.890.034) y un beneficio medio incremental de AVAC de 872 AVAC (IC del 95 %: -193 a 2.328). Esto se reflejó en la razón media de coste-efectividad incremental (ICER), que es de -173.572/AVAC. El diagrama de dispersión de coste-efectividad incremental (Fig. 3 ) muestra que la mayoría de los puntos se encuentran en el cuadrante sureste, lo que significa que, en la mayoría de los casos, el NBS será menos costoso y más eficaz. El beneficio monetario neto (NMB) viene dado por la ecuación.
donde es la disposición a pagar por un AVAC [ 47 ] , entonces el SBN es beneficioso. Si , entonces el SBN no lo es. Dados valores de disposición a pagar de $1,000, $10,000 y $50,000, el NMB se encuentra en $147,059,934 (IC del 95%: $20,409,793 a $249,645,778), $154,914,379 (IC del 95%: 38,684,079 a 248,338,153), y $189,823,026 (IC del 95%: 113,519,660 a 258,439,379), respectivamente. NBS es beneficioso para los valores de disposición a pagar de $10,000 y $50,000, y el NMB medio para el valor de disposición a pagar de $1,000 indica que NBS es beneficioso. En general, los resultados del PSA indican que el cribado y el tratamiento temprano de la AME son más económicos y eficaces que la ausencia de cribado y el tratamiento tardío. Los resultados del PSA se muestran en la Tabla 2 .
Para respaldar la comparabilidad con otros estudios, también realizamos un análisis secundario desde la perspectiva del pagador público. Como se muestra en la Tabla A2 del Apéndice , los resultados se mantuvieron favorables, con un ICER de -$110,703 por AVAC ganado. El NMB en un umbral de disposición a pagar de $50,000 por AVAC fue de $116 millones, lo que indica que el cribado neonatal para AME sigue siendo rentable incluso cuando se excluyen los costos indirectos. La tabla completa de resultados del pagador público está disponible en la Figura A2 del Apéndice . Además, la Figura A1 del Apéndice ilustra el diagrama de dispersión de coste-efectividad incremental desde la perspectiva del pagador público PSA, mostrando que la mayoría de las simulaciones caen dentro del cuadrante sureste, lo que refuerza que el cribado es más eficaz y menos costoso desde la perspectiva del pagador público.
Análisis de sensibilidad determinista
El análisis de costos diferenciales (DSA) se realizó determinando la diferencia de costo incremental entre el tratamiento endoscópico neonatal (SNE) y el tratamiento temprano, en comparación con la ausencia de SNE y el tratamiento tardío, para los percentiles 1, 10, 20, 30, 40, 50, 60, 70, 80, 90 y 99 de la distribución de cada parámetro. Las distribuciones utilizadas en el análisis de PSA fueron las mismas que se pueden consultar en las Tablas 1 y A1 .
Los resultados del DSA identificaron los parámetros del modelo con mayor impacto en los costos. Los diez resultados más impactantes del DSA se muestran en la Fig. 4. Los parámetros con mayor impacto en la diferencia de costos fueron la probabilidad de un resultado positivo en la prueba de detección de AME, la tasa de transición de la sedestación a la muerte, la probabilidad de presentar síntomas con dos copias de SMN2 y la probabilidad de tener dos o tres copias de SMN2 .Tabla 2 Resultados del PSA a lo largo de un horizonte de vida y una tasa de descuento del 1,5%
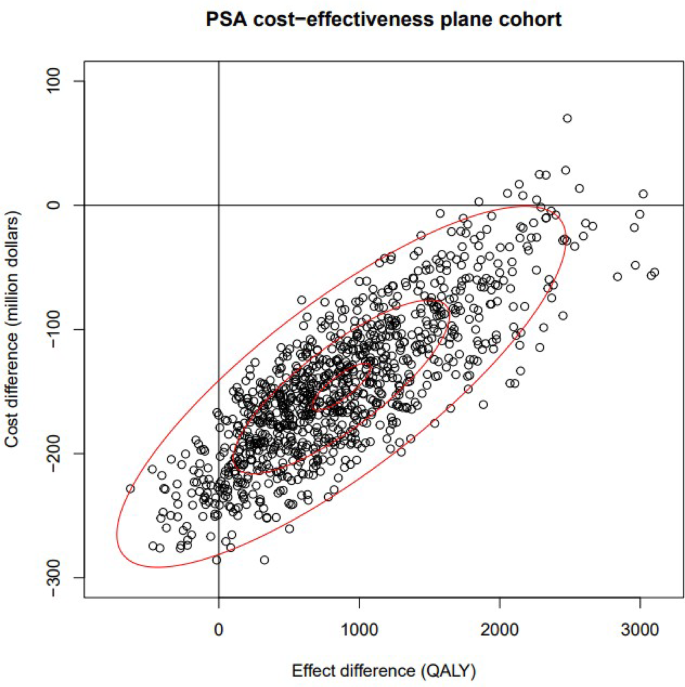
El diagrama de dispersión muestra la diferencia de costo frente a la diferencia de efecto entre el cribado de la AME y el tratamiento temprano, en comparación con la ausencia de cribado y el tratamiento tardío. Cada punto representa una iteración del PSA. La mayoría de los puntos se ubican en el cuadrante sureste, lo que indica que, en la mayoría de los casos, el cribado de la AME y el tratamiento temprano son menos costosos y más efectivos.
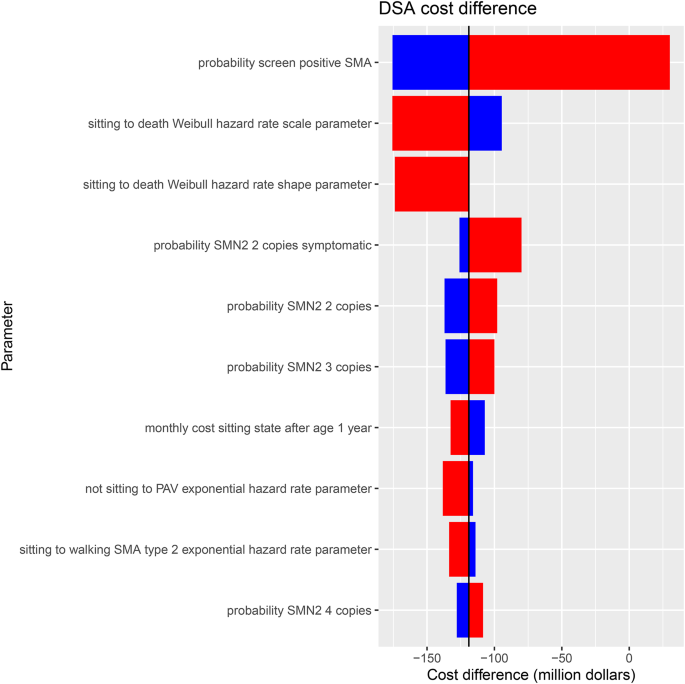
Diagrama de tornado que ilustra la diferencia de costo (en millones de dólares canadienses) con respecto a la DSA. Las barras rojas indican un valor alto del parámetro y las barras azules, un valor bajo. El parámetro «Resultado positivo para AME» tiene el mayor impacto en el costo total, seguido de «Sentarse hasta la muerte» y » Copias de SMN2 sintomáticas».
Discusión
Este modelo se desarrolló utilizando datos canadienses, incluyendo el número de nacidos vivos, costos, servicios públicos y supervivencia a largo plazo. Hasta donde sabemos, esta es la primera evaluación económica del cribado de la AME para la AME en Canadá. Si bien el cribado de la AME se ha adoptado ampliamente en Canadá recientemente, con las tres últimas provincias (NS, NB, PEI) adoptando la AME en sus plataformas de cribado, persisten dudas sobre su coste-efectividad. Además, esta es la primera evaluación económica del cribado de la AME que incorpora los costes de la terapia puente en el modelo. En nuestro análisis, entre una cohorte de 357.903 recién nacidos, el cribado de la AME para la AME se asoció con un ahorro de costes de 146.187.000 dólares (IC del 95 %: -249.773.777 a -17.890.034) y una ganancia de 872 AVAC (IC del 95 %: -193 a 2.328) en comparación con la ausencia de cribado de la AME para la AME en el contexto canadiense. Estos hallazgos indican que el tratamiento endoscópico neonatal (SNE) para la AME permite ahorrar costos y mejorar los resultados de salud, lo que lo convierte en la intervención predominante en comparación con la ausencia de cribado. Además, la figura A12 del apéndice indica una alta probabilidad de costo-efectividad en todos los umbrales de disposición a pagar. La identificación temprana de la AME mediante el SNE permite tratar a los pacientes antes de que la enfermedad progrese, previniendo la pérdida irreversible de neuronas motoras. Esta identificación temprana permite que los pacientes alcancen mayores hitos motores, lo que se espera que mejore los resultados de salud a lo largo de su vida. La mayor calidad de vida resultante de la identificación temprana también reduce los costos asociados con vivir con AME grave. La ganancia media de 872 AVAC en el análisis puede atribuirse a la mejora del pronóstico para los pacientes tratados tempranamente, previniendo el daño irreversible observado en los pacientes no tratados. Por lo tanto, los costos adicionales de invertir en el SNE para la AME se compensan con el ahorro de costos obtenido mediante la identificación temprana y el tratamiento inmediato de los pacientes con AME positiva.
Nuestros resultados demuestran que incluso cuando se varían los parámetros, el modelo muestra de forma consistente que el NBS para la AME y el tratamiento temprano suponen un ahorro de costes y han mejorado los resultados de salud en comparación con la ausencia de NBS para la AME y el tratamiento tardío. El diagrama de dispersión del PSA respalda aún más esto, con la mayoría de los puntos en el cuadrante sureste, lo que indica que el NBS para la AME es menos costoso y más eficaz en la mayoría de los escenarios (Fig. 3 ). Sin embargo, algunos escenarios en el PSA indicaron que el NBS podría ser más costoso o menos eficaz, lo que refleja la variabilidad del modelo. Los resultados del DSA destacaron algunos de los parámetros que tuvieron el mayor impacto en los costes, como la probabilidad de obtener un resultado positivo en la detección de la AME. Utilizamos la tasa de incidencia estándar de la AME, comúnmente citada en la bibliografía, de 1 de cada 10 000 3. Aunque se desconoce la incidencia real de la AME en Canadá, variamos este parámetro utilizando las tasas de incidencia canadienses notificadas en Alberta y Ontario, que fueron de 1 de cada 9401 y 1 de cada 27 960, respectivamente [ 5 , 6 ].
Se han completado modelos similares en otros países, incluidos Inglaterra y los Países Bajos. En 2022, un análisis de costo-utilidad desde la perspectiva del pagador público en los Países Bajos evaluó el cribado de AME frente a la ausencia de cribado, utilizando una estructura similar que implica un árbol de decisión y un modelo de Markov [ 14 ]. Su análisis de caso base encontró que el cribado de AME resultó en un ahorro de costos de 17.782.124 dólares canadienses y un beneficio incremental de 320 AVAC, aunque esto fue entre una cohorte más pequeña de 169.680 recién nacidos, lo que resultó en un ICER total de -55.594 dólares canadienses/AVAC. Un modelo similar, basado en el estudio de los Países Bajos, se completó en 2023 utilizando una cohorte de 585.254 recién nacidos en Inglaterra desde la perspectiva social [ 13 ]. Este estudio encontró que la detección de AME resultó en un ahorro de costos de CAD 108,213,263 y un mayor beneficio de AVAC de 529, lo que lleva a un ICER de -205,521 CAD/AVAC. Los resultados de nuestro modelo se encuentran entre los de estos estudios, con nuestro valor medio de ICER de -$173,572/AVAC. Una diferencia clave en los datos de costos entre estos estudios fueron los altos costos de hospitalización informados en los estudios de los Países Bajos e Inglaterra. Nuestro estudio informó costos de hospitalización moderados, ya que el tratamiento temprano debería minimizar las estadías hospitalarias, especialmente después del primer año del diagnóstico. Esta suposición también fue apoyada por nuestros expertos clínicos, quienes estuvieron de acuerdo con los costos de hospitalización utilizados en nuestro modelo. Nuestro modelo se realizó desde la perspectiva social, incluyendo la pérdida de ingresos potenciales tanto del paciente como del cuidador y otros costos indirectos como viajes y servicios de salud de bolsillo. La perspectiva social se considera el estándar de oro en economía de la salud y fue la más adecuada para este análisis [ 48 ].
El desarrollo de este modelo de coste-utilidad presentó varias limitaciones. En primer lugar, la escasez de datos de ensayos clínicos para pacientes con OA que presentaban síntomas clínicos. Además, no se disponía de ensayos clínicos con risdiplam que incluyeran datos individuales de pacientes sobre la edad de logro, lo que los hizo ineficaces para la inclusión en el modelo. Por lo tanto, utilizamos datos de ensayos con nusinersen para estimar el logro de hitos motores para estos pacientes con OA clínicamente presente y todos los pacientes tratados con risdiplam. Asimismo, para los pacientes presintomáticos con copias SMN2-4 , aplicamos datos de ensayos clínicos con copias SMN2-3 presintomáticas debido a la falta de datos de ensayos clínicos sobre pacientes presintomáticos con copias SMN2-4 . Además, tuvimos que extrapolar los efectos a largo plazo de ensayos clínicos que solo contaban con un seguimiento a corto plazo, dado que los TME están disponibles recientemente. Las limitaciones de los datos también afectaron la calidad de los valores de utilidad utilizados, ya que los valores de utilidad para pacientes con AME en Canadá son limitados. Este desafío se extendió a la recopilación de datos de costes, en particular respecto a los costes de hospitalización por AME más allá del primer año tras el diagnóstico. Finalmente, nos basamos en la opinión de expertos para fundamentar el algoritmo de tratamiento de la AME y los parámetros de costeo. También asumimos una tasa de aceptación del 100% del cribado de la AME en las provincias donde se ofrece actualmente y excluimos la pequeña proporción de familias que rechazan el cribado (p. ej., <0,1% en Ontario), ya que las tasas de rechazo no estaban disponibles de forma uniforme en todas las jurisdicciones. Además, asumimos que las personas que reciben tratamiento no experimentarán una regresión a estados de salud de menor funcionalidad con el tiempo, según los datos disponibles de ensayos clínicos y de extensión; sin embargo, la durabilidad a largo plazo del efecto del tratamiento sigue siendo incierta, especialmente en pacientes tratados tras la aparición de los síntomas.
Las investigaciones futuras deberían centrarse en la realización de ensayos clínicos que proporcionen datos sobre los hitos motores de cada paciente y en la ampliación del período de seguimiento para comprender mejor los resultados a largo plazo de los pacientes con AME que reciben diversos TME. Además, datos más completos sobre los costos asociados a la AME y el valor de la utilidad de las personas diagnosticadas con AME en Canadá mejorarían la precisión de las futuras evaluaciones económicas.
Los resultados de esta evaluación económica constituyen una base sólida para la inclusión del cribado de la AME en todos los programas canadienses de servicios de salud reproductiva. Además, proporciona evidencia que incorpora las técnicas más recientes, como la terapia puente, en un panorama en constante evolución del cribado de la AME.