Profundización en la integración de POCUS en la medicina cardiovascular aguda
Marina Petersen Saadi Prayuth Rasmeehirun1,2,*, Guilherme Heiden Telo2 y Erwan Donal2
1 Departamento de Cardiología, Hospital de Clínicas de Porto Alegre, Ramiro Barcelos 2350, 90035-003 Porto Alegre/RS, Brasil
2 Departamento de Cardiología, Universidad de Rennes, Hospital Pontchaillou – CHU Rennes, Inserm, LTSI—UMR 1099, Rennes F-35000, Francia
Recibido el 25 de agosto de 2025; aceptado tras revisión el 20 de noviembre de 2025; publicado en línea como preimpreso el 1 de enero de 2026.
Resumen
La ecografía en el punto de atención (POCUS, por sus siglas en inglés) ha experimentado un desarrollo vertiginoso en la última década, pasando de constituir un complemento diagnóstico a convertirse en una herramienta fundamental e integrada en la valoración clínica inmediata, sobre todo en ámbitos como la atención cardiovascular aguda. Este avance ha sido propiciado por la portabilidad y accesibilidad de los dispositivos, así como por la creciente evidencia científica que respalda su utilidad clínica en diversos escenarios.
POCUS aporta información fisiopatológica relevante en tiempo real, lo que permite una aproximación diagnóstica más precisa, una mejor estratificación del riesgo y una toma de decisiones terapéuticas individualizada en el propio entorno del paciente. Entre sus aplicaciones más destacadas en el contexto cardiopulmonar, la ecografía pulmonar (LUS) se ha posicionado como una técnica fiable para la detección y monitorización de la congestión pulmonar, superando en sensibilidad y especificidad a métodos tradicionales como la radiografía de tórax y el examen físico. Este enfoque permite una identificación precoz y dinámica de alteraciones, facilitando intervenciones oportunas.
Por otro lado, la Puntuación de Ecografía en Exceso Venoso (VExUS) contribuye con una evaluación sistematizada de la congestión venosa sistémica, utilizando patrones Doppler en venas abdominales para identificar grados y repercusiones de la sobrecarga. Asimismo, el integral de velocidad-tiempo en el tracto de salida del ventrículo izquierdo (LVOT-VTI) emerge como un indicador reproducible y cuantificable del flujo directo y del gasto cardíaco, parámetros que resultan esenciales para la monitorización hemodinámica y la valoración de la respuesta al tratamiento. Complementando este arsenal diagnóstico, la ecografía cardíaca enfocada (FoCUS) brinda una evaluación estructural y funcional rápida del corazón, permitiendo identificar alteraciones valvulares, contractilidad segmentaria, derrame pericárdico, entre otras condiciones.
La fiabilidad, utilidad pronóstica y valor añadido de todas estas modalidades han sido validadas progresivamente a través de estudios multicéntricos y en poblaciones diversas, lo que resalta su importancia en la práctica clínica actual. Sin embargo, para lograr una implementación generalizada y estandarizada, persisten desafíos relacionados con la formación de las personas operadoras, la certificación de competencias y la homogeneización de protocolos de adquisición e interpretación de imágenes.
La integración de POCUS en los flujos de trabajo diarios, especialmente mediante la realización de evaluaciones estructuradas y seriadas del estado pulmonar, venoso y hemodinámico, representa una oportunidad única para perfeccionar la toma de decisiones clínicas, adaptar de manera precisa las estrategias terapéuticas y, en última instancia, mejorar los resultados clínicos y la experiencia del paciente. Esta revisión ofrece una síntesis exhaustiva de la evidencia disponible, los aspectos metodológicos y las implicancias operativas de POCUS en la medicina cardiovascular aguda, subrayando siempre su rol complementario respecto de las herramientas diagnósticas tradicionales, lejos de pretender reemplazarlas, sino expandiendo el arsenal diagnóstico disponible al personal sanitario.
Descargado desde https://academic.oup.com/ehjimp/article/4/1/qyaf147/8407920
Resumen
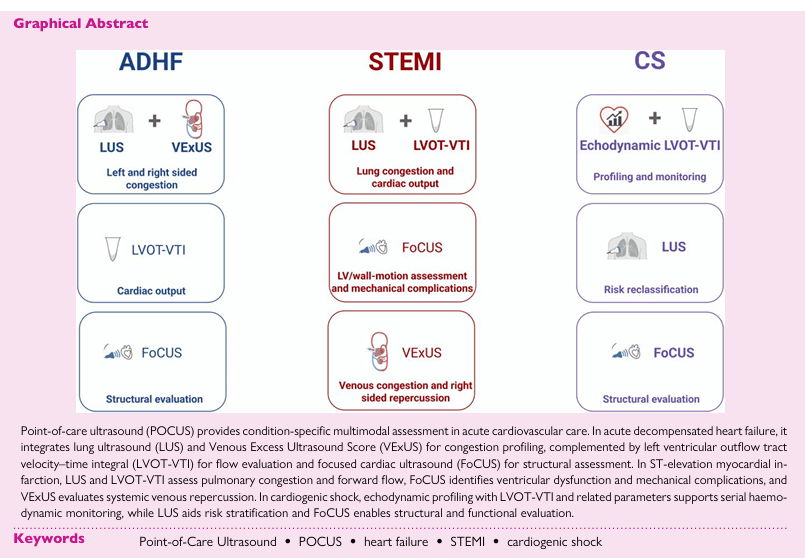
La ecografía en el punto de atención (POCUS) habilita una evaluación multimodal, integral y específica de las condiciones presentes en pacientes con patología cardiovascular aguda. Por ejemplo, en el escenario de insuficiencia cardíaca descompensada aguda, la combinación de ecografía pulmonar (LUS) y la puntuación VExUS permite un perfilado preciso de la congestión, mientras que la adición del LVOT-VTI facilita la valoración objetiva del flujo sanguíneo y el gasto cardíaco. La ecografía cardíaca enfocada (FoCUS) complementa estos procedimientos con una valoración estructural detallada, permitiendo detectar alteraciones morfológicas y funcionales de manera expedita.
En el contexto del infarto agudo de miocardio con elevación del segmento ST (STEMI), la ecografía pulmonar y el LVOT-VTI resultan útiles para evaluar la presencia y gravedad de la congestión pulmonar y el flujo cardiovascular anterógrado, respectivamente. FoCUS, por su parte, se orienta a identificar disfunciones ventriculares y posibles complicaciones mecánicas asociadas al evento isquémico, mientras que VExUS aporta información sobre el impacto sistémico venoso de la afección.
Ante el shock cardiogénico, el perfilado ecodinámico mediante LVOT-VTI y otros parámetros asociados permite una monitorización hemodinámica seriada y dinámica, fundamental para guiar el soporte circulatorio. Simultáneamente, LUS contribuye a la estratificación del riesgo al detectar sobrecarga pulmonar, y FoCUS posibilita la valoración inmediata de la estructura y función cardíacas, facilitando la detección de complicaciones agudas que requieren intervención especializada.
Introducción
Lograr un diagnóstico cardiopulmonar preciso y oportuno representa uno de los pilares fundamentales en la atención cardiovascular moderna. Sin embargo, las herramientas tradicionales disponibles en la cabecera del paciente presentan limitaciones considerables en términos de sensibilidad, especificidad y prontitud de respuesta, lo que puede afectar de manera significativa la eficacia de la toma de decisiones clínicas. El examen físico, aunque sigue siendo insustituible como primer acercamiento clínico, adolece de variabilidad interobservador y, en muchos escenarios, de una precisión insuficiente; por ejemplo, los estertores pulmonares permiten identificar una presión auricular derecha (RAP) ≥10 mmHg y una izquierda ≥20 mmHg tan solo en el 28 % y 25 % de los casos, respectivamente. La distensión venosa yugular, por su parte, muestra una sensibilidad de apenas el 39 % para la detección de congestión sistémica. La radiografía de tórax, método tradicionalmente empleado, ofrece una sensibilidad aproximada del 56 % para identificar congestión pulmonar en insuficiencia cardíaca aguda descompensada.
Aunque los biomarcadores, las técnicas avanzadas de imagen y la monitorización hemodinámica invasiva aportan información valiosa, suelen estar limitados por su accesibilidad, costo, complejidad técnica o demora en la obtención de resultados, lo que restringe su aplicación en situaciones que exigen inmediatez. Frente a este panorama, la ecografía en el punto de atención (POCUS) surge como una respuesta innovadora y efectiva, al permitir una evaluación en tiempo real, no invasiva y basada en parámetros fisiológicos directamente observables, integrados en la dinámica de la toma de decisiones en la cabecera del paciente.
POCUS se define como un examen ecográfico enfocado, orientado a objetivos clínicos específicos y realizado por la persona que atiende al paciente, integrándose de inmediato en el razonamiento clínico. Al proporcionar información insitu, POCUS complementa —sin desplazar— tanto el examen físico como las herramientas diagnósticas convencionales, incrementando la precisión diagnóstica, mejorando la estratificación de riesgos y guiando de manera más eficiente la terapéutica. La rápida disponibilidad de resultados permite acelerar los procesos decisorios en múltiples contextos clínicos, desde la sala de emergencias hasta la unidad de cuidados intensivos y la consulta especializada.
En el área cardiovascular, la ecografía pulmonar destaca por su capacidad para identificar signos de congestión como las líneas B, con una sensibilidad y especificidad que ampliamente superan a los métodos tradicionales, lo que refuerza su utilidad y pertinencia en el abordaje integral del paciente con patología aguda.
El auge de la ecografía en el punto de atención en el diagnóstico cardiopulmonar
Marina Petersen Saadi Prayuth Rasmeehirun 1,2,*, Guilherme Heiden Telo 2, y Erwan Donal 2 1, 1 Departamento de Cardiología, Hospital de Clínicas de Porto Alegre, Ramiro Barcelos 2350, 90035-003 Porto Alegre/RS, Brasil 2 Departamento de Cardiología, Universidad de Rennes, Hospital Pontchaillou – CHU Rennes, Inserm, LTSI—UMR 1099, Rennes F-35000, Francia Recibido el 25 de agosto de 2025; aceptado tras la revisión el 20 de noviembre de 2025; publicado en línea-ante-imprensa 1 de enero de 2026
Resumen
Ultrasonido en punto de atención (POCUS) ha evolucionado rápidamente de un complemento diagnóstico a una extensión esencial del razonamiento clínico al lado del paciente en la atención cardiovascular aguda. Al proporcionar información inmediata, fisiológicamente fundamentada y no invasiva, POCUS mejora la precisión diagnóstica, la estratificación de riesgos y la orientación terapéutica en tiempo real. Entre sus aplicaciones principales, la ecografía pulmonar permite la detección y monitorización fiables de la congestión pulmonar, superando métodos tradicionales como la radiografía de tórax y el examen físico. La Puntuación de Ecografía en Exceso Venoso ofrece una evaluación estructurada de la congestión venosa sisémica mediante patrones Doppler venosos abdominales. El tracto de salida del ventrículo izquierdo velocidad-tiempo en tegral actúa como sustituto reproducible del flujo directo y el gasto cardíaco, mientras que la ecografía cardíaca enfocada proporciona una evaluación estructural y funcional rápida del corazón. La fiabilidad y el valor pronóstico de estas modalidades han sido respaldados por cada vez más evidencia en diversos contextos clínicos, aunque la estandarización de los protocolos de formación y adquisición sigue siendo crucial para una implementación generalizada. La integración de POCUS en los flujos de trabajo diarios —a través de sesiones estructuradas y seriadas de estado pulmonar, venoso y hemodinámico— promete perfeccionar la toma de decisiones, individualizar estrategias de tratamiento y mejorar los resultados. Esta revisión resume la evidencia actual, consideraciones metodológicas e implicaciones prácticas de la POCUS en la medicina cardiovascular aguda, enfatizando su complementariedad a, en lugar de reemplazar, las herramientas diagnósticas tradicionales.
Introducción
El diagnóstico cardiopulmonar preciso y oportuno es una parte clave del cuidado cardiovascular. Sin embargo, las herramientas tradicionales al lado del paciente suelen carecer de la sensibilidad y la inmediatez necesarias para una toma óptima de decisiones. El examen físico, aunque indispensable, está limitado por la variabilidad y baja precisión entre observadores: los rales pulmonares detectan presión del auricular derecho (RAP) ≥10 mmHg y presión del auricular izquierdo ≥20 mmHg en solo el 28% y el 25% de los casos, respectivamente, mientras que la distensión venosa yugular muestra una sensibilidad de solo el 39% para la congestión sistémica.1La radiografía torácica rinde solo moderadamente mejor, con una sensibilidad de ∼56% para detectar congestión pulmonar en insuficiencia cardíaca descompensada aguda (TDAH).2 Aunque los biomarcadores, la imagen y la monitorización hemodinámica invasiva siguen siendo valiosos, son retardados, inespecíficos o no están fácilmente disponibles en la cabecera. Estas limitaciones subrayan la necesidad de una ecografía en el punto de atención (POCUS), que ofrece una evaluación en tiempo real, no invasiva y basada en la fisiológica, integrada directamente en la toma de decisiones clínicas. POCUS se refiere a un examen ecografiado enfocado y orientado a objetivos, realizado por el médico al lado del paciente e integrado en el razonamiento clínico. Al proporcionar información en tiempo real, POCUS complementa—en lugar de reemplazar—el examen físico y las herramientas diagnósticas convencionales. Mejora la precisión diagnóstica, apoya la estratificación de riesgos y guía la terapia, acelerando la toma de decisiones clínicas en diversos entornos clínicos. En medicina cardiovascular, la ecografía pulmonar (LUS) identifica la congestión pulmonar a través de las líneas B con una precisión notablemente mayor que los métodos tradicionales.3
La Puntuación de Ecografía en Exceso Venoso (VExUS) cuantifica la congestión venosa sistémica mediante patrones Doppler venosos abdominales, reflejando la poscarga venosa y la transmisión posterior de presión que contribuye a la lesión del órgano terminal.4
La ecografía cardíaca enfocada (FoCUS) representa un tipo específico de POCUS aplicado al corazón, realizado por Los clínicos se formaron adecuadamente en su uso, aunque no necesariamente en ecocardiografía integral. Actúa como una extensión del examen físico, permitiendo una evaluación rápida de la función ventricular global izquierda y derecha, alteraciones estructurales y detección de derrame pericárdico.
La evaluación ecodinámica se refiere a la evaluación no invasiva de la hemodinámica mediante ecocardiografía al lado del paciente, combinando parámetros basados en Doppler y morfología para estimar el gasto cardíaco, las presiones de llenado y la resistencia al conducto. En conjunto, estas modalidades amplían la evaluación dinámica hemodinámica junto a la cama, integrando datos clínicos e imagenísticos para refinar el razonamiento diagnóstico y guiar la terapia.5
Esta revisión narrativa explora el papel evolutivo del POCUS como herramienta empresarial y basada en fisiología para el diagnóstico cardiopulmonar y la atención cardiovascular aguda. Más allá de aplicaciones individuales, como la LUS para la congestión pulmonar o la VExUS para la sobrecarga venosa sistémica, la revisión integra modalidades hemodinámicas adicionales —incluyendo la integral de velocidad-tiempo del tracto de salida del ventrículo izquierdo (LVOT-VTI) y FoCUS — para ilustrar cómo la POCUS multimodal puede proporcionar información en tiempo real tanto sobre la congestión como sobre la perfusión. En conjunto, estos enfoques ap están redefiniendo la evaluación hemodinámica junto al paciente y la toma de decisiones clínicas en ADHF, infarto de miocardio por elevación ST (STEMI) y shock cardiogénico (CS), donde una evaluación rápida y precisa es esencial. 2 M. P. Saadi et al.
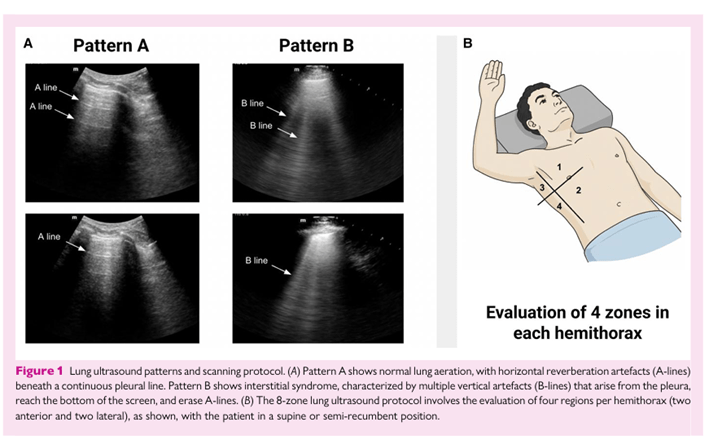
3 Ecografía en punto de atención en diagnóstico cardiopulmonar Figura 1 Patrones de ecografía pulmonar y protocolo de escaneo. (A) El patrón A muestra aireación pulmonar normal, con artefactos de reverberación horizontal (líneas A) bajo una línea pleural continua. El patrón B muestra el síndrome intersticial, caracterizado por múltiples artefactos verticales (líneas B) que surgen de la pleura, llegan al fondo de la pantalla y borran las líneas A. (B) El protocolo de ultrasonido pulmonar de 8 zonas implica la evaluación de cuatro regiones por hemitórax (dos anteriores y dos laterales), como se muestra, con el paciente en posición supina o semi-reclinada. Adquisición e interpretación La ecografía pulmonar LUS se basa en la interpretación de artefactos más que en la visualización directa de estructuras anatómicas. En pulmones normalmente aireados, la única estructura visible es la pleura, que aparece como una línea horizontal hiperecoica —conocida como línea pleural— que se mueve de forma sincrónica con la respiración. Debajo de ella, artefactos de reverberación horizontal llamados líneas A indican contenido de aire preservado. A medida que la aireación disminuye y se acumula líquido intersticial, emergen artefactos verticales conocidos como líneas B. Estas líneas hiperecóicas en forma de láser surgen de la pleura, llegan al fondo de la pantalla, se mueven con la respiración y borran las líneas A, como se ilustra en la Figura 1A.6. Aunque las líneas B son una característica distintiva del edema pulmonar en el TDAH, no son específicas de la enfermedad y también pueden aparecer en otras condiciones que reproduzcan la aireación pulmonar. Patrones difuntos y no gradientes también pueden aparecer en enfermedades pulmonares parénquimas —como la enfermedad pulmonar intersticial, fibrosis pulmonar o síndrome de dificultad respiratoria aguda— mientras que un gradiente basal a apical de las líneas B es consistente con congestiones cardiogénicas.7
Las distribuciones focales o asimétricas suelen indicar consolidación o atelectasia. Factores técnicos y relacionados con el paciente también pueden modificar la apariencia de los artefactos: en la obesidad, un grosor excesivo de la pared torácica atenúa la transmisión de ultrasonidos, reduciendo la visibilidad de la línea B, mientras que en pacientes ventilados mecánicamente, el aumento del volumen pulmonar y la presión positiva al final del espiratorio pueden suprimir o redistribuir transitoriamente las líneas B. Por tanto, una interpretación precisa requiere integración con el contexto clínico y hemodinámico para evitar una clasificación errónea.8
La adquisición de imágenes se realiza utilizando una sonda de matriz en fase o convexa, posicionada perpendicularmente a los espacios intercostales para evitar la sombra de las costillas, ajustando la profundidad para centrar la línea pleural. Entre los protocolos disponibles, el método de 8 zonas —respaldado por la EACVI— ofrece un equilibrio óptimo entre la precisión diagnóstica y la capacidad de la cama de pacientes, como se ilustra en la
Figura 1B.8 Puntuación de Ecografía en Exceso Venoso.
La puntuación VExUS es una herramienta compuesta basada en Doppler diseñada para evaluar la congestión venosa sistémica desde la perspectiva del acuerdo de órgano extremo, integrando el diámetro de la vena cava inferior (VIC) con los patrones de flujo venoso en la vena hepática (HV). vena portal (PV) y venas intrarrenales (VD) para proporcionar una evaluación fisiológicamente fundamentada.9,10
VExUS recoge las consecuencias hemodinámicas de un RAP elevado, sirviendo como marcador indirecto de la poscarga venosa. Refleja el equilibrio entre la presión media sistémica de llenado (MSFP) y el RAP, que determina la presión venosa aguas arriba y modula la transmisión de presión a los órganos inales del abdome.
Esta transmisión hacia atrás da lugar a anomalías características en la forma de onda Doppler que se correlacionan con un mayor riesgo de órgano terminal en jurado debido a perfusión capilar deficiente y edema intersticial.11 La evaluación VExUS comienza con la medición del diámetro de la VExUS a 1–2 cm de la aurícula derecha, con el paciente en posición supina. Si la VCI está dilatada (≥2 cm), se obtienen formas de onda Doppler de la HV, PV y RV mediante una sonda de matriz en fase o convexa, ya sea mediante una ventana subcostal o transhepática. Estas formas de onda se utilizan para clasificar la gravedad de la congestión venosa de 0 a 3, basándose en el grado de transmisión anormal de presión.
• VExUS 0: VExC < 2 cm—sin congestión venosa significativa.
• VExUS 1 (Leve): VCI ≥2 cm con patrones normales de flujo venoso o hallazgos ligeramente anómalos [S < D en HV, índice de pulsatilidad PV (PVPI) 30–50%, o flujo intrarrenal pulsátil pero bifásico].
• VExUS 2 (Moderado): VCI ≥2 cm con al menos un patrón severamente anormal (onda S invertida en HV, PVPI ≥50% en PV o flujo venoso enal intrar monofásico).
• VExUS 3 (Grave): VI ≥2 cm con dos o más patrones de f-low severamente anormales.
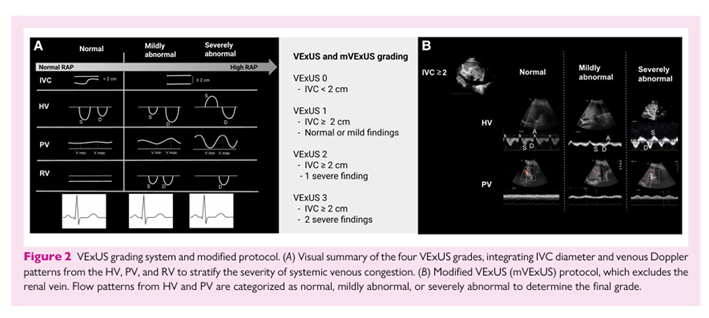
Esta evaluación progresiva ofrece una visión dinámica y centrada en órganos sobre la gravedad de la congestión venosa, ampliando la hemodinámica. Descargado de https://academic.oup.com/ehjimp/article/4/1/qyaf147/8407920 por invitado el 06 de enero de 2026 4 M. P. Saadi et al. Figura 2
Sistema de clasificación
VExUS y protocolo modificado. (A) Resumen visual de los cuatro grados de VExUS, integrando el diámetro de la VCI y los patrones Doppler venosos de la HV, PV y VD para estratificar la gravedad de la congestión venosa sistémica. (B) Protocolo modificado de VExUS (mVExUS), que excluye la vena renal. Los patrones de flujo de HV y PV se clasifican como normales, ligeramente anormales o gravemente anormales para determinar la calificación final.
evaluación más allá del diámetro de la VCI, como se detalla en la Figura 2A. Más recientemente, este enfoque se ha simplificado en el protocolo modificado VExUS (mVExUS), incluyendo únicamente la evaluación de la VIC, HV y PV, excluyendo la vena renal —que es más laboriosa y depende del operador— manteniendo la precisión diagnóstica con un protocolo simplificado como se muestra en la Figura 2B. 12,13 14
El mVExUS ha demostrado un fuerte valor pronóstico en pacientes con TDAH, también puede producirse la mortalidad hospitalaria con excelente reproducibilidad interobservadora (coeficiente de correlación en traclase = 0,957) y un tiempo medio de adquisición de < patrón D también puede producirse en la regurgitación tricúspide estructural o la hipertensión pulmonar, independientemente del estado de volumen.
La correlación por ECG—especialmente para la interpretación de la HV—es esencial para evitar una clasificación errónea. 16 Por tanto, el contexto clínico es fundamental. La integral de tiempo de la velocidad del tracto de salida ventricular izquierdo LVOT-VTI se obtiene utilizando Doppler de onda pulsada en la vista apical de cinco cámaras, capturando la envolvente espectral del flujo a través de la LVOT. Cuando se indexa al área de LVOT, permite estimar el volumen ictus y el gasto cardíaco, aunque la VTI por sí sola se utiliza frecuentemente como un sustituto práctico junto a la cama del flujo directo. Los valores normales oscilan entre 18 y 22 cm, 17 a 18 mientras que los valores 7 mmHg y 14 cm), B (pulmones húmedos y LVOT-VTI >14 cm), C (pulmones secos y LVOT-VTI ≤14 cm) y D (pulmones húmedos y LVOT-VTI ≤14 cm). En una cohorte prospectiva de 308 pacientes con STEMI, la mortalidad hospitalaria osciló entre el 0% en LUV A y el 45% en LUV D (AUC 0,915). Asimismo, la incidencia del shock cardiogénico agudo relacionado con infarto de miocardio (AMI-CS) en las primeras 24 horas aumentó progresivamente entre categores, alcanzando el 30,8% en LUV D. En comparación con la clasificación o protocolos de Killip basados únicamente en LUS, la clasificación LUV demostró un desempeño superior en la predicción del riesgo de mortalidad o CS durante la fase aguda de STEMI, resultando en una mejora neta positiva de 0,07 para predecir la mortalidad hospitalaria. 19,43 A pesar de los resultados prometedores, la validación de la clasificación LUV en grandes cohortes multicéntricas es esencial. Además, es importante destacar que el uso de POCUS no debe retrasar los flujos de trabajo de reperfuo ni la terapia guiada por guías. Curiosamente, en STEMI, las líneas B pueden no reflejar exclusivamente presiones de bilio elevadas. Un estudio que comparó la LUS con la LVFP medida de forma invasiva no encontró correlación significativa en el ingreso, con múltiples líneas B frecuentemente presentes incluso en pacientes con LVFP normal, lo que sugiere que cambios como el aumento de la permeabilidad vascular debido a un estado proinflamatorio pueden estar detrás de estos hallazgos. 44 No obstante, su presencia se correlaciona consistentemente con peores resultados, lo que refleja el valor pronóstico independiente de LUS en este contexto. La aplicación de VExUS en STEMI también ha demostrado una vaya clínica de investigación. La presencia de VExUS ≥1 se ha asociado con una mayor mortalidad hospitalaria, menor índice cardíaco y se ha tratado con mayor frecuencia en infartos de miocardio inferior. 45 Además, un estudio separado informó que el aumento de los grados de VExUS se relacionaba con un mayor riesgo de desarrollar INKA en pacientes con síndromes coronarios agudos, incluyendo aquellos con presentaciones no STEMI. 46
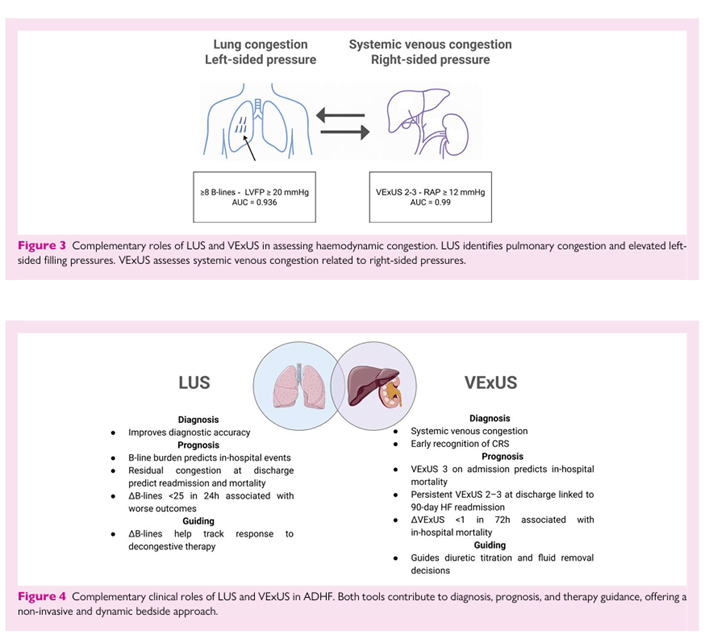
Integración en las vías clínicas La integración de POCUS en el manejo clínico de la AMI representa un avance significativo en la evaluación cardiovascular junto a la cama. Más allá de confirmar la disfunción sistólica del ventrículo izquierdo, POCUS permite un análisis rápido del movimiento regional de la pared, facilitando el reconocimiento temprano de anomalías mentales específicas que apoyan el diagnóstico y la localización de la farsícula. Además, facilita la detección rápida de complicaciones mecánicas y ayuda a descartar diagnósticos alternativos que puedan imitar el IAM, incluyendo síndromes aórticos agudos o embolia pulmonar masiva. La incorporación de la evaluación LUS y LVOT-VTI amplía su función desde el diagnóstico hasta la pronóstica, proporcionando información no invasiva sobre la congestión pulmonar, el estado hemodinámico y el gasto cardíaco, como se muestra en la Figura 5.
Cuando se incorpora sistemáticamente en las vías clínicas tempranas, el POCUS sirve como una herramienta complementaria que perfecciona la precisión del diagnóstico de tics, la estratificación del riesgo y la toma de decisiones terapéuticas en pacientes que presentan síndromes coronarios agudos. Perfil hemodinámico por choque cardiogénico En manos experimentadas, el POCUS sirve como una herramienta poderosa para el ecody námico (monitorización hemodinámica no invasiva) y la diferenciación temprana de subtipos de choques. Un metaanálisis reciente demostró una sensibilidad agrupada del 90% y una especificidad del 98% para identificar el mecanismo subyacente del shock —incluyendo una especificidad del 98% (IC 95%: 97–99) para el SC— destacando su fuerte rendimiento diagnóstico junto con estándares de referencia invasivos. 47 Más allá de la clasificación inicial del tipo de choque, la ecodinámica puede aproximar combinar parámetros hemodinámicos clave en el choque cardiogénico 48 relacionado con el TDAH (ADHF-CS). En comparación con mediciones invasivas, el índice cardíaco ecocardiográfico (eCI ≤2,2 L/min/m²) mostró una alta sensibilidad (97%) y una especificidad aceptable (73%) para detectar estados de baja producción. Las estimaciones de la presión arterial pulmonar, RAP, potencia cardíaca (eCPO) e Índice de Pulsatilidad de la Arteria Pulmonar (ePAPi) también muestran buen rendimiento diagnóstico, aunque la precisión es menor para la estimación de PCWP. Cabe destacar que una reducción de ePAPi se asoció con una mortalidad más alta a los 60 días, mientras que una eCPO más baja mostró una tendencia similar.
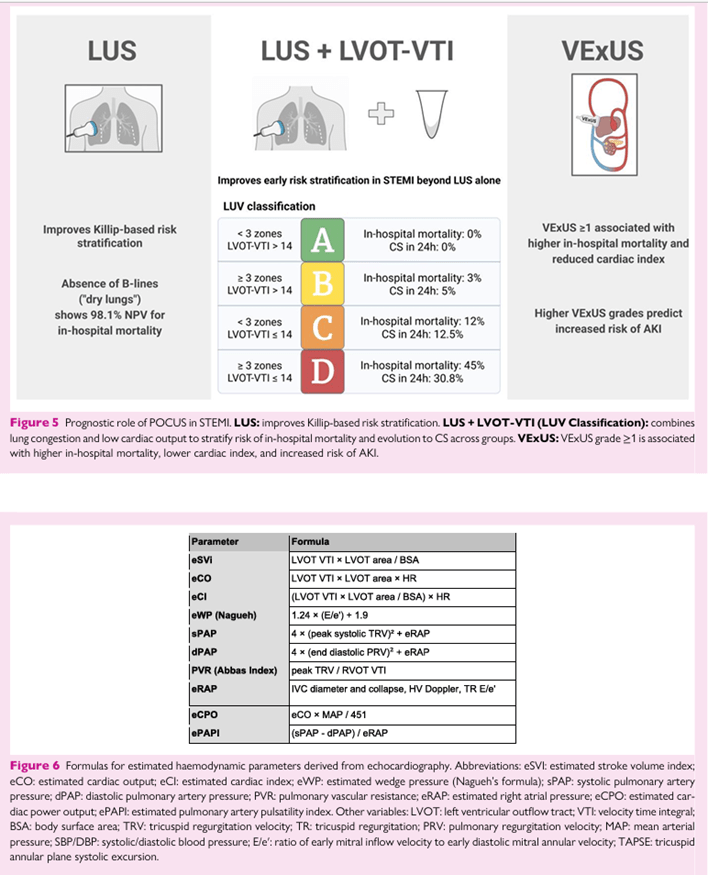
El fenotipado ecocardiográfico según la clasificación de Teherani 49 —que distingue disfunción predominante izquierda, derecha o biventricular— se correlacionó bien con los perfiles hemodinámicos invasivos (κ = 0,457; P < 0,001). Además, LVOT-VTI proporciona un sustituto práctico y no invasivo del flujo directo que puede utilizarse para monitorizar las tendencias del gasto cardíaco y evaluar la respuesta a la terapia. Una IVT marcadamente reducida (10 cm) puede indicar recuperación de la función sistólica y preparación para el destete de 17,50 grados. No obstante, los hallazgos estructurales y funcionales deben interpretarse siempre en conjunto, asegurando que las tendencias de la ITV se contextualicen dentro de la evaluación ecocardiográfica más amplia. Estos hallazgos respaldan el papel de la evaluación ecocardiográfica seriada y no invasiva para monitorizar la respuesta hemodinámica y guiar la terapia al lado del paciente. No obstante, la HRC sigue siendo el estándar de referencia para la cuantificación precisa de presiones intracardíacas y débito cardíaco. Las fórmulas ecocardiográficas clave para estos parámetros se suman en la Figura 6.
La estratificación del riesgo más allá de SCAI LUS proporciona un valor pronóstico en SC al detectar y rastrear la congestión pulmonar. En el registro de ALTShock-2, se aplicó un protocolo simplificado de 4 zonas de LUS usando un umbral dicotómico (≤50% frente a >50% de la línea B en la implicación) en el ingreso y 24 horas en pacientes con CE. Los pacientes con >50% de líneas B a las 24 horas presentaron una frecuencia significativamente mayor a los 30 días, mientras que la reducción temprana de la línea B se asoció de forma independiente con una mejora en la supervivencia. De manera similar, en un estudio prospectivo de pacientes con STEMI en AMI-SC, la congestión pulmonar evaluada por LUS se asoció fuertemente con la etapa de choque SCAI: cada incremento de etapa correspondía a un aumento de 2,2 veces en las probabilidades de tener más zonas pulmonares B-line-positivas. La LUS también permitió una reclasificación significativa del riesgo: la presencia de congestión pulmonar (‘pulmones húmedos’, definidos como ≥3 líneas B en ≥2 zonas pulmonares) identifica a pacientes con mayor riesgo de mortalidad hospitalaria, incluso entre aquellos inicialmente categorizados como de bajo riesgo (SCAI A o B). Entre los PA de SCAI A/B, quienes tenían pulmones húmedos tuvieron una mortalidad sustancialmente mayor que aquellos con pulmones secos (8,8% vs. 2,7%; OR ajustado 3,5, IC 95% 1,4–8,6; P = 0,006), subrayando el valor pronóstico aditivo de LUS. 52
En conjunto, estos hallazgos subrayan el valor de la LUS serial para la estratificación dinámica del riesgo y la fenotipización en la cama del paciente en la cesárea. Refinar el diagnóstico más allá de la hemodinámica y las complicaciones postprocedimentales Más allá del perfilado hemodinámico, la ecocardiografía en la cama del paciente con FoCUS amplía el alcance diagnóstico al permitir una evaluación estructural rápida del corazón, una ventaja frente a la monitorización basada únicamente en catéter. AMI-CS, FoCUS permite la detección de complicaciones mecánicas como defecto del tabique ventricular, ruptura del músculo papilar o rotura de la pared libre. En el TDAH-CS, facilita el reconocimiento de causas contribuyentes o secundarias, incluyendo disfunción valvular aguda o embolia pulmonar. 5.
Figura 5 Papel pronóstico de la POCUS en STEMI. LUS: mejora la estratificación de riesgos basada en Killip. LUS + LVOT-VTI (Clasificación LUV): combina congestión pulmonar y bajo gasto cardíaco para estratificar el riesgo de mortalidad hospitalaria y evolución a SC entre grupos. VExUS: El VExUS grado ≥1 se asocia con una mayor mortalidad hospitalaria, un índice cardíaco más bajo y un mayor riesgo de AQ. Figura 6 Fórmulas para parámetros hemodinámicos estimados derivados de la ecocardiografía. Abreviaturas: eSVI: índice estimado de volumen ictusal; eCO: gasto cardíaco estimado; eCI: índice cardíaco estimado; eWP: presión estimada de cuña (fórmula de Nagueh); sPAP: presión arterial pulmonar sistólica; dPAP: presión arterial pulmonar diastólica; PVR: resistencia vascular pulmonar; eRAP: presión estimada del auricular derecho; eCPO: potencia estimada de salida del diac del coche; ePAPI: índice de pulsatilidad de la arteria pulmonar estimado. Otras variables: LVOT: tracto de salida ventricular izquierdo; VTI: integral de tiempo de velocidad; BSA: superficie corporal; TRV: velocidad de regurgitación tricúspide; TR: regurgitación tricúspide; PRV: velocidad de regurgitación pulmonar; MAP: presión arterial media; SBP/DBP: presión arterial sistólica/diastólica; E/e′: relación entre la velocidad temprana de entrada mitral y la velocidad anular mitral diastólica temprana; TAPSE: excursión sistólica tricúspide del plano anular. Descargado de https://academic.oup.com/ehjimp/article/4/1/qyaf147/8407920 por invitado el 6 de enero de 2026 9 Ecografía en el punto de atención en diagnóstico cardiopulmonar El FoCUS también desempeña un papel fundamental en la identificación de formas obstructivas de shock causadas por tamponamiento cardíaco, carga residual aguda del ventriculo derecho en pliegue o obstrucción dinámica de la LVOT. Finalmente, en pacientes que desarrollan shock tras interventilaciones cardíacas o estructurales, FoCUS es especialmente valioso para la detección rápida de derrame pericárdico y tamponamiento—condiciones que a menudo pasan desapercibidas en el examen físico, el ECG o la radiografía torácica. En un estudio retrospectivo, FoCUS acortó significativamente tanto el tiempo hasta el diagnóstico como el tiempo hasta la pericardiocentesis en comparación con la imagen estándar, subrayando su potencial vital en este entorno crítico. 53,54 Integración en las vías clínicas POCUS proporciona un marco integral y no invasivo para la evaluación hemodinámica de la CE, apoyando tanto el perfilado inicial como la gestión dinámica tras intervenciones terapéuticas. En la presentación, ayuda a discriminar mecanismos predominantes como la falla de la bomba, la fisiología distributiva o la disminución de volumen, guiando así las elecciones tempranas de tratamiento. Una vez establecido el fenotipo, la evaluación ecocardiográfica serial de permite estimar en tiempo real las presiones de obturación, las presiones de las arterias pulmonares, el gasto cardíaco, la función ventricular y la resistencia vascular a la terapia vasoactiva titulada. Estas mediciones deben repetirse tras cambios hemodinámicos importantes o ajustes de medicación. Su fiabilidad depende de ventanas acústicas adecuadas y de la experiencia del operador; cuando la calidad de imagen es limitada o los datos Doppler son inconsistentes, la RHC sigue siendo el estándar de referencia. La FÓQUUS debe integrarse en la evaluación inicial para ayudar en la evaluación estructural del corazón, ayudando a diferenciar los tipos de feno de choque e identificar complicaciones mecánicas, enfermedad valvular significativa o derrame pericárdico que puedan alterar el manejo. LUS complementa este enfoque refinando la estratificación del riesgo dentro del marco SCAI. En pacientes clasificados como SCAI estadios A o B, la presencia de ‘pulmones húmedos’ se asoció con una mortalidad hospitalaria significativamente mayor en comparación con los ‘pulmones secos’. Esto pone de manifiesto el valor prog y prog de la LUS incluso en las primeras fases del shock, apoyando su discurso interno sobre la reclasificación de riesgos al pie del paciente. Integrar LUS con VExUS personaliza aún más la gestión de volúmenes. Se debe buscar un balance líquido neto negativo, incluso con creatinina límite, cuando el Doppler venoso demuestra una transmisión severa por presión (VExUS grado 2–3) acompañado de congestiones pulmonares (>2 zonas B-línea–positivas). 55 Por el contrario, en pacientes con tolerancia líquida—congestión pulmonar mínima (15% durante el levantamiento pasivo de piernas). A través de esta integración, la ecocardiografía hemodinámica conecta la evaluación diagnóstica con la orientación terapéutica en tiempo real, alineando el monitoreo no invasivo con los marcos de cuidados críticos establecidos y facilitando un manejo individualizado en la CS. Implementación La integración efectiva del POCUS en la atención cardiovascular aguda requiere educación estructurada, certificación y protocolos estandarizados. Las curvas de aprendizaje varían según las modalidades: LUS suele requerir menos escaneos supervisados por supervisión, mientras que ∼50 exámenes supervisados parecen suficientes para alcanzar la competencia en interpretación VExUS. Mediciones hemodinámicas más avanzadas requieren un entrenamiento supervisado prolongado hasta que la reproducibilidad se acerque a la de los ecocardiógrafos experimentados. Es importante destacar que la formación dirigida de los residentes de cardiología ya ha demostrado ser eficaz para mejorar la toma de decisiones clínicas, especialmente para el reconocimiento de complicaciones mecánicas en el infarto agudo de miocardio. Definir estas curvas de aprendizaje con mayor precisión será esencial para asegurar una implementación segura y eficaz. Los protocolos de adquisición estandarizados y las directrices basadas en la evidencia sobre indicaciones adecuadas deberían difundirse ampliamente, centrándose inicialmente en fisioterapeutas de emergencia, intensivistas y cardiólogos, para promover la integración del POCUS en los flujos de trabajo clínicos diarios. Limitaciones A pesar de su rápida adopción, POCUS sigue siendo muy dependiente del operador y sujeto a variabilidad en la calidad de imagen, interpretación y documentación. Las limitaciones técnicas —como ventanas acústicas deficientes, artefactos de movimiento y desalineación Doppler— pueden comprometer la precisión. Los riesgos de cada método se describen en detalle en los temas anteriores y siempre deben considerarse junto con la presentación clínica del paciente. Además, la falta de vías formativas estandarizadas y requisitos de certificación en todas las instituciones dificulta la reproducibilidad y la adopción clínica generalizada. Además, la evidencia que vincule directamente las estrategias guiadas por POCUS con resultados centrados en el paciente está demostrado sigue siendo limitada. La mayoría de los estudios son monocéntricos y observacionales, lo que subraya la necesidad de ensayos pragmáticos de mayor tamaño para clarificar su valor incremental frente a la evaluación convencional y establecer su papel en la gestión dirigida por guías. Direcciones futuras Más allá de la implementación y la estandarización, la generación de evidencia y la innovación tecnológica definirán la próxima fase de la evolución del POCUS. Los ensayos aleatorizados multicéntricos deberían evaluar el impacto de las estrategias guiadas por POCUS en resultados difíciles —como mortalidad, rehospitalización y coste-efectividad— mientras que los estudios pragmáticos de implementación en urgencias, unidades de cuidados intensivos y salas de cardiología pueden informar la integración en el mundo real. Será esencial establecer marcos de competencia y procesos de aseguramiento de la calidad para garantizar un rendimiento consistente. Paralelamente, se espera que la inteligencia artificial (IA) desempeñe un papel cada vez más favorable en POCUS al reducir la variabilidad entre operadores, guiar a usuarios menos experimentados durante la adquisición de imágenes y asistir con el reconocimiento automatizado de patrones sonográficos clave. Los modelos de aprendizaje profundo ya demuestran la capacidad de estandarizar la adquisición e interpretación gráfica de ecocardio, y estos principios son directamente aplicables a modalidades POCUS como LUS y VExUS, donde la cuantificación automática acoplada de líneas B y el reconocimiento de patrones de formas de onda podrían mejorar la reproducibilidad. En el futuro, la IA también podría integrar indings de ultrasonido con datos clínicos y de laboratorio para generar perfiles dinámicos hemodinámicos en tiempo real, mejorando la precisión diagnóstica y la catión de estratificación pronóstica en la atención cardiovascular aguda. 58,59 En conjunto, estos avances consolidarán la POCUS como una herramienta ampliamente aplicable y de alto impacto en la atención cardiovascular—uniendo fisiología, tecnología y toma de decisiones clínicas—al tiempo que enfatizan su complementariedad, más que superioridad, respecto a las herramientas diagnósticas tradicionales, salvo cuando la evital la respalde claramente.
Conclusión
El uso de POCUS representa una de las grandes revoluciones recientes en la atención cardiovascular y en el diagnóstico cardiopulmonar moderno. Su disponibilidad inmediata al lado del paciente permite a los clínicos ampliar las capacidades diagnósticas, acelerar la toma de decisiones y proporcionar una estratificación de riesgos más precisa, a menudo en tiempo real y en el momento de mayor necesidad. A medida que la evidencia continúa acumulándose, la POCUS se reconoce cada vez más no como un reemplazo de las herramientas diagnósticas tradicionales, sino como su complemento más potente: integrar el razonamiento clínico con la imagen fisiológica para perfeccionar la evaluación y guiar la terapia. Una incorporación reflexiva en la práctica diaria es tanto factible como esencial para entregarse de forma más oportuna, i
References
1. Wainstein MV, Machado GP, Telo GH, da Silveira AD, Nasi LA, de Araujo GN. Point-of-care ultrasound in the evaluation of STEMI patients. Front Cardiovasc Med 2025;12:1627396.
2. Cardinale L, Priola AM, Moretti F, Volpicelli G. Effectiveness of chest radiography, lung ultrasound and thoracic computed tomography in the diagnosis of congestive heart fail ure. World J Radiol 2014;6:230–7.
3. Maw AM, Hassanin A, Ho PM, McInnes MDF, Moss A, Juarez-Colunga E et al. Diagnostic accuracy of point-of-care lung ultrasonography and chest radiography in adults with symptoms suggestive of acute decompensated heart failure: a systematic review and meta-analysis. JAMA Netw Open 2019;2:e190703.
4. Telo GH, Saadi MP, Silvano GP, da Silveira AD, Biolo A. Contribution of lung ultrasound and VExUS in the diagnosis and monitoring of patients with heart failure. ABC Heart Fail Cardiomyop 2024;4:e20240010.
5. Soliman Aboumarie H, Tavazzi G, Via G, Guarracino F, Stankovic I, Hagendorff A et al. Cardiac ultrasound in cardiovascular emergency and critical care. A clinical consensus statement of the European Association of Cardiovascular Imaging (EACVI), the Acute CardioVascular Care Association (ACVC) of the ESC, and the European Association of Cardiothoracic Anaesthesia and Intensive Care (EACTAIC). Eur Heart J Cardiovasc Imaging 2025;26:1699–724.
6. Picano E, Scali MC, Ciampi Q, Lichtenstein D. Lung ultrasound for the cardiologist. JACC Cardiovasc Imaging 2018;11:1692–705.
7. Volpicelli G, Elbarbary M, Blaivas M, Lichtenstein DA, Mathis G, Kirkpatrick AW et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med 2012;38:577–91.
8. Gargani L, Girerd N, Platz E, Pellicori P, Stankovic I, Palazzuoli A et al. Lung ultrasound in acute and chronic heart failure: a clinical consensus statement of the European Association of Cardiovascular Imaging (EACVI). Eur Heart J Cardiovasc Imaging 2023; 24:1569–82.
9. Beaubien-Souligny W, Rola P, Haycock K, Bouchard J, Lamarche Y, Spiegel R et al. Quantifying systemic congestion with Point-Of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J 2020;12:16.
10. Soliman-Aboumarie H, Denault AY. How to assess systemic venous congestion with point of care ultrasound. Eur Heart J Cardiovasc Imaging 2023;24:177–80.
11. Rola P, Haycock K, Spiegel R, Beaubien-Souligny W, Denault A. VExUS: common mis conceptions, clinical use and future directions. Ultrasound J 2024;16:49.
12. Bhardwaj V, Vikneswaran G, Rola P, Raju S, Bhat RS, Jayakumar A et al. Combination of Inferior vena cava diameter, hepatic venous flow, and portal vein pulsatility index: ven ous excess ultrasound score (VEXUS score) in predicting acute kidney injury in patients with cardiorenal syndrome: a prospective cohort study. Indian J Crit Care Med 2020;24: 783–9.
13. Martin KC, Gill EA, Douglas IJ, Longino AA. Evaluation of a modified venous excess ultrasound (VExUS) protocol for estimation of venous congestion: a cohort study. Ultrasound J 2025;17:7.
14. Saadi MP, Silvano GP, Machado GP, Almeida RF, Scolari FL, Biolo A et al. Modified ven ous excess ultrasound: a dynamic tool to predict mortality in acute decompensated heart failure. J Am Soc Echocardiogr 2025. https://doi.org/10.1016/j.echo.2025.08.011
15. Saadi MP, Machado GP, Silvano GP, da Rosa Barbato JP, Almeida RF, Scolari FL et al. Assessment of interrater reliability in point-of-care ultrasound for assessing congestion in cardiovascular intensive care. ABC Imagem Cardiovascular 2025;38:e20250022.
16. Koratala A, Reisinger N. Venous excess Doppler ultrasound for the nephrologist: pearls and pitfalls. Kidney Med 2022;4:100482.
17. Soliman-Aboumarie H, Vandenbriele C, Baldetti L, Balthazar T, Ott S, Hernandez-Montfort J et al. Echocardiography for short-term mechanical circulatory support: a trans-Atlantic practical guide. Eur Heart J Imaging Methods Pract 2025;3: qyaf067. 18. Jentzer JC, Tabi M, Wiley BM, Lanspa MJ, Anavekar NS, Oh JK. Doppler-derived haemo dynamics performed during admission echocardiography predict in-hospital mortality in cardiac intensive care unit patients. Eur Heart J Acute Cardiovasc Care 2022;11:640–50.
19. Machado GP, Telo GH, de Araujo GN, da Rosa Barbato JP, Amon A, Martins A et al. A combination of left ventricular outflow tract velocity time integral and lung ultrasound to predict mortality in ST elevation myocardial infarction. Intern Emerg Med 2024;19: 2167–76. 20. Gentile F, Sciarrone P, Panichella G, Bazan L, Chubuchny V, Buoncristiani F et al. Echocardiography-derived forward left ventricular output improves risk prediction in systolic heart failure. J Am Soc Echocardiogr 2024;37:937–46.
21. Hubert A, Girerd N, Le Breton H, Galli E, Latar I, Fournet M et al. Diagnostic accuracy of lung ultrasound for identification of elevated left ventricular filling pressure. Int J Cardiol 2019;281:62–8.
22. Szekely Y, Brahmbhatt DH, Scolari FL, Doumouras BS, Billia F. Lung ultrasound predicts left-sided filling pressures in patients with cardiogenic shock admitted to the cardiac in tensive care unit. Eur Heart J 2022;43:ehac544.1491.
23. Longino A, Martin K, Leyba K, Siegel G, Gill E, Douglas IS et al. Correlation between the VExUS score and right atrial pressure: a pilot prospective observational study. Crit Care 2023;27:205.
24. Iacovoni A, Giaccherini C, Paris S, Abete R, Vittori C, Inciardi RM et al. Ultrasound as sessment of venous and pulmonary congestion in left ventricular assist devices patients. Artif Organs 2025;49:1171–84.
25. Martindale JL, Wakai A, Collins SP, Levy PD, Diercks D, Hiestand BC et al. Diagnosing acute heart failure in the emergency department: a systematic review and meta-analysis. Acad Emerg Med 2016;23:223–42.
26. Pivetta E, Goffi A, Nazerian P, Castagno D, Tozzetti C, Tizzani P et al. Lung ultrasound integrated with clinical assessment for the diagnosis of acute decompensated heart fail ure in the emergency department: a randomized controlled trial. Eur J Heart Fail 2019; 21:754–66.
27. Núñez-Ramos JA, Aguirre-Acevedo DC, Pana-Toloza MC. Point of care ultrasound im pact in acute heart failure hospitalization: a retrospective cohort study. Am J Emerg Med 2023;66:141–5.
28. Aslaner MA, Helvacı Ö, Haycock K, Kılıçaslan I ̇ , Yaşar E, Cerit MN et al. Diagnostic ac curacy of venous system ultrasound for subtypes of acute kidney injury. Emerg Med J 2024;41:304–10.
29. Beaubien-Souligny W, Eljaiek R, Fortier A, Lamarche Y, Liszkowski M, Bouchard J et al. The association between pulsatile portal flow and acute kidney injury after cardiac sur gery: a retrospective cohort study. J Cardiothorac Vasc Anesth 2018;32:1780–7.
30. Coiro S, Porot G, Rossignol P, Ambrosio G, Carluccio E, Tritto I et al. Prognostic value of pulmonary congestion assessed by lung ultrasound imaging during heart failure hos pitalisation: a two-centre cohort study. Sci Rep 2016;6:39426. Downloaded from https://academic.oup.com/ehjimp/article/4/1/qyaf147/8407920 by guest on 06 January 2026 11 Point-of-care ultrasound in cardiopulmonary diagnostics
31. Takagi R, Kobayashi M, Kuwahara A, Takihara K, Yamashita Y, Deguchi H et al. Trajectory, correlates, and outcomes of pulmonary congestion by lung ultrasound in pa tients hospitalized for acute pulmonary edema. Int J Cardiol 2025;438:133599.
32. Cogliati C, Casazza G, Ceriani E, Torzillo D, Furlotti S, Bossi I et al. Lung ultrasound and short-term prognosis in heart failure patients. Int J Cardiol 2016;218:104–8. 33. Platz E, Merz AA, Jhund PS, Vazir A, Campbell R, McMurray JJ. Dynamic changes and prognostic value of pulmonary congestion by lung ultrasound in acute and chronic heart failure: a systematic review. Eur J Heart Fail 2017;19:1154–63.
34. Anastasiou V, Peteinidou E, Moysidis DV, Daios S, Gogos C, Liatsos AC et al. Multiorgan congestion assessment by venous excess ultrasound score in acute heart failure. J Am Soc Echocardiogr 2024;37:923–33.
35. Saadi M, Silvano GP, Telo GH, Scolari FL, Machado GP, Almeida RF et al. VExUS score improvement is associated with better outcomes in acute decompensated heart failure. Eur Heart J 2024;45:ehae666.1198.
36. Rinaldi PM, Rihl MF, Boniatti MM. VExUS score at discharge as a predictor of readmis sion in patients with acute decompensated heart failure: a cohort study. Arq Bras Cardiol 2024;121:e20230745.
37. Campos-Sáenz de Santamaría A, Albines Fiestas ZS, Crespo-Aznarez S, Esterellas-Sánchez LK, Sánchez-Marteles M, Garcés-Horna V et al. VExUS protocol along cardiorenal syndrome: an updated review. J Clin Med 2025;14:1334.
38. Abu-Naeima E, Fatthy M, Shalaby MAAS, Ayeldeen G, Verbrugge FH, Rola P et al. Venous excess Doppler ultrasound assessment and loop diuretic efficiency in acute car diorenal syndrome. BMC Nephrol 2025;26:157.
39. Islas-Rodríguez JP, Miranda-Aquino T, Romero-González G, Hernández-Del Rio J, Camacho-Guerrero JR, Covarrubias-Villa S et al. Effect on kidney function recovery guiding decongestion with VExUS in patients with cardiorenal syndrome 1: a rando mized control trial. Cardiorenal Med 2024;14:1–11.
40. Argaiz ER, Koratala A, Reisinger N. Comprehensive assessment of fluid status by point-of-care ultrasonography. Kidney360 2021;2:1326–38.
41. Araujo GN, Silveira AD, Scolari FL, Custodio JL, Marques FP, Beltrame R et al. Admission bedside lung ultrasound reclassifies mortality prediction in patients with ST-segment-elevation myocardial infarction. Circ Cardiovasc Imaging 2020;13:e010269.
42. Carreras-Mora J, Vidal-Burdeus M, Rodríguez-González C, Simón-Ramón C, Rodríguez-Sotelo L, Sionis A et al. Lung ultrasound in the acute phase of ST-segment-elevation acute myocardial infarction: 1-year prognosis and improvement in risk prediction. J Am Heart Assoc 2024;13:e035688.
43. Machado GP, Telo GH, de Araujo GN, da Silveira AD, Wainstein M. Comparing ultrasound-based prognostic classifications in STEMI: is LUV better than LUCK? Intern Emerg Med 2025;20:1645–7.
44. de Araujo GN, Beltrame R, Machado GP, Custodio JL, Zimerman A, da Silveira AD et al. Comparison of admission lung ultrasound and left ventricular end-diastolic pressure in patients undergoing primary percutaneous coronary intervention. Circ Cardiovasc Imaging 2021;14:e011641.
45. Machado GP, Telo GH, Barbato JPDR, Saadi MP, Araujo GN, Chies A et al. Venous ex cess ultrasound (VExUS) score in patients with ST-elevation myocardial infarction to predict in-hospital mortality. Arq Bras Cardiol 2025;122:e20250093.
46. Viana-Rojas JA, Argaiz E, Robles-Ledesma M, Arias-Mendoza A, Nájera-Rojas NA, Alonso-Bringas AP et al. Venous excess ultrasound score and acute kidney injury in pa tients with acute coronary syndrome. Eur Heart J Acute Cardiovasc Care 2023;12:413–9.
47. Basmaji J, Tang JE, Arntfield R, Desai K, Ball IM, Fiorini K et al. The diagnostic accuracy of point-of-care ultrasound in shock: a systematic review and meta-analysis. Can J Anaesth 2025;72:1118–29.
48. Tehrani BN, Truesdell AG, Psotka MA, Rosner C, Singh R, Sinha SS et al. A standardized and comprehensive approach to the management of cardiogenic shock. JACC Heart Fail 2020;8:879–91.
49. Frea S, Gravinese C, Boretto P, De Lio G, Bocchino PP, Angelini F et al. Comprehensive non-invasive haemodynamic assessment in acute decompensated heart failure-related cardiogenic shock: a step towards echodynamics. Eur Heart J Acute Cardiovasc Care 2024;13:646–55.
50. Ezad SM, Ryan M, Donker DW, Pappalardo F, Barrett N, Camporota L et al. Unloading the left ventricle in venoarterial ECMO: in whom, when, and how? Circulation 2023;147: 1237–50.
51. Tavazzi G, Colombo CNJ, Pagnesi M, Bertaina M, Montisci A, Frea S et al. Lung ultra sound and mortality in a cardiogenic shock population: a prospective registry-based ana lysis. Eur J Heart Fail 2025. https://doi.org/10.1002/ejhf.3692 52. Scolari FL, Machado GP, Pagnoncelli A, Chies A, de Araujo GN, da Silveira AD et al. Lung ultrasound evaluation of SCAI shock stages predicts mortality in ST-segment elevation myocardial infarction. JACC Cardiovasc Imaging 2023;16:260–2.
53. Kovacevic M, Cooper JM, Krater R. Point-of-care ultrasound in early identification of tamponade: a case series. Cureus 2025;17:e78823. 54. Hanson MG, Chan B. The role of point-of-care ultrasound in the diagnosis of pericardial effusion: a single academic center retrospective study. Ultrasound J 2021;13:2.
55. Argaiz ER, Rola P, Haycock KH, Verbrugge FH. Fluid management in acute kidney injury: from evaluating fluid responsiveness towards assessment of fluid tolerance. Eur Heart J Acute Cardiovasc Care 2022;11:786–93.
56. Breunig M, Chelf C, Kashiwagi D. Point-of-care ultrasound psychomotor learning curves: a systematic review of the literature. J Ultrasound Med 2024;43:1363–73.
57. Amon A, Machado GP, Azevedo WTA, Saadi MP, Scolari FL, Telo GH et al. Impact of a cardiothoracic ultrasound protocol in patients with ST-elevation myocardial infarction: the Focused Assessment in STEMI (FASTEMI) protocol. Eur Heart J 2024;45: ehae666.1723.
58. Fortuni F, Ciliberti G, De Chiara B, Conte E, Franchin L, Musella F et al. Advancements and applications of artificial intelligence in cardiovascular imaging: a comprehensive re view. Eur Heart J Imaging Methods Pract 2024;2:qyae136.
59. Sabo S, Pettersen H, Bøen GC, Jakobsen EO, Langøy PK, Nilsen HO et al. Real-time guidance and automated measurements using deep learning to improve echocardio graphic assessment of left ventricular size and function. Eur Heart J Imaging Methods Pract 2025;3:qyaf094