Kai Hubel a 1,Florian Kron a b 1,Michael Patrick Lux c
https://doi.org/10.1016/j.ejca.2020.07.037
Conceptos.
Potencial de ahorro para mantenimiento con trastuzumab, rituximab y terapias de apoyo, p. G-CSF.
El uso de biosimilares puede liberar enormes recursos para el sistema de salud.
Los ahorros se pueden utilizar para compensar la financiación de nuevas terapias innovadoras.
El potencial de ahorro de los biosimilares aún no se explota por completo.
Las campañas podrían aumentar la conciencia económica y la implementación de biosimilares.
Abstrac
Apuntar
La introducción de opciones de tratamiento nuevas e innovadoras para pacientes con cáncer va acompañada de un enorme aumento en los costos de atención médica. En consecuencia, se necesitan con urgencia nuevos enfoques de financiación para reducir la carga sobre el sistema sanitario.
La introducción de biosimilares ( fármacos biológicos que contienen el principio activo de un fármaco biológico de referencia ya aprobado) puede aliviar potencialmente la carga de los sistemas sanitarios. Al calcular los costos de tres biosimilares de uso frecuente, simulamos el impacto económico en la salud de los biosimilares en el mundo real para el sistema de salud alemán.
Métodos
Según los análisis económicos de la salud disponibles, la prescripción real y el potencial de contención de costos de los biosimilares en comparación con el original se calcularon de manera ejemplar para las terapias costosas trastuzumab en el cáncer de mama, rituximab en el linfoma folicular y G-CSF en la atención de apoyo. Los cálculos de incidencia se basaron, por ejemplo, en datos de la Institución Robert-Koch, Registro de Cáncer de Munich e indicadores de calidad de centros certificados. El cálculo de costos se basó en Lauer-Taxe® (referencia oficial para información de precios farmacéuticos).
Resultados
La aplicación de biosimilares generaría ahorros anuales potenciales para los ejemplos elegidos de hasta 4,9 Mio EUR para rituximab en linfoma folicular, 40,5 Mio EUR para filgrastim , 56,4 Mio EUR para pegfilgrastim y entre 95,9 y 120,5 Mio EUR para trastuzumab.
Conclusiones
El uso consecuente de biosimilares permite una reducción considerable de los costos generales del tratamiento, especialmente para tratamientos de mantenimiento a largo plazo costosos y terapias con altas incidencias. Si se aprovecha al máximo la opción del uso de biosimilares, se podrían liberar enormes recursos dentro del sistema de salud para compensar la financiación de nuevas terapias innovadoras
1 . Introducción
Los avances en la comprensión de la biología del cáncer permitieron el desarrollo de tratamientos innovadores contra el cáncer, como terapias dirigidas o personalizadas. Durante los últimos 20 años, los medicamentos biológicos se han convertido en una parte integral y efectiva en oncología y otras áreas de enfermedades. Por otro lado, se espera que los costos de atención médica continúen aumentando. Entre 1995 y 2013, el precio medio de lanzamiento de los medicamentos contra el cáncer aumentó un 10 % cada año [ 1 ]. En Europa, el gasto sanitario en cáncer aumentó de 35 700 millones EUR en 1995 a 83 200 millones EUR en 2014, y el gasto en medicamentos contra el cáncer aumentó en el mismo período de 7 600 millones EUR a 19 100 millones EUR [ 2]. En 2009, entre los 27 países de la UE, los costes sanitarios del cáncer por ciudadano variaron sustancialmente de 16 EUR en Bulgaria a 182 EUR en Alemania o 184 EUR en Luxemburgo [3 ] . Aunque la parte del gasto total dedicada a la medicina del cáncer se ha mantenido estable en gran medida en Alemania desde 2004 [ 4 ], se necesitan nuevos enfoques de financiación para evitar que la carga financiera de la sociedad se vuelva insoportable.
Para garantizar el reembolso de los costos de investigación y desarrollo, la aprobación de un medicamento biológico va seguida de un período de protección del mercado. Una vez que expira este período, generalmente después de 10 años, el uso de biosimilares está legalmente permitido. Los biosimilares son productos biológicos que contienen una copia de la sustancia activa de un producto biológico original ya autorizado (producto de referencia) en el Espacio Económico Europeo. Los biosimilares difieren de los medicamentos genéricos , incluido el tamaño de la sustancia activa, su complejidad y la naturaleza del proceso de fabricación. La extensa comparación de las características fisicoquímicas y funcionales del biosimilar con el producto de referencia es la base del desarrollo del biosimilar ( Fig. 1) [ 5 ]. Por lo tanto, es necesario establecer la similitud con el producto de referencia [ 6 ]. Si se ha demostrado la biosimilitud, la extrapolación de los datos de eficacia y seguridad a otras indicaciones del producto de referencia puede ser posible cuando el mecanismo de acción es el mismo entre las diferentes indicaciones y el perfil de seguridad del biosimilar se caracteriza adecuadamente y se excluye la inmunogenicidad inaceptable [ 5 ]. Por lo tanto, una repetición de los ensayos clínicosya se puede evitar con el medicamento de referencia, lo que reduce los costos de desarrollo de los biosimilares, que por lo tanto pueden estar disponibles a un precio más bajo. Además, la entrada de biosimilares en el mercado europeo dio lugar a reducciones de precios competitivos no solo entre los biosimilares sino también con respecto a los medicamentos de referencia [ 7 , 8 ]. En consecuencia, la introducción de biosimilares posiblemente pueda aliviar la carga sobre la atención médica. Aquí, demostramos el impacto potencial en la salud y la economía de los biosimilares al presentar tres ejemplos de cálculo en diferentes entidades (rituximab, trastuzumab , G-CSF).

Figura 1 . Pasos en el proceso de aprobación de producto de referencia y biosimilar.
2 . Métodos
Según los análisis económicos de la salud disponibles, el potencial de ahorro real de los biosimilares se determinó de manera ejemplar para rituximab , trastuzumab y G-CSF (filgrastim y pegfilgrastim). Entre las indicaciones de rituximab y trastuzumab, seleccionamos de manera ejemplar el linfoma folicular y el cáncer de mama, respectivamente, para evitar que los cálculos se vuelvan demasiado complejos con múltiples indicaciones. Se compararon los costos asociados del original y el biosimilar para determinar el potencial de ahorro para el sistema de salud alemán en el mundo real. Se aplicaron diferentes enfoques para los cálculos. Los cálculos detallados se presentan en el Apéndice 1 .
2.1 . Rituximab
Para evaluar los costes anuales potenciales de ahorro de rituximab, se calcularon los costes de los pacientes con seguro médico obligatorio que recibían rituximab para el linfoma folicular ( Tabla A1 ). Los cálculos se basaron en los precios mayoristas de farmacia según Lauer-Taxe®, una referencia oficial para la información de precios farmacéuticos [ 9 ] (estado de enero de 2020). Se incluyeron deducción fiscal (4,2 % para el producto de referencia y 7,5 % para biosimilares), tasa fija del fabricante para anticuerpos (71 EUR), IVA (19 %) y devolución del fabricante. La dosis recomendada para el tratamiento de inducción de pacientes con linfoma folicular (ICD10C82) no tratados previamente o en recaída/refractarios es de 375 mg/m 2superficie corporal por ciclo durante 6 ciclos [ 10 ]. Los cálculos se basaron en la suposición de que se usaron 6 ciclos de 675 mg por paciente por año en la terapia de primera línea. El tratamiento de mantenimiento no se consideró en los cálculos para que los resultados puedan transferirse a otras entidades (p. ej., linfoma difuso de células B grandes, linfoma de células del manto). No se consideró la medicación desechada. Para cubrir todos los biosimilares disponibles, se consideraron las cuotas de mercado respectivas de Rixathon® y Truxima®.
2.2 . Trastuzumab
Para trastuzumab, los costes se calcularon para pacientes aseguradas que recibieron trastuzumab para cáncer de mama en entornos (neo)adyuvantes y metastásicos. Debido a las diferentes cifras de incidencia de cáncer de mama HER2 positivo de diversas fuentes [ [11] , [12] , [13] , [14] , [15] , [16] , [17] , [18] ], el mínimo y se utilizó la tasa máxima. Se asumió un peso medio de 70,7 kg para los cálculos de dosis [ 19 ]. La dosis de carga (durante 3 semanas) y de mantenimiento para la administración Q3W de trastuzumab fue de 8 mg/kg y 6 mg/kg, respectivamente [ 20] .]. En el entorno (neo)adyuvante, las pacientes con cáncer de mama temprano reciben tratamiento con trastuzumab durante un año [ 20 ], lo que corresponde a 17 ciclos. Debido a la complejidad del entorno metastásico, se hicieron las siguientes suposiciones: El tratamiento estándar de primera línea es trastuzumab en combinación con pertuzumab y taxano. En cuanto al ensayo Cleopatra, los pacientes recibieron una media de 24 ciclos durante 17,4 meses [ 21]. Este período cubre diferentes líneas de tratamiento en el sentido de un análisis transversal y se basa en el supuesto de una tasa de incidencia anual constante. Suponiendo que la supervivencia global en el entorno metastásico es de 56,5 meses (según el seguimiento del ensayo Cleopatra), el tiempo de supervivencia restante tras finalizar el tratamiento es de 39,1 meses. Suponiendo que los pacientes en segunda línea que reciben T-DM1 logran una supervivencia libre de progresión de 9,1 meses seguidos de lapatinib/capecitabina, lo que da como resultado una supervivencia libre de progresión de 6,4 meses, el tiempo de supervivencia medio restante es de 23,6 meses. Suponiendo que los pacientes reciban posteriormente una combinación de quimioterapia con trastuzumab y que el tiempo de cuidados intensivos amplíe la esperanza de vida a 3 meses, la duración del tratamiento con trastuzumab en la línea posterior es de 20,6 meses, lo que corresponde a 27 ciclos.9 ] excluyendo descuentos e importaciones paralelas. No se consideró la medicación desechada. Debido a la complejidad de los cálculos, el potencial de ahorro se calculó por separado para todos los biosimilares disponibles ( Apéndice 1, Tabla A2 ). Aquí presentamos los resultados del biosimilar con los costos más bajos.
2.3 . G-CSF
Para G-CSF, los costos se calcularon para pacientes con seguro médico que recibieron filgrastim o pegfilgrastim para la prevención de la neutropenia ( Tablas A3 y A4 ). Para determinar el uso anual de G-CSF, se analizaron todos los datos de prescripción entre enero y diciembre de 2018 de la base de datos de la organización de investigación por contrato IQVIA [ 22 ]. Filgrastim debe administrarse diariamente hasta que el recuento de neutrófilos se haya recuperado al rango normal. En la práctica clínica, la duración del tratamiento con filgrastim por ciclo de quimioterapia suele ser inferior a 7 días [ 23 ], con una duración media de 5,1 a 5,5 días [ 24 , 25]. Filgrastim está disponible en dos concentraciones: Las jeringas precargadas contienen 30 Mio. UI o 48 Mio. UI, aprobado para pacientes con un peso corporal de hasta 60 kg y 96 kg, respectivamente. Basado en el análisis de Hadji et al. [ 26 ], se asumió que el 75 % y el 25 % de las inyecciones administradas utilizaron la solución de 30 Mio UI y 48 Mio UI, respectivamente. Un precio de referencia fijo dentro del medicamento filgrastimgrupo se introdujo en octubre de 2018. Los precios de referencia fijos se definen si se determinan diferencias de precios significativas con las cuotas de suministro relevantes dentro de un grupo de medicamentos. Si los biosimilares constituyen una parte significativa de las prescripciones dentro del grupo de medicamentos, su diferencia de precio frente al biológico de referencia se vuelve relevante para el precio de referencia fijo. Los precios de filgrastim antes de octubre de 2018 se basaron en el biológico de referencia Neupogen® (Amgen) y los biosimilares Filgrastim HEXAL® (Hexal), Ratiograstim® (Ratiopharm) y Nivestim® (Pfizer). Las cuotas de mercado en el mercado alemán de G-CSF de acción corta (SA) de biosimilares Accofil® (Accord) y Grastofil® (Stada) son insignificantes (<3% en total [ 22]), por lo que no se consideraron sus precios. Como los precios entre los biosimilares de filgrastim no difirieron, se calculó el potencial de ahorro para los biosimilares de filgrastim en general. El pegfilgrastim G-CSF de acción prolongada (LA) está disponible en dosis de 6 mg/0,6 ml y se administra por vía subcutánea una vez por ciclo de quimioterapia, al menos 24 h después de la administración de quimioterapia. El primer biosimilar de pegfilgrastim se lanzó en el mercado alemán en septiembre de 2018. En 2018, la cuota de mercado media de biosimilares representó solo el 0,4 % [ 22] y, por lo tanto, se descuidó en el cálculo. A partir del 3/2020, tres biosimilares están disponibles comercialmente en el mercado alemán: Ziextenzo® (Sandoz/Hexal), Pelgraz® (Accord) y Pelmeg® (Mundipharma) ofrecen precios minoristas de farmacia un 27 % por debajo del biológico de referencia Neulasta (Amgen) . Como los precios entre los biosimilares de pegfilgrastim no difirieron, se calculó el potencial de ahorro para los biosimilares de pegfilgrastim en general. Todos los cálculos se basaron en los precios minoristas de las farmacias de acuerdo con Lauer-Taxe® [ 9 ], excluyendo los descuentos y las importaciones paralelas. No se consideró la medicación desechada.
3 . Resultados
3.1 . Rituximab
El número anual de pacientes con linfoma folicular recién diagnosticado en Alemania es de 3100 [ 27 ]. Suponiendo que hasta el 20 % de los pacientes tendrán enfermedad en estadio I/II que no requerirá rituximab y el 10 % de los pacientes nunca necesitarán tratamiento , el 70 % de los pacientes recibirán rituximab durante el curso de la enfermedad. En Alemania, el coste anual del producto de referencia (Mabthera®, Roche) asciende a 33,01 Mio EUR. Teniendo en cuenta una cuota de mercado del 60,8 % y el 39,2 % para los biosimilares actualmente disponibles Rixathon® y Truxima®, respectivamente, el coste anual asciende a 28,09 Mio EUR para la combinación de productos biosimilares. Así, el potencial de ahorro anual por uso exclusivo de biosimilares sería de 4,92 Mio EUR ( Fig. 2 ).
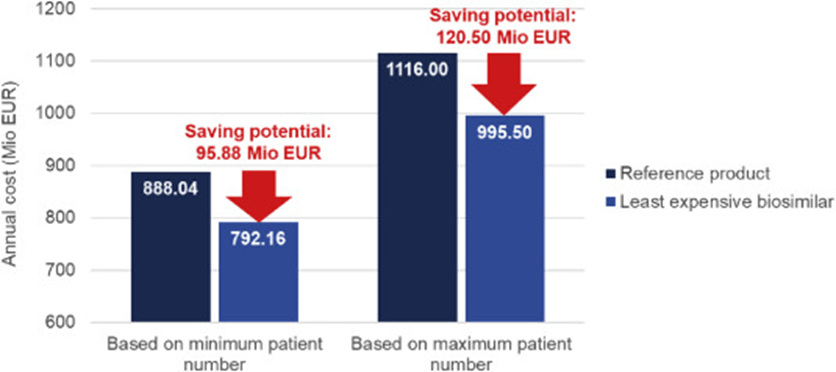
figura 2 Cálculo del potencial de ahorro de los biosimilares de rituximab en pacientes con linfoma folicular.
3.2 . Trastuzumab
A partir del 3/2020, cinco biosimilares están disponibles comercialmente en el mercado alemán: Kanjinti® (Amgen), Ontruzant® (MSD), Herzuma® (Mundipharma), Ogivri® (Mylan) y Trazimera® (Pfizer). Trazimera® (Pfizer) es en realidad el biosimilar menos costoso con costos 10.8% por debajo del biológico de referencia Herceptin® (Roche). Según cálculos basados en diversas fuentes, el número de pacientes con cáncer de mama HER2 positivo que reciben trastuzumab en tratamiento (neo)adyuvante y metastásico oscila entre 8.199 y 14.380 y entre 4.643 y 4.670 casos/año, respectivamente. Teniendo en cuenta los informes de los centros certificados, el 14,81% de los pacientes en (neo)adyuvancia no reciben trastuzumab debido a comorbilidades , edad avanzada o tamaño tumoral pequeño (pT1a) [ 28] .], el número real utilizado para los siguientes cálculos oscila entre 6.985 y 12.250. El número correspondiente de ciclos/año varía de 118.745 a 208.250 en el (neo-)adyuvante y de 236.793 a 238.170 en el marco metastásico. El potencial de ahorro anual ascendería a un rango de 95,9 Mio EUR a 120,5 Mio EUR si todos los pacientes recibieran el biosimilar de trastuzumab menos costoso en comparación con el fármaco original ( Fig. 3 ).
Figura 3 . Cálculo del potencial de ahorro de los biosimilares de trastuzumab. Debido a los diferentes números de incidencia para el cáncer de mama HER2 positivo de varias fuentes, se proporcionan cálculos para el número mínimo y máximo de pacientes.
3.3 . G-CSF
En 2018, se prescribieron un total de 733 139 jeringas de filgrastim con una cuota de mercado media de biosimilares del 82 % del mercado de filgrastim en Alemania [ 22 ]. Los costes totales de filgrastim basados en los precios minoristas de las farmacias en 2018 ascendieron a 108,97 millones. EUR. Sin el uso de biosimilares y la implementación de precios de referencia fijos debido a la penetración significativa de biosimilares, los costos totales de filgrastim habrían ascendido a 149,47 Mio. EUR. Así, ahorros de hasta 40,5 Mio. EUR por año se han realizado con una cuota de mercado de biosimilares del 82% y precios de referencia fijos ( Fig. 4 ).
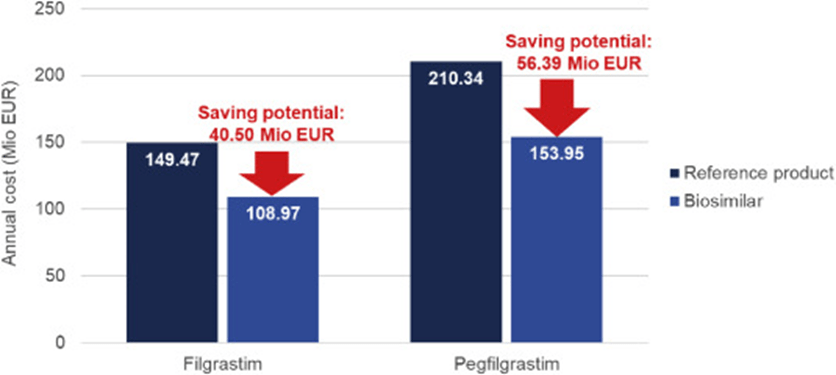
Figura 4 . Cálculo de los potenciales de ahorro de los biosimilares de filgrastim y pegfilgrastim.
En 2018, se prescribieron un total de 120 869 jeringas de pegfilgrastim en Alemania [ 22 ]. Los costes totales de pegfilgrastim basados en los precios minoristas de las farmacias ascendieron a 210,34 Mio EUR en 2018. Si los biosimilares de pegfilgrastim se hubieran recetado exclusivamente, el coste anual habría ascendido a 153,95 Mio EUR. Por lo tanto, los biosimilares de pegfilgrastim ofrecen un ahorro anual potencial de 56,39 Mio EUR ( Fig. 4 ). El primer biosimilar de pegfilgrastim recibió una autorización de comercialización válida en toda la UE en septiembre de 2018 y está disponible para su compra en el mercado minorista alemán desde el 15 de octubre de 2018. En junio de 2019, los biosimilares de pegfilgrastim tenían una cuota de mercado de solo el 22 % [ 29 ] .
La introducción de biosimilares condujo a la implementación de precios de referencia fijos dentro del grupo filgrastim y la consiguiente generación de ahorros significativos a nivel de paciente. El siguiente ejemplo de caso de una paciente con cáncer de mama de alto riesgo con receptores de hormonas positivos (HR+)/HER2 negativos que pesa 71 kg y que está siendo tratada con dosis intensificadas de epirubicina/paclitaxel/ciclofosfamida (ETC) [ 30 ] debería ilustrar el posible potencial de ahorro . Basado en el alto riesgo de neutropenia febril (>20%) [ 30], la profilaxis primaria con G-CSF se inició en el ciclo 1 y continuó hasta el ciclo 9. Se administraron 6 mg de pegfilgrastim el día 2 por ciclo de quimioterapia. Como alternativa, se habrían administrado 30 millones de UI de filgrastim en los días 3 a 10 por ciclo de quimioterapia. Al recetar un biosimilar de filgrastim, se podrían haber generado ahorros de hasta 5093 EUR por paciente en comparación con los costos del producto original antes de la implementación del precio de referencia. Fue la introducción de biosimilares lo que condujo a la reducción general de precios. Al prescribir un biosimilar de pegfilgrastim, se podría haber generado un ahorro de hasta 4199 EUR por paciente en comparación con los costos del producto original ( Tabla 1 ).
Tabla 1 . Estudio de caso de un paciente que recibe profilaxis primaria con G-CSF durante 9 ciclos de quimioterapia con dosis intensificadas de epirubicina/paclitaxel/ciclofosfamida: Cálculo de los potenciales de ahorro de los biosimilares de filgrastim y pegfilgrastim, respectivamente [∗ no se tiene en cuenta el precio de referencia].
| Filgrastim | |
| Ciclo de tratamiento 1–9 (cada día administrado 3–10) | |
| Costes estimados producto original∗ [€] | 16,047 |
| Costes estimados biosimilar∗ [€] | 10,954 |
| Ahorro potencial estimado al prescribir biosimilar∗ [€] | 5,093 |
| Pegfilgrastim | |
| Ciclo de tratamiento 1-9 | |
| Costes estimados producto originario [€] | 15,662 |
| Costes estimados biosimilar [€] | 11,463 |
| Ahorro potencial estimado al prescribir biosimilar [€] | 4,199 |
4 . Discusión
En general, se acepta que los biosimilares pueden aliviar potencialmente la carga económica del sistema de salud. Nuestros resultados indican que el potencial de ahorro es particularmente alto para el tratamiento de mantenimiento a largo plazo costoso, como trastuzumab para el cáncer de mama y terapias con altas incidencias, como la terapia de apoyo con G-CSF. Hasta donde sabemos, este fue el primer análisis de costos que calculó el potencial de ahorro que se puede lograr al cambiar de un producto de referencia a un biosimilar durante un año, teniendo en cuenta a todos los pacientes de las indicaciones respectivas si se tratan de acuerdo con las pautas. Los análisis de rentabilidad anteriores proporcionaron datos para Europa y los EE. UU. para G-CSF para un paciente durante un ciclo de quimioterapia solamente [ [31] , [32] ,[33] ].
Los ahorros obtenidos por el uso de biosimilares podrían permitir la reasignación de presupuestos para facilitar el tratamiento óptimo del paciente. En este contexto, la asequibilidad de los biosimilares puede mejorar el cumplimiento de las pautas y mejorar el acceso a la atención en áreas desatendidas. Además, se conservan recursos para compensar la financiación de nuevas terapias innovadoras, como las células CAR-T y las terapias dirigidas..
A escala global, la presencia de múltiples fabricantes de biosimilares garantiza la seguridad de los suministros. La acumulación de existencias permite el apoyo en caso de situaciones impredecibles, como la actual pandemia de COVID-19, y minimiza el riesgo de escasez de suministro. Los ahorros obtenidos con la introducción de biosimilares se pueden utilizar para mantener las capacidades de producción en los países europeos. Además de asegurar una mayor competitividad entre los diferentes proveedores médicos, la creciente aparición de biosimilares también facilita la medicina personalizada, es decir, la sociedad puede permitirse que individualmente se prescriban los tratamientos más adecuados para los pacientes [ 34]. Debido a su relevancia para los precios de referencia fijos, los biosimilares contribuyen a reducir los precios del grupo de medicamentos, incluido el producto de referencia, lo que alivia aún más la carga financiera del sistema de salud.
A pesar de los beneficios obvios que se pueden lograr con la prescripción de biosimilares, los datos de marketing actuales indican que el potencial de ahorro aún no se está explotando por completo. Por ejemplo, en 2019, las prescripciones de biosimilares representaban solo una pequeña fracción (7,2 %) del mercado biofarmacéutico alemán total [ 35 ]. En particular, las cuotas de mercado de los biosimilares de insulina lispro e insulina glargina fueron extremadamente bajas (3,3 % y 11,5 % de las dosis diarias definidas, respectivamente). Se observaron mayores proporciones para los biosimilares discutidos aquí: el 61,8 % de las prescripciones de trastuzumab, el 79,1 % de las prescripciones de rituximab, el 35,5 % de pegfilgrastim y el 76,7 % de las dosis diarias definidas de filgrastim eran biosimilares [ 35]. Este último indica un aumento significativo en comparación con los datos de 2009, cuando solo un tercio de las prescripciones de filgrastim se referían al biosimilar de filgrastim [ 36 ].
Hay varias razones por las que todavía existe una restricción en la prescripción de biosimilares. Muchos médicos albergan preocupaciones al cambiar de un fármaco original bien conocido a un biosimilar, aunque esta preocupación debería ser infundada [ 37 ]. En toda Europa, las cuotas de mercado de los biosimilares varían ampliamente, en parte como consecuencia de las normas inconsistentes sobre cómo los médicos deben abordar el tema de la intercambiabilidad entre el original y el biosimilar [ 34]. En comparación con otros países europeos, Alemania tiene un papel de liderazgo en la cantidad de prescripciones de biosimilares. Con el fin de fomentar la prescripción de biosimilares, las aseguradoras de salud y las asociaciones de médicos se acercaron de manera proactiva a los médicos con campañas educativas que aliviaron las preocupaciones relacionadas con el perfil clínico y destacaron los beneficios económicos del uso de biosimilares [34] .]. En consecuencia, una encuesta realizada en 2018 entre médicos alemanes indicó que la mayoría estaba consciente de que los biosimilares tienen el potencial de aliviar la carga financiera del sistema de salud. Sin embargo, el 25 % de los participantes consideraron otros eventos adversos/desconocidos y la falta de evidencia basada en ensayos, respectivamente, como barreras para recetar biosimilares. El veinte por ciento de los participantes de la encuesta nunca han recetado biosimilares. Alrededor de la mitad de los participantes solicitaron materiales educativos sobre biosimilares de asociaciones de expertos y autoridades reguladoras en lugar de fabricantes y registros prospectivos [ 38 ]. Sin embargo, los registros prospectivos son necesarios para registrar los efectos secundarios a largo plazo [ 39 ].
Este análisis tiene muchas limitaciones. Debido a los acuerdos de descuento individuales, los costos reales de los biosimilares pueden ser más bajos, por lo que el potencial de ahorro extrapolado puede haberse subestimado y puede ser incluso mayor. El cálculo del tamaño de la muestra se basó parcialmente en suposiciones; es decir, es un tamaño estimado que puede ser mayor o menor. No se consideró el sector de hospitalización de acuerdo con los grupos relacionados con el diagnóstico .
En conclusión, la adopción de biosimilares tiene el potencial de mejorar la sostenibilidad de la atención médica en oncología , lo cual es particularmente importante a medida que aumenta la incidencia del cáncer en todo el mundo. Sin embargo, los datos disponibles muestran de manera impresionante que los ahorros potenciales están lejos de agotarse y que, si se explota completamente la opción de los biosimilares, se podrían liberar enormes recursos en el sistema de salud para compensar la financiación de nuevas formas innovadoras de terapia