Stephanie Lazar1 y J. Michelle Kahlenberg2
Systemic Lupus Erythematosus: New Diagnostic and Therapeutic ApproachesStephanie Lazar and J. Michelle KahlenbergAnnual Review of Medicine 2023 74:1, 339-352
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune devastadora que puede resultar en morbilidad y mortalidad sustanciales. El diagnóstico y el tratamiento del LES son desafíos clínicos. La presentación del paciente y la respuesta al tratamiento son heterogéneas debido a la compleja desregulación inmune que da lugar a la patogénesis de la enfermedad del LES. Una intrincada interacción entre el riesgo genético y el sesgo de las respuestas adaptativas e innatas del sistema inmune conduce a la sobreproducción de interferones tipo I y otras citoquinas, la activación del complemento, la deposición del complejo inmunológico y, en última instancia, la inflamación y el daño tisular. Aquí, revisamos los criterios de clasificación, así como las herramientas de diagnóstico estándar y emergentes disponibles para identificar a los pacientes con LES. Luego nos centramos en el tratamiento médico, incluidas las nuevas terapias, las intervenciones no farmacológicas y el tratamiento de la comorbilidad.
El diagnóstico precoz del LES es crucial para prevenir los brotes y el daño tisular resultante. Es importante destacar que el camino hacia el LES comienza antes de la enfermedad clínica. Se han encontrado autoanticuerpos en el suero de pacientes con LES aproximadamente 3-9 años antes del diagnóstico (2). Los anticuerpos antinucleares (ANA), anti-Ro, anti-La y antifosfolípidos son los más tempranos presentes en el suero, y la acumulación de nuevos subtipos de autoanticuerpos generalmente se detiene después del inicio de la enfermedad (2)
Las pruebas de ANA ahora están ampliamente disponibles, y esto ha mejorado el tiempo de retraso hasta el diagnóstico de LES; sin embargo, todavía hay un retraso considerable en el diagnóstico. Un estudio del Reino Unido encontró que en los 5 años anteriores al diagnóstico, los pacientes con LES vieron a su proveedor de atención primaria el doble de veces que los pacientes sin LES por síntomas que incluyen artritis, erupción cutánea, fatiga, serositis, fiebre y otros (3). Los retrasos en el diagnóstico pueden contribuir a las disparidades raciales en el resultado de la enfermedad, ya que los pacientes negros e hispanos con frecuencia presentan manifestaciones más graves en el momento del diagnóstico (4).
Prueba de autoanticuerpos
Los ANA son un grupo de autoanticuerpos que se unen a varios antígenos nucleares y citoplasmáticos (5). El ANA es un biomarcador sensible para la evaluación de sospechas de enfermedades reumáticas asociadas a ANA, más comúnmente LES, y la detección de ANA suele ser un requisito para participar en ensayos clínicos de LES (6). No es útil para el seguimiento de la actividad de la enfermedad (7). Hay tres ensayos primarios para las pruebas de ANA: inmunoensayo enzimático, inmunoensayo multiplex y ensayo de inmunofluorescencia indirecta en células HEp-2, siendo este último el estándar de oro (6, 7).
Hasta el 25% de los pacientes sanos pueden ser ANA positivos, lo que limita la especificidad de la prueba de cribado (8, 9). La mayoría de los pacientes que son ANA positivos nunca desarrollan enfermedad reumática (6). La positividad de ANA es más común entre las mujeres y ciertos grupos étnicos y raciales, incluidos los afroamericanos (8, 10). Muchos individuos sanos con ANA positivo tienen anticuerpos dirigidos al antígeno 70 de las manchas finas densas (DFS70) (11), y los anticuerpos anti-DFS70 son extremadamente raros en pacientes con sospecha de enfermedades reumáticas asociadas a ANA (12).
El panel de antígenos nucleares extraíbles prueba autoanticuerpos específicos que reaccionan con componentes del núcleo celular, revelando 2-11 autoanticuerpos diferentes que tienen implicaciones diagnósticas y pronósticas (5). Aparte de las pruebas de antígenos nucleares extraíbles, las pruebas anti-dsDNA (ADN bicatenario) son altamente específicas para el LES, y los niveles de anticuerpos se correlacionan con la actividad de la enfermedad, particularmente la nefritis lúpica (revisado en 13). La Iniciativa Europea de Normalización de la Autoinmunidad ha estandarizado las características morfológicas de varios patrones (7) que tienen correlatos específicos de antígenos y enfermedades (14) (Cuadro 1).
| Patrón de anticuerpos antinucleares | Objetivos de antígenos asociados | Correlato clínico de la enfermedad |
|---|---|---|
| Homogéneo | dsDNA, histonas, cromatina | LES, LES inducido por fármacos, AIJ, hepatitis autoinmune crónica |
| Denso moteado fino | DFS70 | Afecciones saludables y otras afecciones no ADRS |
| Centrómero | CENP-B (centrómero) | SSc cutánea limitada, PBC |
| Fino moteado | SS-A/Ro, SS-B/La, Mi-2, TIF1γ, Ku | SjS, LES, SCLE, lupus eritematoso neonatal, bloqueo cardíaco congénito, DM, SSc, solapamiento SSc-AIM |
| Moteado grueso | Sm, RNP, U1RNP, ARN-polimerasa III | SLE, SSc, MCTD, solapamiento SSc-AIM, UCTD |
| Nucléolo | Th/To, PM/Scl, U3RNP, ARN-polimerasa I | SSc, superposición SSc-AIM, Raynaud, SjS, cáncer |
Abreviaturas: AIM, miositis autoinmune; DM: dermatomiositis; AIJ: artritis idiopática juvenil; MCTD: enfermedad mixta del tejido conectivo; CBP: cirrosis biliar primaria; ADRS: enfermedad reumática autoinmune sistémica; SCLE: lupus eritematoso cutáneo subagudo; LES: lupus eritematoso sistémico; SjS: síndrome de Sjogren; SSc: esclerodermia; UCTD: enfermedad indiferenciada del tejido conectivo.
Criterios de clasificación EULAR/ACR 2019
Antes de 2019, había dos criterios principales de clasificación para el LES: los criterios del Colegio Americano de Reumatología (ACR) de 1997 y los criterios de las Clínicas Colaboradoras Internacionales de Lupus Sistémico (SLICC) de 2012. Con el fin de mantener la especificidad de los criterios ACR de 1997 pero aumentar la sensibilidad de los criterios SLICC, se desarrollaron los criterios de clasificación de la Alianza Europea de Asociaciones de Reumatología (EULAR)/ACR de 2019 para el LES con fines de investigación (15). ANA ≥ 1:80 tuvo una tasa de sensibilidad del 98% para el diagnóstico de LES y se agregó como requisito de ingreso para los criterios. Se utilizó la ponderación diferencial de los criterios en un sistema de puntos, con 10 puntos que indican la clasificación del LES. Además, se incluyó la advertencia de que los criterios solo deben contarse para el LES si no existe otra explicación. Los criterios de 2019 han sido validados en poblaciones adultas y pediátricas con sensibilidades del 92% y 89%, respectivamente (16, 17).
Pruebas del complemento unido a células
El panel de ensayo multianalito recientemente desarrollado, denominado comercialmente prueba AVISE (Exogen Diagnostics), realiza una prueba de dos niveles que emplea productos de activación del complemento unidos a células (CB-CAP) como biomarcadores para el diagnóstico y la actividad de la enfermedad (18). La prueba mide los autoanticuerpos, la C4d unida a eritrocitos y la C4d unida a células B para ayudar a diagnosticar el LES (18). Los CB-CAP tienen una sensibilidad más alta que las mediciones estándar de complemento y anti-dsDNA solas para el LES en adultos y pediátricos (19, 20) y predecir la progresión del LES probable al LES clasificable según los criterios ACR (21). Además, las anomalías de los CB-CAP pueden predecir puntuaciones más altas del índice de gravedad del LES en pacientes con complemento normal (22). Un estudio reciente de 161 pacientes encontró que las pruebas de CB-CAP aumentaron la confianza del médico en el diagnóstico de LES y aumentaron la frecuencia del tratamiento temprano con hidroxicloroquina (HCQ) (18).
Pruebas de interferón
Los interferones tipo I y tipo II están regulados al alza antes de que se desarrolle el LES clasificable, aunque los datos para apoyar estos hallazgos están limitados por estudios pequeños (23, 24). Los ensayos funcionales para análisis de sangre aún no están disponibles comercialmente, pero pueden estar pronto. Las pruebas de interferón siguen siendo una herramienta de investigación valiosa, pero aún no han demostrado ser viables como biomarcadores en la práctica clínica.
TRATAMIENTOS ESTABLECIDOS
El tratamiento estándar de atención de todos los pacientes con LES utiliza terapia antipalúdica, generalmente HCQ, a menos que exista una contraindicación para este medicamento (25). Los antimaláricos trabajan para reducir la carga de antígenos en el lisosoma y también inhiben la activación del interferón por los ácidos nucleicos (revisado en 26). La HCQ generalmente es bien tolerada y se ha demostrado que reduce el riesgo de brotes de enfermedades (27), mejorar la esperanza de vida (28), disminuir el riesgo de trombosis (29), y tienen efectos positivos sobre la enfermedad de la piel (30) y manifestaciones musculoesqueléticas del LES. Es importante destacar que el uso temprano de HCQ puede ser beneficioso, ya que puede revertir los cambios inflamatorios de citoquinas e interferón en pacientes con LES incompleto (31, 32). El uso de HCQ durante el embarazo también reduce el riesgo de parto prematuro (33) y bloqueo cardíaco fetal en madres anti-Ro-positivas (34). Existen datos que apoyan el uso de otros medicamentos antipalúdicos como la cloroquina y la quinacrina en el LES, pero una mayor tasa de toxicidad retiniana (para la cloroquina) y la dificultad de acceso (para la quinacrina) limitan su uso generalizado (25). Los efectos secundarios del uso de HCQ pueden incluir malestar gastrointestinal y, más raramente, toxicidad retiniana y miocardiopatía. La toxicidad retiniana puede limitarse mediante una dosificación adecuada (objetivo de 5 mg/kg/día) y mediante el cribado anual después de los primeros 5 años de tratamiento con HCQ utilizando técnicas avanzadas como la tomografía de coherencia óptica (35). La monitorización de los niveles sanguíneos de HCQ también puede tener utilidad para identificar a los pacientes con mayor riesgo de toxicidad retiniana (36).
Los glucocorticoides se utilizan tradicionalmente como una forma de acción rápida para obtener control sobre la actividad de la enfermedad. La dosis depende de la gravedad de la enfermedad, con 5-10 mg de prednisona equivalente generalmente suficiente para manifestaciones leves. La enfermedad más grave puede requerir una dosis más alta: hasta 0,5-1 mg/kg de prednisona equivalente con o sin pulso inicial intravenoso (i.v.) metilprednisolona (37) para nefritis lúpica, afectación hematológica grave o enfermedad del sistema nervioso central. Limitar la dosificación de esteroides a solo lo que es esencial y disminuir la disminución siempre que sea posible es deseable, ya que el uso de esteroides se correlaciona fuertemente con la acumulación de daño a lo largo del tiempo en los pacientes (38, 39).
Más allá de los antipalúdicos, la elección de tratamientos adicionales para los pacientes con LES depende de las manifestaciones de la enfermedad del paciente. Cuadro 2 resume las recomendaciones EULAR de 2019 para la gestión del LES (25). La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) no aprueba ninguna terapia específicamente para las indicaciones cutáneas de LES, por lo que el manejo de la enfermedad de la piel se basa en la opinión de expertos. Se pueden utilizar terapias como esteroides tópicos e inhibidores tópicos de la calcineurina, dapsona, metotrexato, lenalidomida o micofenolato mofetilo (MMF) (40). Para la artritis, el metotrexato (41), leflunomida (42), y MMF (43) pueden ofrecer beneficios y permitir la reducción de la dosis de esteroides. También se ha demostrado que el metotrexato mejora en general la actividad global de la enfermedad por LES (41). La azatioprina también se usa a menudo para reducir la actividad global de la enfermedad del LES (25). La terapia con ciclofosfamida (CYC) generalmente se reserva para manifestaciones que amenazan los órganos, como la afectación del sistema nervioso central o la nefritis lúpica.
| Leve | Moderado | Muy fuerte | Nefritis lúpica | |
|---|---|---|---|---|
| Definición | Síntomas constitucionales Artritis leve Erupción ≤9% BSA Plaquetas 50-100 × 103 milímetro3 SLEDAI ≤ 6 BILAG C o ≤1 BILAG B manifestación | Artritis similar a la AR Erupción 9-18% BSA Vasculitis cutánea ≤18% BSA Plaquetas 20-50 × 103 milímetro3 Serositis SLEDAI 7–12 ≥2 Manifestaciones BILAG B | Enfermedad que amenaza los principales órganos (cerebritis, mielitis, neumonitis, vasculitis mesentérica) Plaquetas <20 × 103 milímetro3 Enfermedad similar a TTP o síndrome hemofagocítico agudo SLEDAI > 12 ≥1 BILAG Manifestación A | Clase III, IV, V |
| Tratamiento de primera línea | HCQ GC Piel: GC tópica, CNI | HCQ GC MTX AZA MMF CNI | HCQ GC MMF CYC | HCQ GC MMF CYC |
| Tratamiento de enfermedades refractarias | MTX AZA | BEL Anifrolumab | Anifrolumab RTX | BEL CNI/VSC |
Antes de los avances recientes (ver más abajo), la terapia de la nefritis lúpica se había mantenido sin cambios durante una década. El pilar fue CYC, utilizado por vía oral en la década de 1970 y luego principalmente a través de la terapia de pulso intravenoso (0.5-1.0 g / m2) en la década de 1980 (44). Un segundo protocolo para la dosificación de CYC, denominado Euro-lupus, en el que el paciente recibe seis dosis de 500 mg i.v. CYC con 2 semanas de diferencia, demostró ser igualmente eficaz para lograr la remisión renal en comparación con CYC de pulso de dosis más altas (45) y ahora es la opción inicial preferida para el uso de CYC en la mayoría de los pacientes. Después de que los ensayos fueron criticados por proporcionar datos solo sobre pacientes europeos (predominantemente caucásicos), los ensayos posteriores que utilizaron la dosis de Euro-lupus también mostraron tasas de respuesta iguales en pacientes de color (46). Un estudio completado en 2009 demostró que una dosis objetivo de 3 g/día MMF y CYC de pulso intravenoso logró la misma eficacia en términos de tasa de respuesta renal, sin diferencias en los eventos adversos (47). Por lo tanto, MMF también se ha convertido en una opción estándar para el tratamiento de la nefritis lúpica.
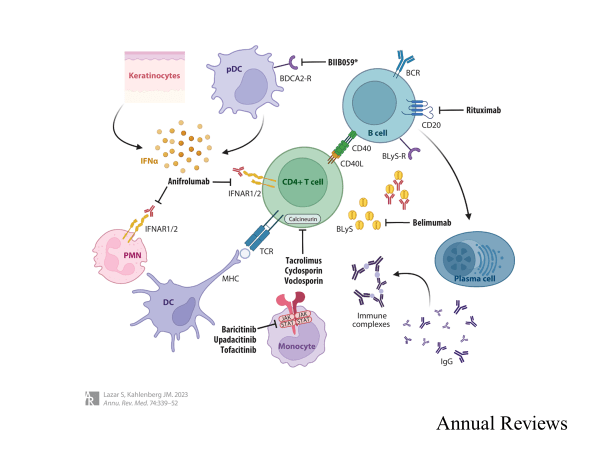
Si bien la monoterapia con MMF o CYC todavía se considera estándar de atención, las opciones para la terapia dual y las terapias dirigidas han sido aprobadas recientemente por la FDA (Figura 1). Belimumab (BEL) (ver más abajo para más detalles) en combinación con MMF o CYC puede aumentar la probabilidad de una respuesta renal parcial o completa sobre MMF o CYC solo (48) y ahora está aprobado por la FDA para esta indicación. Además, el uso de un inhibidor de la calcineurina en combinación con MMF puede proporcionar mejores tasas de respuesta renal. Esto se ha demostrado para tacrolimus (49) y también voclosporina (VSC), que recibió el etiquetado de la FDA para la nefritis lúpica en 2021 (50) (véase infra). El tacrolimus también puede tener efectos beneficiosos en la nefritis lúpica como monoterapia, pero es necesario completar estudios adicionales antes de implementarlo como práctica estándar (51).
Avances terapéuticos recientes
Belimumab.
BEL es un anticuerpo monoclonal (mAb) recombinante y completamente humano que bloquea la unión del estimulador de linfocitos B soluble a su receptor en las células B, disminuyendo así la supervivencia, diferenciación y activación de las células B. Fue el primer producto biológico aprobado por la FDA para el LES y está disponible como infusión intravenosa o inyección subcutánea.
Cuatro grandes ensayos controlados aleatorios (ECA) de fase III doble ciego demostraron la eficacia de BEL (52–55) en pacientes con enfermedad activa en tratamiento de base estándar. Las mejoras incluyeron la respuesta a los índices compuestos, la reducción de los brotes y la reducción de la exposición a los esteroides (52–54). Una revisión reciente también encontró eficacia de BEL y ninguna indicación de aumento del daño en los pacientes tratados (56), y un estudio de seguimiento de 6 años de belimumab en sujetos con lupus eritematoso sistémico (BLISS-76) pacientes encontraron mejoras significativas a largo plazo en la fatiga y los resultados de calidad de vida relacionados con la salud entre los pacientes tratados con BEL (57). Una advertencia es que los pacientes con enfermedades que amenazan los órganos fueron excluidos de los ensayos.
Más recientemente, BEL se evaluó para el tratamiento de la nefritis lúpica en un ECA doble ciego de fase III, que mostró una mejor respuesta renal de eficacia primaria y una respuesta renal completa en la semana 104 en pacientes tratados con BEL en comparación con placebo y un menor riesgo de evento relacionado con el riñón o muerte en el grupo BEL (58).
Rituximab.
Rituximab (RTX) es un mAb quimérico que se dirige a CD20, una proteína transmembrana en todas las células B excepto las células pro-B y las células plasmáticas, lo que resulta en citotoxicidad y agotamiento de células B. Varias series de casos y estudios retrospectivos han mostrado mejoría en los parámetros del LES, incluida la nefritis lúpica, con el tratamiento con RTX (59, 60). La eficacia de la RTX se estudió en el LES no renal con actividad moderada a grave de la enfermedad en el tratamiento de base estándar, pero el estudio no cumplió con sus criterios de valoración primarios o secundarios (61). El análisis de subgrupos mostró tasas más altas de respuestas clínicas mayores y parciales entre los pacientes afroamericanos e hispanos que en el ensayo en general. Posteriormente, el ECA de fase III LUNAR se propuso estudiar la RTX en pacientes con LES con nefritis lúpica clase III o IV (62). Aunque el estudio no cumplió con los criterios de valoración primarios o secundarios, hubo más respondedores parciales en el grupo tratado con RTX que en el grupo placebo (31% versus 15%), y ningún paciente requirió terapia de rescate CYC en el grupo RTX (en comparación con 8 pacientes en el grupo placebo). A pesar del fracaso de la RTX para mostrar eficacia en los datos de ECA, los médicos todavía la utilizan, particularmente en pacientes refractarios o enfermedad hematológica asociada al LES, a menudo con excelentes resultados.
Anifrolumab.
Anifrolumab es un mAb humano dirigido a la subunidad 1 del receptor de interferón tipo I que inhibe la señalización de todos los interferones tipo I y se administra por infusión intravenosa (63). Recibió la aprobación de la FDA para el tratamiento del LES en 2021. Un ECA de fase II encontró que anifrolumab redujo la actividad de la enfermedad en pacientes con LES moderado a grave (64); sin embargo, el primer ECR de fase III, TULIP-1, no alcanzó el criterio de valoración primario del índice 4 de respondedor de LES (65). Varios criterios de valoración secundarios, incluida la Evaluación Compuesta del Lupus (BICLA) basada en el Grupo de Evaluación del Lupus de las Islas Británicas, mostraron una respuesta favorable. Posteriormente, se siguió una segunda fase III RCT, TULIP-2, con BICLA como criterio de valoración primario (66). Este estudio mostró una reducción significativa en la actividad de la enfermedad en pacientes con LES moderado a grave (66). Los datos agrupados de TULIP-1 y TULIP-2 mostraron una reducción de las erupciones, incluidas las derivadas de la disminución gradual de los esteroides (67). Anifrolumab probablemente será una herramienta útil en el arsenal de tratamiento del LES para pacientes con actividad de la enfermedad de moderada a grave, especialmente en la piel, que no pueden tolerar o no responden a las terapias convencionales; Sin embargo, los datos de eficacia en el mundo real están pendientes.
Voclosporina.
VSC es un inhibidor oral de la calcineurina en la misma clase de fármacos que el tacrolimus y la ciclosporina. VSC fue aprobado en enero de 2021 por la FDA para el tratamiento de la nefritis lúpica activa en combinación con agentes inmunosupresores de fondo (68). Dos ECA pivotales han mostrado una mejoría en la tasa de respuesta renal y una reducción de la proteinuria cuando la VSC se combinó con MMF y esteroides, en comparación con MMF y esteroides solos (50, 69). Los datos provisionales preliminares de un estudio de extensión de 2 años han mostrado reducciones sostenidas en la proteinuria y ningún cambio en la función renal después de hasta 30 meses de exposición a VSC (70); Se publicarán datos adicionales al final del estudio.
Terapias emergentes.
La investigación en curso está examinando nuevas intervenciones para beneficiar a los pacientes con LES. La inhibición de varias quinasas relacionadas con el sistema inmunitario, incluidas JAK1 y TYK2, ha demostrado ser prometedora, y se están realizando ECA más grandes (71). El bloqueo de tipos específicos de células, como las células dendríticas plasmocitoides, también ha mostrado una promesa temprana (72). Los estudios están investigando estrategias para aumentar las células T reguladoras mediante el uso de dosis bajas de IL-2 y moléculas similares a IL-2 (revisado en 73). Existe una gran esperanza de que los próximos 10-20 años de investigación sean transformadores para el manejo del LES a medida que se descubran nuevas vías patológicas y se desarrollen terapias.
NONPHARMACOLOGIC INTERVENTIONS
Suplementación con vitamina D
La deficiencia e insuficiencia de vitamina D son prevalentes entre los pacientes con LES y se asocian con la evitación del sol (74). La deficiencia de vitamina D se correlaciona con una mayor actividad de la enfermedad, niveles más altos de fatiga y un mayor riesgo de trombosis en pacientes con LES (74–80). En la nefritis lúpica, la administración de suplementos de vitamina D puede reducir la proteinuria y retrasar la progresión del daño renal (79). El nivel objetivo recomendado de 25(OH) vitamina D es de 40 ng/ml, ya que los niveles más altos no mostraron un beneficio terapéutico añadido (79). La suplementación con vitamina D es bien tolerada (76), y los niveles deben comprobarse rutinariamente para garantizar la absorción (81).
Modificaciones dietéticas
La disbiosis del microbioma intestinal en el LES probablemente tiene un papel en la generación y actividad de la enfermedad, pero necesita más investigación. Varios estudios que comparan diversas poblaciones humanas de LES con controles sanos han demostrado una disminución de la proporción de Firmicutes a Bacteroidetes (82, 83), y varios estudios con ratones propensos al lupus han demostrado que la disbiosis o el sesgo particular de los organismos comensales empeora las manifestaciones autoinmunes (84, 85). En un estudio, los cambios inducidos por antibióticos en la microbiota intestinal dieron lugar a una disminución de la autoinmunidad sistémica y una mejora de la patología renal en el modelo de lupus murino (86).
A pesar de esta evidencia de disbiosis en el LES, las interacciones de la dieta y el microbioma requieren más estudios para justificar las recomendaciones basadas en la evidencia sobre factores como los probióticos y la dieta para los pacientes con LES. Además, si bien no existe una «dieta para el lupus» acordada, varias modificaciones dietéticas pueden tener efectos beneficiosos. En un estudio transversal, una dieta mediterránea disminuyó la gravedad de la enfermedad y el riesgo cardiovascular en pacientes con LES (87). También se ha observado que una mayor ingesta dietética de ácidos grasos omega-3 y menores proporciones omega-6:omega-3 se asociaron favorablemente con los resultados informados por los pacientes en el LES y la calidad del sueño (88).
Evitar la luz ultravioleta
La exposición a la luz ultravioleta (UV) puede inducir brotes de LES sistémico y cutáneo (89, 90). Aunque los mecanismos exactos de la autoinmunidad inducida por UV siguen siendo poco conocidos, la evidencia sugiere que la generación de especies reactivas de oxígeno, el aumento del daño en el ADN, el aumento de la exposición al antígeno, la producción de mediadores inflamatorios, incluidos los interferones de tipo I, y el aumento del reclutamiento de células inflamatorias están involucrados (91). Se recomienda encarecidamente la protección contra la exposición a los rayos UV con protectores solares de amplio espectro (92); El factor de protección solar (SPF) 30 o superior mejora la protección. Otros métodos de fotoprotección incluyen la búsqueda de sombra, evitar el sol, sombreros, gafas de sol, mangas largas y pantalones largos (93). Se debe enfatizar la educación sobre la fotoprotección.
Limitar la exposición a glucocorticoides
Los glucocorticoides proporcionan una rápida supresión del sistema inmunitario en los brotes de LES, pero causan toxicidad (94). El objetivo del uso de glucocorticoides es reducir la dosis a ≤7,5 mg diarios lo más rápido posible y mantener la dosis más baja necesaria (25). Las complicaciones glucocorticoides a corto plazo incluyen obesidad, hipertensión, diabetes tipo 2, susceptibilidad a la infección y daño irreversible que incluye necrosis avascular y accidente cerebrovascular (94). Las consecuencias a largo plazo incluyen cataratas, fracturas osteoporóticas y enfermedades cardiovasculares (94). La acumulación de daños depende del tiempo y la dosis (95, 96). Un estudio de cohorte de LES encontró que el 80% del daño orgánico estaba posible o definitivamente relacionado con la exposición a glucocorticoides durante el período de estudio de 15 años (96).
Ensayos recientes han sugerido que limitar la exposición acumulativa a glucocorticoides puede no afectar negativamente los resultados. En un estudio piloto, 50 pacientes con nefritis lúpica activa recibieron RTX y MMF, dos dosis de metilprednisolona intravenosa 500 mg y sin esteroides orales (RITUXILUP). Después de 12 meses, el 53% logró la remisión completa, que es comparable a los resultados de estudios previos con el uso de esteroides orales convencionales (97). El reciente ECA de fase III de VSC utilizó dosis iniciales de prednisona 25 mg/día, lo que sugiere que la eficacia no se ve perjudicada por los regímenes de esteroides de dosis más bajas (50). Se necesitan ensayos aleatorios adicionales para determinar si los regímenes de esteroides en dosis bajas son tan efectivos como el tratamiento convencional.
Gestión de la comorbilidad
Las enfermedades cardiovasculares y las infecciones representan la mayor parte de la mortalidad asociada al LES (98). Los factores de riesgo cardiovascular, incluida la hipertensión y la diabetes tipo 2, son más comunes entre los pacientes con LES, y la hipertensión resistente es casi el doble de probable en pacientes con LES en comparación con los controles (99). El examen de mantenimiento de la salud y la prevención de complicaciones relacionadas con la enfermedad de LES y el tratamiento son esenciales para proporcionar una atención de calidad. El manejo incluye mantener actualizado el estado de vacunación; exámenes de detección de neoplasias malignas de rutina apropiados para la edad; detección y manejo de hipertensión, diabetes e hiperlipidemia; y educación sobre estrategias de autogestión y estilo de vida saludable.
CONCLUSIÓN
El LES es una enfermedad autoinmune multifactorial que puede afectar a casi todos los órganos del cuerpo. En los últimos 50 años, hemos pasado de los esteroides crónicos y los regímenes quimioterapéuticos de dosis altas a la terapia biológica dirigida. El control de la enfermedad y la mortalidad por LES han mejorado a lo largo de los años (100), pero aún queda trabajo por hacer. Disparidades en la asistencia sanitaria, racismo sistémico (101), y la falta de acceso eficiente y asequible a medicamentos más nuevos (102) contribuyen a resultados subóptimos en pacientes con LES. Las estrategias de gestión eficaces deberán sinergizar las terapias de precisión y los determinantes sociales de la salud para tener el mayor impacto en la vida de los pacientes.