- Prof. Gill Livingston, MD Dr. Jonathan Huntle Kathy Y Liu, MRCPsych Prof. Sergi G Costafreda, PhD Prof. Geir Selbæk, MDProf. Suvarna Alladi, PhD y cols.
Acciones específicas para reducir el riesgo de demencia a lo largo de la vida
Recomendamos varias acciones específicas en los 14 factores de riesgo:
- •Garantizar que la educación de buena calidad esté disponible para todos y fomentar actividades cognitivamente estimulantes en la mediana edad para proteger la cognición.
- •Haga que los audífonos sean accesibles para las personas con pérdida auditiva y disminuya la exposición al ruido dañino para reducir la pérdida auditiva
- •Tratar la depresión de manera efectiva
- •Fomentar el uso de cascos y protección para la cabeza en los deportes de contacto y en las bicicletas.
- •Fomente el ejercicio porque las personas que participan en deportes y ejercicio tienen menos probabilidades de desarrollar demencia
- •Reducir el consumo de cigarrillos a través de la educación, el control de precios y la prevención de fumar en lugares públicos y hacer que los consejos para dejar de fumar sean accesibles.
- •Prevenir o reducir la hipertensión y mantener la presión arterial sistólica de 130 mm Hg o menos a partir de los 40 años
- •Detectar y tratar el colesterol LDL alto desde la mediana edad
- •Mantenga un peso saludable y trate la obesidad lo antes posible, lo que también ayuda a prevenir la diabetes
- •Reducir el alto consumo de alcohol a través del control de precios y una mayor conciencia de los niveles y riesgos de consumo excesivo
- •Dar prioridad a los entornos comunitarios y a la vivienda favorables a las personas mayores, y reducir el aislamiento social facilitando la participación en actividades y la convivencia con otras personas.
- •Hacer que las pruebas de detección y el tratamiento de la pérdida de visión sean accesibles para todos
- •Reducir la exposición a la contaminación del aire
Consideraciones para las personas con demencia
Las intervenciones después del diagnóstico ayudan a las personas a vivir bien con demencia, incluida la planificación para el futuro. Las intervenciones de afrontamiento multicomponente para los cuidadores familiares y el manejo de los síntomas neuropsiquiátricos son importantes y deben centrarse en la persona.
Los síntomas neuropsiquiátricos deben tratarse, y existe evidencia clara de que las intervenciones multicomponentes coordinadas por la atención son útiles. Las intervenciones de actividad también reducen los síntomas neuropsiquiátricos y son importantes para mantener el disfrute y el propósito de las personas con demencia. No hay evidencia de que el ejercicio sea una intervención para los síntomas neuropsiquiátricos.
Las personas con enfermedad de Alzheimer y demencia con cuerpos de Lewy deben recibir inhibidores de la colinesterasa y memantina. Estos medicamentos son baratos, con relativamente pocos efectos secundarios; atenuar el deterioro cognitivo en un grado modesto, con buena evidencia de un efecto a largo plazo; y están disponibles en la mayoría de los países de ingresos altos, aunque menos en los países de ingresos bajos y medianos.
Hay progreso y esperanza en los tratamientos modificadores de la enfermedad de Alzheimer, con algunos ensayos de anticuerpos dirigidos al β amiloide que muestran una eficacia modesta para reducir el deterioro después de 18 meses de tratamiento. Sin embargo, los efectos son pequeños y los fármacos se han probado en personas con enfermedad leve y en personas con pocas otras enfermedades. Estos tratamientos han sido autorizados en algunos países, pero tienen efectos secundarios notables, con pocos datos sobre los efectos a largo plazo. El costo de estos tratamientos y las precauciones que se deben tomar, que tienen implicaciones en los recursos para el personal, las exploraciones y los análisis de sangre especializados, podrían limitar su uso y ser un desafío para los sistemas de salud. Se recomienda que se comparta ampliamente la información completa sobre los efectos desconocidos a largo plazo, la ausencia de datos sobre los efectos en las personas con multimorbilidad y la escala de eficacia y efectos secundarios, en particular para los portadores del genotipo APOE ε4. Recomendamos que las personas que reciben anticuerpos dirigidos al amiloide β sean monitoreadas cuidadosamente.
El líquido cefalorraquídeo o los biomarcadores sanguíneos deben usarse clínicamente solo en personas con demencia o deterioro cognitivo para ayudar a confirmar o excluir un diagnóstico de enfermedad de Alzheimer. Los biomarcadores solo se validan en poblaciones mayoritariamente blancas, lo que limita la generalización y plantea preocupaciones sobre la equidad en salud.
Las personas con demencia que se enferman físicamente de forma aguda y necesitan ser ingresadas en el hospital se deterioran cognitivamente más rápido que otras personas con demencia. Es importante proteger la salud física y garantizar que las personas tengan ayuda si la necesitan para garantizar que coman y beban lo suficiente y puedan tomar medicamentos.
La COVID-19 expuso la vulnerabilidad de las personas con demencia. Tenemos que aprender de esta pandemia y también proteger a las personas con demencia, ya que su vida y su bienestar, y el de sus familias, se han valorado menos que el de las personas sin demencia.
El campo de los biomarcadores ha avanzado desde el informe de 2020, y los biomarcadores de líquidos están más ampliamente validados, aunque gran parte del trabajo se ha realizado en personas atendidas en centros terciarios, que a menudo difieren de la mayoría de las personas con demencia porque tienden a ser más jóvenes o tienen demencias más raras. Además, ahora hay más claridad sobre el significado de los cambios en los biomarcadores. Los biomarcadores de β y tau amiloide en personas con deterioro cognitivo ayudan a confirmar la presencia de la patología de la enfermedad de Alzheimer, pero no confirman que esta patología sea la causa de los síntomas. Las placas amiloides ocurren muchos años antes de la presentación clínica de la demencia. Los biomarcadores de β amiloide son comunes en individuos mayores (es decir, 10% de positividad a los 70 años y 33% de positividad a los 85 años en una muestra de EE. UU.) que no tienen deterioro cognitivo, la mayoría de los cuales no desarrollarán demencia. La presencia de biomarcadores de β amiloide y tau aumenta la probabilidad de demencia, y la evidencia de neurodegeneración en neuroimagen aumenta aún más este riesgo. La visión de los biomarcadores sanguíneos, como la tau fosforilada, como una prueba escalable para predecir quién desarrollará demencia está progresando, pero aún no se ha realizado.
Para las personas que viven con demencia, las intervenciones posteriores al diagnóstico pueden ayudar a maximizar la salud física, mejorar la calidad de vida, reducir las hospitalizaciones y planificar el futuro. Las intervenciones deben ser individualizadas, tener en cuenta las circunstancias vitales de la persona e incluir a la familia y a otros cuidadores. Existe mucha más evidencia sobre las intervenciones psicosociales multicomponentes para los cuidadores familiares y el manejo de los síntomas neuropsiquiátricos que la disponible en el momento de nuestro último informe. Estas intervenciones son importantes y deben estar centradas en la persona.
Existe nueva evidencia de los efectos beneficiosos de los inhibidores de la colinesterasa para las personas con enfermedad de Alzheimer y demencia con cuerpos de Lewy, tanto a largo como a corto plazo. Aunque los inhibidores de la colinesterasa deberían estar disponibles para el tratamiento de estas demencias sobre la base de la evidencia de su efectividad, este tratamiento aún no está disponible en muchos países. Se sabe menos sobre los tratamientos con anticuerpos β antiamiloide. De manera alentadora, por primera vez, algunos ensayos han informado una pequeña disminución en el deterioro cognitivo en personas que reciben tratamientos con anticuerpos anti-amiloide, con una reducción sustancial de la β de amiloide en el cerebro. Estos tratamientos redujeron el deterioro después de 18 meses de tratamiento en un 27-35%, pero son caros, engorrosos de usar, requieren una monitorización y un seguimiento intensivos y pueden tener efectos secundarios clínicamente significativos y, a veces, graves. No existen pruebas sobre sus efectos a largo plazo y su seguridad.
La COVID-19 expuso la vulnerabilidad de las personas con demencia. Tenemos que aprender de estas nuevas observaciones para garantizar que las personas vulnerables estén protegidas y que se valoren la vida y el bienestar de las personas con demencia y sus familias.
Los avances sustanciales en la comprensión de la protección y el riesgo y en las intervenciones farmacológicas y no farmacológicas para las personas con demencia significan que, ahora más que nunca, podemos prevenir, diagnosticar y tratar la demencia, mejorando la vida de las personas, las familias y la sociedad.
Introducción
Volvimos a convocar a la Comisión Lancet sobre la prevención, intervención y atención de la demencia1 2 con el objetivo de incidir en la política, el conocimiento, la práctica clínica y la agenda de investigación. Se han logrado avances emocionantes en la prevención, el diagnóstico y los medicamentos y tratamientos no farmacológicos de la demencia. Se puede y se debe hacer más para prevenir la demencia y ayudar a las personas que viven con demencia y a sus familias.3 Nuestro grupo interdisciplinario, internacional y multicultural de expertos adoptó un marco de triangulación, priorizando las revisiones sistemáticas y los metaanálisis y realizando nuevos metaanálisis cuando fue necesario. Cada comisionado, elegido de una amplia gama geográfica y cultural para incorporar diversos puntos de vista, escribió al menos una sección y cada sección fue presentada y debatida cara a cara y en múltiples versiones escritas. Acordamos unánimemente la mejor evidencia disponible y su consistencia. Identificamos los avances que probablemente tengan los mayores efectos y realizamos nuevos trabajos que nos permiten calcular los efectos de los factores de riesgo potencialmente modificables para la demencia. Aquí, presentamos nuestros nuevos análisis y consolidamos el conocimiento actual, resumiendo el balance de la evidencia sobre la prevención, la intervención y la atención. El número de personas que viven con demencia en todo el mundo en 2019 se estimó en 57 millones y se prevé que aumente a 153 millones para 2050.4 La proporción de personas con demencia ha aumentado con el tiempo en los países de ingresos más bajos debido a un mayor aumento porcentual de la longevidad que en los países de ingresos altos.5, 6En este tercer informe de la Comisión Lancet sobre la demencia, resumimos lo que ya se sabía afirmando lo que informamos en comisiones anteriores. Esta información proviene de investigaciones realizadas durante muchas décadas por personas de todo el mundo. A continuación, nos basamos en esta investigación, explicamos nuevas pruebas, las referenciamos y producimos nuevas pruebas, integrando la información para hacer recomendaciones actualizadas. Consideramos específicamente las poblaciones de los países de ingresos altos (HIC) y los países de ingresos bajos y medianos (PIMB) y las comunidades subrepresentadas, desatendidas y minoritarias en todos los países donde se dispone de evidencia. La evidencia todavía proviene desproporcionadamente de los países de ingresos altos. El uso y la investigación de las intervenciones también podrían ser más probables en los países de ingresos altos porque dependen de la disponibilidad de recursos, a pesar de que pueden ahorrar costos.7, 8, 9 Los planes nacionales de demencia en 31 de los 46 países no hacen recomendaciones específicas para la consideración de la diversidad, la equidad o la inclusión de las personas de culturas y etnias subrepresentadas.
10 Y los planes que sí tienen en cuenta estos factores suelen limitar sus recomendaciones a la interpretación de las pruebas cognitivas.
11 Como establecemos en este informe, garantizar la consideración de todas las culturas y etnias para todos los tipos de demencia es esencial para dirigir la ayuda a las personas que más la necesitan.
Prevención
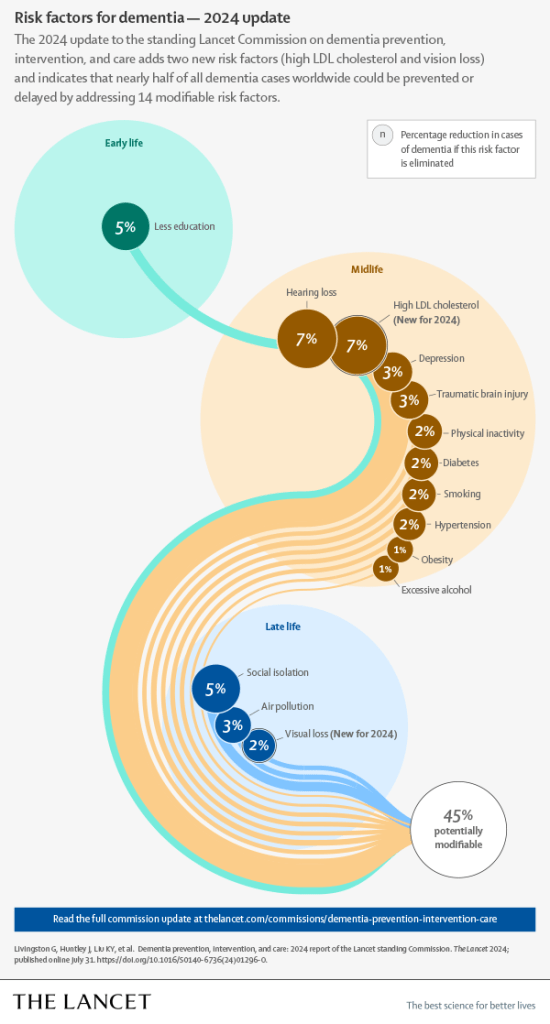
Ha habido una rápida expansión en el volumen de trabajo sobre la prevención de la demencia y la reducción del riesgo relacionado con los 12 factores de riesgo que se identificaron a partir de la literatura de investigación existente y se discutieron en nuestros informes anteriores de la Comisión Lancet en 2017 y 2020.2 Los factores de riesgo identificados en nuestros informes anteriores fueron menor educación, pérdida de audición, hipertensión, inactividad física, diabetes, aislamiento social, consumo excesivo de alcohol, contaminación del aire, tabaquismo, obesidad, lesión cerebral traumática y depresión, para los cuales informamos que las reducciones tienen el potencial de prevenir el 40% de los casos de demencia.2 Discutimos los mecanismos de estos 12 factores de riesgo, que indicaron que el riesgo se puede reducir a cualquier edad. Aquí, actualizamos la evidencia y consideramos otros posibles factores de riesgo. Utilizamos un enfoque de curso de vida para comprender cómo reducir el riesgo o prevenir la demencia porque muchos riesgos operan en diferentes momentos de la vida. Por ejemplo, la obesidad y la hipertensión arterial son factores de riesgo en la mediana edad, a menudo con orígenes más tempranos, pero en la vejez, la asociación con el deterioro cognitivo leve (DCL) y la demencia se reduce.12 13,- 14 Al igual que en nuestros informes anteriores, buscamos factores de riesgo con evidencia de alta calidad, consistente, dosis-respondiente y válidamente medida; que preceden a la demencia; y que todavía están presentes cuando se miden una década o más antes de su aparición. Incluimos solo los factores de riesgo con evidencia convincente, pero reconocemos que es probable que haya otros factores de riesgo y de protección. Los comisionados se reunieron y discutieron la evidencia, decidieron qué incluir y expusieron nuestras discusiones y la evidencia en el documento. Aquí, discutimos nueva evidencia biológicamente plausible sobre los mecanismos que vinculan un factor de riesgo con la demencia y, cuando hay nueva evidencia, la presentamos y resumimos la evidencia previa sobre los mecanismos para dar una visión equilibrada. Sin embargo, no pretendemos hacer un examen completo y detallado de todos los mecanismos. También discutimos si la evidencia proviene de poblaciones diversas y, por lo tanto, es generalizable, y si hay evidencia de que la intervención para reducir el factor de riesgo marca una diferencia en el riesgo de demencia.
Compresión de la morbilidad
Los datos de algunos países de ingresos altos sugieren que las tasas de incidencia de demencia específicas por edad han disminuido en las últimas dos décadas.15 haciendo hincapié en que la prevención es posible. Hay menos datos de los países de ingresos bajos y medianos. Los estudios que han examinado la asociación de la demencia con la privación socioeconómica sugieren que la disminución de la incidencia de demencia ocurre principalmente en personas que viven en áreas socioeconómicamente favorecidas.15 Estos hallazgos sugieren que muchas demencias son potencialmente prevenibles (y diferibles), pero las tasas específicas por edad podrían aumentar si la prevalencia del riesgo (p. ej., prevalencia de diabetes u obesidad) aumenta, y este aumento en las tasas específicas por edad podría tener un impacto particular en personas con menos educación. Un estudio de Inglaterra16 sugiere que ya podría estar ocurriendo un aumento en las tasas de demencia específicas por edad, aunque existe incertidumbre y se necesitan pruebas adicionales.16 17 18Se demostró que las personas con estilos de vida saludables, que incluían ejercicio regular, no fumar, evitar el exceso de alcohol e incluir actividad cognitiva en la vejez, no solo tenían un menor riesgo de demencia que aquellos con estilos de vida menos saludables, sino que también retrasaban el inicio de la demencia durante más tiempo que su mayor esperanza de vida, lo que resultaba en más años saludables y menos años de enfermedad.19 En general, las personas que llevan una vida más saludable pueden esperar vivir más tiempo que las personas con estilos de vida poco saludables y, si desarrollan demencia, viven menos años con la enfermedad, con notables implicaciones en la calidad de vida de las personas y en el ahorro de costos para los servicios.
Vulnerabilidad cognitiva, mantenimiento cerebral y reserva cognitiva
Como se discutió en la Comisión Lancet de 2020, los cambios neuropatológicos no conducen inevitablemente a la demencia. La mayoría de las personas mayores con demencia tienen varios tipos de neuropatología. Un estudio de seis cohortes comunitarias, que comprendió a 4354 personas mayores de 80 años que habían fallecido en los EE. UU. o el Reino Unido, identificó que 2443 (91%) de las 2695 personas analizadas para seis tipos de neuropatología murieron con dos o más tipos de neuropatología.20 Cuantos más tipos de neuropatología tenían las personas, más probabilidades tenían de tener demencia (figura 1), pero algunas personas con muchas neuropatologías no habían desarrollado demencia.

La capacidad de resistir la neuropatología antes de mostrar los síntomas de la demencia se describe como reserva cognitiva. A veces, los términos resiliencia o reserva cerebral también se utilizan para describir el afrontamiento de la patología y la resistencia a la neuropatología. Las personas que están físicamente más sanas son más capaces de resistir los efectos de la neuropatología que las personas que no están físicamente sanas.21 Por ejemplo, aunque la incidencia de demencia relacionada con la edad ha disminuido en algunos países en los últimos 25 años, un estudio post-mortem no mostró diferencias en la neurodegeneración durante ese tiempo, pero sí una reducción en la patología vascular.22 Una revisión sistemática informó que las actividades físicas, cognitivas y sociales aumentan la reserva cognitiva y atenúan el efecto de la neuropatología.23 En general, en las últimas dos décadas, una combinación de mayor reserva cognitiva y física desarrollado a lo largo del curso de la vida, preservando la salud cognitiva a pesar de la neuropatología, y es probable que un menor daño vascular haya contribuido a la disminución observada de la incidencia de demencia relacionada con la edad.24 No obstante, el número de personas con demencia sigue aumentando debido al envejecimiento de la población.
Los desafíos de la investigación sobre la prevención de la demencia y la reducción del riesgo
Naturaleza a lo largo de la vida de las exposiciones a la protección y al riesgo
Muchos factores operan a lo largo del curso de la vida, desde la gestación hasta la vejez. Estos factores son difíciles de rastrear, y nuestra base de evidencia se limita a lo que se estudia en edades particulares. Aquí, analizamos la evidencia directamente relacionada con la demencia; Sin embargo, existe evidencia más amplia que no capturamos sobre el crecimiento óptimo del cerebro en los primeros años de vida (es decir, en el útero y la infancia) y la exposición a la adversidad y sus efectos en la cognición, la salud vascular y las actividades físicas y cognitivas. La exposición educativa tiene fuertes efectos protectores. En esta Comisión, utilizamos el lenguaje del riesgo y luego discutimos la protección, que puede mitigar tanto los riesgos como las enfermedades derivadas de los riesgos. La duración, la consistencia y el momento de la exposición al posible riesgo podrían ser importantes, con un estudio que informó, por ejemplo, que la diabetes en la mediana edad es un factor de riesgo para la demencia, pero podría no ser un riesgo en aquellos cuyo inicio de la diabetes es en la vejez.25 No está claro si esta diferencia en el riesgo se debe a una menor duración de la exposición en las personas que desarrollan diabetes en la edad avanzada que en las que desarrollan diabetes en la mediana edad, si la gravedad de la diabetes tiene un efecto sobre el riesgo o si hay un período crítico de exposición. Es posible que, si las personas que desarrollan diabetes en la vejez viven lo suficiente, también podrían tener un mayor riesgo de demencia. Otros factores de riesgo, como el tabaquismo, que la evidencia sugiere que es un factor de riesgo en la mediana edad, claramente también confieren riesgo en la vejez.
Efectos del pródromo largo antes de la identificación e intervención de la demencia
La larga fase preclínica de algunas demencias, a lo largo de más de una década, se caracteriza por cambios neuropatológicos progresivos, como la acumulación de β de amiloide o tau antes de la demencia de Alzheimer. Los cambios neuropatológicos inicialmente tienen pocos efectos cognitivos, pero estos efectos pueden aumentar a lo largo de muchos años.26 Los cambios en el comportamiento y la salud pueden ocurrir mucho antes de la aparición de la demencia, por lo que los riesgos potenciales identificados en los pocos años anteriores a la aparición de la demencia podrían ser un verdadero efecto causal o una causalidad inversa, o el vínculo podría ser bidireccional. Esta bidireccionalidad podría ser cierta incluso cuando los estudios informan sobre el tiempo medio de seguimiento de la cohorte, que podría variar entre las personas que desarrollan demencia (debido a la censura al inicio de la demencia) y las que no. Los estudios futuros deben informar el seguimiento medio de las personas que desarrollan y no desarrollan demencia por separado o evaluar el efecto de excluir los casos incidentes que se desarrollan dentro de los 5 a 10 años posteriores al seguimiento. Existen muchas dificultades metodológicas en el diseño y la realización de ensayos de intervención para la prevención de la demencia, incluida la garantía de una duración suficiente del seguimiento; el reclutamiento de participantes de grupos de alto riesgo o que a menudo están excluidos, como las personas de grupos étnicos minoritarios (que varían según el país); y la adherencia a la intervención y la realización de cambios asociados en el estilo de vida o en el comportamiento que se asocian con mejores trayectorias de funcionamiento cognitivo, 27 La adherencia al estudio disminuye con el aumento de la complejidad e intensidad de la intervención.28 Puede ser más difícil demostrar el beneficio de una intervención en un ensayo controlado aleatorizado (ECA) si el grupo de control está muy motivado para aceptar también la intervención. El beneficio puede detenerse o disminuir si la intervención no continúa después del final del ensayo.
Diversidad, equidad e inclusión
Anteriormente, consideramos la prevención y la reducción de riesgos a nivel mundial, utilizando datos internacionales para la prevalencia de factores de riesgo y riesgos relativos (RR) de metanálisis cuando fue posible.12 La consideración de la equidad es importante, no solo desde el punto de vista ético, sino también para informar sobre la orientación de la intervención y la accesibilidad para maximizar los efectos preventivos.29 Muchas fuentes de big data comprenden datos de voluntarios, que por su naturaleza excluyen a las personas que están en mayor riesgo.30 Además, algunos de los grandes estudios de cohortes, como el Biobanco del Reino Unido, también reclutan voluntarios más jóvenes (es decir, de <50 años), y aunque su inclusión es útil para excluir la causalidad inversa, la mayoría de las personas no han alcanzado la edad en la que la demencia es común y, por lo tanto, los hallazgos podrían no ser generalizables a poblaciones mayores. Los estudios de cohortes de los factores de riesgo de demencia y, por lo tanto, los metanálisis, provienen en su mayoría de los países de ingresos altos, y estos estudios tienden a reclutar a personas de origen europeo con un alto nivel de educación y un alto nivel socioeconómico, que suelen pertenecer a grupos de mayor edad (es decir, >65 años), con pocas personas incluidas de grupos étnicos minoritarios.
31 Estas limitaciones también se aplican a los ensayos clínicos y, para ambos tipos de estudio, pueden estar relacionadas con criterios de exclusión que especifican otras enfermedades médicas y psiquiátricas notables; falta de un compañero de estudio que acompañe al participante a las visitas del ensayo y lo apoye, como un cuidador familiar; incapacidad para manejar la carga de la participación en la investigación; y la falta de fluidez en el idioma local.32 33La prevalencia de los factores de riesgo varía de un país a otro34 y dentro de los países.
35 Un metaanálisis de 31 estudios de 15 países de América Latina mostró que el doble de personas sin ningún tipo de educación en comparación con aquellas con 1 año o más de educación tenían demencia (21,4% frente a 9,9%) y reportó una prevalencia ligeramente mayor en entornos rurales que urbanos y en mujeres que en hombres.
29 Los factores de riesgo se agrupan dentro de las comunidades y los individuos. Las personas de grupos étnicos desatendidos, como los maoríes en Nueva Zelanda, los australianos de las Primeras Naciones, las personas negras en los EE. UU. y el Reino Unido, y las personas hispanas en los EE. UU., tienen una mayor prevalencia de factores de riesgo potencialmente modificables que la población mayoritaria del país.43 Además, la literatura, y por lo tanto nuestras Comisiones, han asumido que el efecto de tener cada factor de riesgo es el mismo para todos. Por el contrario, la investigación sobre enfermedades cardiovasculares ha identificado, por ejemplo, que el efecto de la presión arterial alta sobre el riesgo de accidente cerebrovascular es mayor en las personas del sur de Asia en el Reino Unido que en la población británica blanca y los efectos de los factores de riesgo para la demencia también pueden variar entre grupos étnicos.44 45Importantes factores de desventaja social, como menos educación, más aislamiento social y bajo nivel socioeconómico, tienden a agruparse con factores de salud que predicen el deterioro cognitivo y la demencia.
46 Por lo tanto, las personas a menudo tienen varios factores de riesgo, que pueden actuar juntos, lo que significa que es importante considerar la comunalidad. Hemos optado por considerar los riesgos individualmente y corregirlos en función de la comunidad, en lugar de considerar varios perfiles de riesgo.El efecto del nivel socioeconómico sobre la prevalencia de algunos factores de riesgo puede variar de un país a otro. La prevalencia de hipertensión, diabetes, obesidad, inactividad física, tabaquismo, consumo excesivo de alcohol, menor educación, traumatismo craneoencefálico (TCE) y exposición a la contaminación atmosférica es mayor en personas de grupos socioeconómicos bajos y con bajos ingresos en países de ingresos altos.
,
,
49 En los países de bajos ingresos, las prevalencias más bajas de obesidad o diabetes en personas con menos riqueza o educación son inconsistentes.
,
51 Además, el aislamiento social es menos común en algunos países de ingresos bajos que en los países de ingresos altos.
32El sexo biológico, es decir, las diferencias físicas entre las personas debido a sus cromosomas sexuales y órganos reproductivos, generalmente se nota al nacer y a las personas se les asigna un sexo. El género vivido es cómo una persona se identifica en el espectro de género. El sexo y el género se reconocen cada vez más como conceptos separables en algunas sociedades. El sexo biológico, la exposición hormonal y los roles sociales son potencialmente importantes para influir en el riesgo de demencia y su expresión en la vejez. Los hallazgos sobre el efecto del sexo biológico en el riesgo de demencia son inconsistentes.
52 Las mujeres tienen tasas de incidencia de demencia ajustadas por edad más altas que los hombres en algunos países, pero no en todos.53 Un metaanálisis con casi un millón de personas de 205 estudios en 37 países identificó que el aumento de la incidencia y prevalencia de la demencia en las mujeres en comparación con los hombres se explicaba por las diferencias en la esperanza de vida y la educación.53 Un análisis de participantes individuales reportó resultados muy variados en cada país.54 En 21 cohortes con un total de 29 850 participantes en África, Asia, Europa, América del Norte, Australia y América del Sur, el riesgo de desarrollar demencia fue mayor en las mujeres que en los hombres (cociente de riesgos instantáneos [CRI] 1,12; IC del 95%: 1,02-1,23). Las primeras estimaciones representativas a nivel nacional de la prevalencia de la demencia en la India indicaron una mayor prevalencia en las mujeres, las personas con menos educación y en los entornos rurales.55 56Tanto en los países de ingresos altos como en los de ingresos bajos y medianos, la evidencia sugiere que el riesgo está relacionado con factores distintos del sexo biológico. Una mayor esperanza de vida y un menor nivel educativo en las mujeres que en los hombres, así como una reducción de los estrógenos en las mujeres posmenopáusicas, podrían causar diferencias sexuales en el desarrollo de la demencia. Un estudio representativo a nivel nacional en Japón de 2200 adultos seguidos desde los 60 años durante 12 años, o hasta la muerte, informó que los menores logros educativos y el trabajo doméstico o las ocupaciones de trabajo manual explicaron las puntuaciones cognitivas basales más bajas de las mujeres y un mayor deterioro cognitivo a lo largo de los años de seguimiento.
57 Un estudio realizado en el Reino Unido con 15 924 participantes identificó que las mujeres nacidas más recientemente en la cohorte estaban alcanzando las puntuaciones más altas de memoria y fluidez de los hombres, a medida que aumentaba el acceso de las mujeres a la educación.
58 Un análisis de 70 846 personas de 60 años o más en los EE. UU., México, Brasil, China e India encontró que la función cognitiva más pobre en las mujeres que en los hombres era más pronunciada en los países de ingresos medios que en los EE. UU. El ajuste por educación atenuó la diferencia en la cognición entre hombres y mujeres en todos los países y eliminó la diferencia en el grupo que recibió un alto nivel de educación.
59 Esta diferencia entre países sugiere que el aumento del riesgo en las mujeres está relacionado en parte con la falta de oportunidades en el trabajo y la educación, lo que conduce a un aumento de la pobreza, un menor acceso a la atención médica y discriminación, todo lo cual varía entre culturas más que entre sexos biológicos.
60 Aunque existe poco conocimiento sobre los riesgos de demencia en las personas que tienen una pareja del mismo sexo, un estudio realizado en Estados Unidos con 23.669 adultos mayores de 50 años identificó un mayor riesgo de deterioro cognitivo en aquellos con una pareja del mismo sexo que en aquellos con una pareja del sexo opuesto.
61 Además, los hombres y mujeres cisgénero generalmente tienen menos factores de riesgo para desarrollar demencia en la vejez que los hombres y mujeres transgénero.
Métodos para considerar la causalidad
Los accidentes cerebrovasculares (incluidos los causados por la fibrilación auricular), la enfermedad de Parkinson, el VIH y la sífilis son causas de demencia en lugar de factores de riesgo, y no los incluimos aquí como factores de riesgo. La demencia vascular suele estar relacionada con el accidente cerebrovascular, que puede ser sintomático o detectarse en las imágenes en ausencia de síntomas motores, y el accidente cerebrovascular se especifica en los criterios diagnósticos de la demencia vascular. El accidente cerebrovascular ocurre con más frecuencia en personas con muchos factores de riesgo potencialmente modificables, como el tabaquismo, la hipertensión y la diabetes, que en personas sin factores de riesgo.
63Aunque los ECA son el estándar de oro para establecer la eficacia de una intervención y, por lo tanto, la causalidad de los factores de riesgo, a menudo son poco prácticos para estudiar la demencia. Los ensayos pueden requerir décadas de intervención y seguimiento antes de que ocurra la demencia clínica, lo que genera costos prohibitivos y sesgos debido al abandono selectivo. Además, puede ser poco ético o imposible asignar aleatoriamente a las personas a un grupo de tratamiento. Los métodos de inferencia causal, los estudios cuasiexperimentales o los estudios ecológicos podrían aumentar la evidencia.
64 En una revisión Cochrane que comparó estudios sobre los resultados de la atención médica (aunque no específicamente sobre la demencia), en la que se evaluaron los efectos cuantitativos de los ECA y los estudios observacionales de las intervenciones, se identificó que 23 de 34 estudios informaron estimaciones de efectos similares de los ECA y los estudios observacionales.
65 Se identificaron diferencias cuando había alta heterogeneidad en el metanálisis (es decir, >50%). Un enfoque para evaluar la causalidad es estudiar los efectos de la intervención implementada en un momento determinado, como la reducción de la contaminación del aire o el aumento de la educación de toda la población. Otro enfoque son los análisis de aleatorización mendeliana, que, por primera vez, hemos incorporado a nuestro marco de triangulación cuando ha sido posible, para ayudar a establecer la causalidad. La aleatorización mendeliana es un método de inferencia causal que se basa en la asignación aleatoria de alelos en el momento de la concepción, por lo que su asociación con un riesgo no puede ser causada por una enfermedad posterior. Este enfoque asume que los comportamientos y el estado de ánimo están en parte impulsados genéticamente y solo se pueden utilizar para la inferencia causal cuando hay suficiente diversidad genética que influye en un factor de riesgo particular en la población estudiada. La aleatorización mendeliana también está limitada por factores como el sesgo de supervivencia, que probablemente explique los hallazgos controvertidos de la aleatorización mendeliana que se oponen a los hallazgos de los ECA.
,
Factores de riesgo específicos potencialmente modificables para la demencia
Los esfuerzos de prevención de la demencia deben adoptar un enfoque matizado y adaptado a los diferentes grupos y tratar de reducir las barreras estructurales y socioculturales para la participación de los grupos de alto riesgo. Los ensayos y las bases de datos de investigación deben apuntar a la diversidad sociodemográfica para reflejar las poblaciones de la vida real. En las siguientes secciones, describimos brevemente los estudios de investigación relevantes recientemente publicados e ilustrativos que se suman a la base de evidencia de la Comisión 2020 sobre los factores protectores y de riesgo para el desarrollo de la demencia. Discutimos en qué parte del curso de la vida la evidencia sugiere que estos factores comienzan a ser importantes, dadas las limitaciones de las edades para las que se dispone de evidencia.
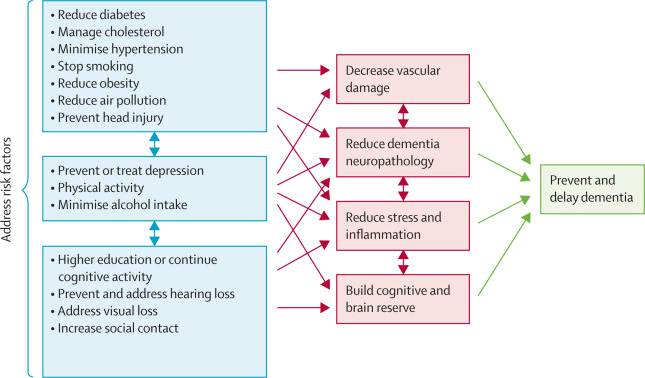
2 Mientras que algunos factores de riesgo, como la hipertensión, evolucionan y cambian a lo largo de la vida, otros factores, como el alcohol o el tabaquismo, pueden ser más consistentes. En la figura 2 resumimos los posibles mecanismos de protección frente a la demencia.
Educación, logros educativos y actividad cognitiva
Anteriormente informamos que las personas con más educación infantil y mayor nivel educativo tienen un menor riesgo de demencia, y discutimos si los efectos de la estimulación cognitiva posterior podrían deberse a que las personas con más educación tienen ocupaciones cognitivamente más estimulantes que las personas con bajos niveles de educación.
2 Se ha estimado que las diferencias en la calidad de la educación, medida por los niveles de lectura a las edades de 14 a 15 años, explican aproximadamente la mitad de las disparidades en la prevalencia de la demencia en los Estados Unidos entre los grupos raciales.
68 En general, el logro educativo, no los años de educación, parece impulsar el efecto protector para la cognición futura y la demencia.
,
70En China, estudios realizados con 20 años de diferencia utilizando los mismos métodos y áreas geográficas informaron que la incidencia y la prevalencia de la demencia han aumentado específicamente en personas con menos de 6 años de educación, posiblemente porque esta población ahora tiene más probabilidades de sobrevivir hasta una edad más avanzada que en años anteriores debido a la mejora general de la salud de la población.
71 En los Estados Unidos, la prevalencia ha disminuido, en paralelo con el aumento de la educación para toda la población diversa del país. La prevalencia de demencia reportada disminuyó más en las personas negras de 65 a 74 años, en línea con la mayor mejora en la educación de esta población que la población blanca no hispana.
72 Para los chinos, filipinos y japoneses-americanos, obtener un título universitario se asoció con un menor riesgo de demencia.
73En un estudio de 107 896 personas de países de ingresos bajos a los que se dio seguimiento durante 13,7–30,1 años, se notificó un menor riesgo de demencia en los participantes con alta estimulación cognitiva en el trabajo que en los participantes con baja estimulación cognitiva en el trabajo (HR de seguimiento a 10 años: 0,79; IC del 95%: 0,66–0,95).
74 En comparación con las personas con poca educación y baja estimulación cognitiva en el trabajo, el HR para la demencia en las personas con alta estimulación cognitiva en el trabajo pero con poca educación fue de 0,80 (0,66-0,97) y para las personas con alta estimulación cognitiva y alta educación fue de 0,63 (0,49-0,82; Figura 3). Resultados similares se informaron en un estudio realizado en Asia, Australia, Europa y América del Norte, que siguió a 10 195 personas durante 3,9 a 6,4 años, y encontró que tanto la educación secundaria como la complejidad ocupacional se asociaron de forma independiente con un mayor tiempo de supervivencia libre de demencia, con un 28% del efecto de la educación mediado por la complejidad ocupacional.
75 Sin embargo, un estudio estadounidense informó que los años de escolaridad predijeron la protección contra el efecto de las lesiones de la sustancia blanca en las personas blancas por resonancia magnética, pero no en las personas negras.
76 A nivel mundial, el nivel educativo ha aumentado con el tiempo, pero sigue siendo bajo en algunos países, por lo que es de gran relevancia cuando se considera la prevención de la demencia y la salud en general.

La alta estimulación cognitiva se ha asociado con la reserva cognitiva. La capacidad de mantener la reserva cognitiva podría estar mediada por muchos mecanismos, incluyendo concentraciones más altas de proteínas circulantes para permitir la reparación del cerebro a través de la axonogénesis y la sinaptogénesis.
74 mayor eficiencia y menor disminución de las redes cerebrales funcionales,
,
79 El aumento de los logros laborales está vinculado a una mejor situación financiera que conduce a más opciones sobre dónde vivir, una mejor salud física a través de un mejor acceso a la atención de la salud y la concienciación sobre la salud, y otros comportamientos que promueven la salud. Un estudio de aleatorización mendeliana identificó que el efecto de los años de educación (medido por genes predictivos) estaba mediado por la inteligencia (medida por genes relacionados con el rendimiento en las pruebas de cociente intelectual).
80En la Lancet Commission de 2020, informamos que los ensayos de entrenamiento cognitivo computarizado en personas mayores sanas y personas con deterioro cognitivo leve generalmente sugirieron un pequeño efecto positivo sobre la cognición, pero no estaba claro si el entrenamiento cognitivo computarizado tenía valor clínico debido a la baja calidad y heterogeneidad de los estudios.
81 Una revisión Cochrane actualizada de las intervenciones de entrenamiento cognitivo computarizado para mantener la función cognitiva en personas mayores cognitivamente sanas, administrada a lo largo de 12 a 26 semanas, también identificó evidencia de baja calidad que respaldaba los pequeños beneficios inmediatos del entrenamiento cognitivo computarizado sobre la función cognitiva global versus controles activos y sobre la memoria episódica versus controles inactivos, sin evidencia de efecto a largo plazo.
82 En particular, las intervenciones de entrenamiento cognitivo computarizado a corto plazo a baja intensidad, que pueden ser financieramente costosas, solo tienen evidencia de baja calidad de efectividad a corto plazo y ninguna evidencia de efectividad a largo plazo en el mantenimiento de la cognición. Es posible que el entrenamiento cognitivo en estos ensayos no cubra la amplitud de la función cognitiva, no sea lo suficientemente intensivo o atractivo, o se administre demasiado tarde en la vida para preservar la función cognitiva. La exposición a la estimulación cognitiva en el trabajo reduce el riesgo de demencia y es de mayor duración que las intervenciones cognitivas o los pasatiempos cognitivamente estimulantes.
Pérdida auditiva y audífonos
A nivel mundial, se estima que el 20% de las personas tienen pérdida de audición, a veces relacionada con exposiciones ocupacionales o ambientales al ruido o infecciones no tratadas.
83 El 62% de las personas con pérdida auditiva en todo el mundo tienen más de 50 años, y la pérdida auditiva a menudo no se trata.
83 En nuestras anteriores Comisiones de The Lancet, realizamos un metanálisis de estudios de cohorte de alta calidad con participantes que no padecían demencia pero que habían medido objetivamente la pérdida auditiva periférica al inicio del estudio.
,
2 Se definieron los estudios de alta calidad como aquellos con medidas objetivas de la audición a través de la evaluación de tonos puros; más de 5 años de seguimiento; ajuste por edad, factores cardiovasculares y cognición o educación al inicio del estudio; y un riesgo general para el resultado de la demencia incidente. Existen otros cinco metaanálisis sobre la asociación entre la pérdida de audición y la demencia posterior.
,
,
,
,
88 uno de los cuales se centró en las lenguas tonales siníticas.
86 Todos estos análisis informaron asociaciones significativas entre la pérdida de audición y la demencia posterior, que oscilaron entre RR 1,28 (IC del 95%: 1,02-1,58) y 2,39 (1,58-3,61).
85 En el estudio más reciente, la pérdida auditiva incidente se asoció con el riesgo de demencia incidente (HR 1,35, IC 95% 1,26-1,45) y se relacionó con la dosis, ya que cada empeoramiento de 10 dB de la audición se asoció con un aumento del 16% en el riesgo de demencia (IC 95% 1,07-1,27).
88Ninguno de estos análisis incluyó todos los criterios que se consideraron para garantizar datos de alta calidad en nuestro metanálisis anterior. También se excluyeron los estudios que compararon poblaciones con diversas gravedades de pérdida auditiva, pero no compararon a los individuos con pérdida auditiva con aquellos sin pérdida auditiva. Se realizaron nuevas búsquedas desde el inicio de la base de datos hasta el 20 de marzo de 2023 en PubMed, Ovid Embase, PsycINFO, Web of Science, Cochrane Library, PROSPERO y el Centre for Reviews and Disemination, contactando a los autores para obtener aclaraciones según fuera necesario, y se encontraron seis estudios que cumplían los criterios (apéndice, pp. 1-2).
,
,
,
,
,
94 Se realizaron búsquedas en «todos los campos» utilizando los términos de búsqueda «demencia» o «deterioro cognitivo» o «enfermedad de Alzheimer» o «deterioro cognitivo leve» Y «audición» o «audición» o «audición» o «presviacusia». Se calcularon los totales si solo se informaron los subgrupos, lo que generó un CRI general para los estudios.
,
,
93 Se utilizaron los resultados no ajustados para los audífonos porque los audífonos forman parte de la vía causal entre la pérdida auditiva y la demencia.
,
,
95 La edad media de referencia de los participantes en el estudio osciló entre los 59 y los 77 años, y el estudio más grande reclutó a hombres cuando se inscribieron en la junta de reclutamiento obligatorio a la edad de 18 a 20 años, pero midió el estado auditivo a una edad media de 59,9 años (IQR 54,6-65,4).
92 El seguimiento en todos los estudios entre el inicio y el estado de demencia fue de entre 6 y 12 años. Realizamos un metanálisis de efectos aleatorios de estos estudios, en el que las personas con pérdida auditiva tenían un mayor riesgo de demencia en comparación con las que no tenían pérdida auditiva (HR 1,37, IC del 95%: 1,00-1,87; Yo
2=80%; n=666 370; Figura 4). Cuatro de los estudios más pequeños informaron sobre el uso de audífonos, y entre el 18 y el 64,5% de las personas con pérdida auditiva usaban audífonos.
,
,
,
94 Todas las personas con pérdida auditiva se incluyeron en nuestro metanálisis, sin considerar el uso de audífonos en la estimación general del riesgo, por lo que la estimación es conservadora. En nuestra meterregresiva, los estudios con una mayor proporción de personas que usaban audífonos informaron una menor probabilidad de demencia que aquellos con una menor proporción de personas que usaban audífonos, pero el intervalo de confianza fue amplio (-1,32, -3,34 a 0,71).

A medida que aumenta la gravedad de la pérdida auditiva, aumenta el riesgo de demencia: los cuatro estudios que investigaron la dosis-respuesta entre la audición y el riesgo de demencia informaron que cada disminución de 10 dB en la capacidad auditiva aumentaba el riesgo de demencia.90, 91, 96, 97 La magnitud de este aumento del riesgo varió entre los estudios, desde un aumento del 4%96 a un aumento del 24%91 en el riesgo de demencia por 10 dB de disminución de la capacidad auditiva.La pérdida auditiva específica del habla en ruido, en la que el déficit es la comprensión del habla cuando hay otros ruidos de fondo, es poco frecuente. El único estudio grande hasta la fecha en el que se midió objetivamente la pérdida de audición del habla en ruido utilizó datos del Biobanco del Reino Unido (n = 82 039; 100 personas con pérdida del habla en ruido, seguidos durante una mediana de 10 años). En comparación con las personas con audición típica de habla en ruido (es decir, umbral de recepción del habla en ruido [SRTn] <-5,5 dB), hubo un mayor riesgo de demencia en personas con insuficiencia (SRTn ≥-5,5 dB a <-3,5 dB; HR 1,61, IC 95% 1,41-1,84) y mala (SRTn ≥-3,5 dB; 1,91, 1,55-2,36) audición en ruido.98Se han propuesto varias hipótesis para explicar cómo la pérdida de audición podría aumentar el riesgo de demencia. Los factores psicosociales, como la soledad, la depresión y el aislamiento social, pueden estar involucrados. Otros mecanismos incluyen la reducción de la reserva cognitiva debido a la disminución de los estímulos ambientales, el aumento de los recursos cognitivos necesarios para escuchar y una interacción de estos riesgos con la patología cerebral.99 Un vínculo causal entre la pérdida de audición y la demencia está respaldado por el hecho de que la exposición más prolongada a la pérdida de audición se asocia con un mayor riesgo de demencia, con el riesgo máximo en las personas que fueron diagnosticadas con pérdida de audición durante más de 25 años.100 Otro mecanismo postulado es la patología cardiovascular común, en la que la enfermedad vascular afecta a la cóclea o a la vía ascendente, causando pérdida de audición, y al lóbulo medial-temporal, causando demencia. Este mecanismo sugeriría que la confusión por el estado de salud cardiovascular o los riesgos explicaría sustancialmente la asociación entre la pérdida de audición y el riesgo de demencia, lo que no se ha demostrado en los metanálisis.99La evidencia descrita aquí plantea la cuestión de si el uso de audífonos en personas con pérdida auditiva puede eliminar o mitigar el aumento del riesgo de demencia. El estudio ACHIEVE, el primer ECA de audífonos y cognición, reclutó a personas de 70 a 84 años. Los participantes eran voluntarios sanos con pérdida auditiva que fueron reclutados con anuncios (n = 739) y personas de una cohorte existente, el estudio ARIC (n = 238).101 No hubo ningún efecto general del uso de audífonos en el resultado primario de la cognición a los 3 años de seguimiento (diferencia -0,002; IC del 95%: -0,08 a 0,08). Es importante destacar que un análisis de sensibilidad preespecificado identificó efectos sustanciales del uso de audífonos en la cognición a los 3 años en el grupo ARIC (diferencia 0,19, 0,02 a 0,36). La población ARIC tenía más factores de riesgo de demencia (es decir, la edad media de la población era 2,8 años mayor, menor cognición basal, fumaba más, menos educación, vivía sola con más frecuencia y era más propensa a tener diabetes e hipertensión) que la población de voluntarios sanos con pérdida auditiva. El deterioro cognitivo incidente fue mayor en el grupo ARIC (57 [24%] de 238 participantes) que en las personas que fueron reclutadas a través de anuncios (61 [8%] de 739 participantes) en el seguimiento a 3 años. En particular, los autores enfatizaron que los participantes voluntarios que se reclutan a través de este tipo de método generalmente representan un subconjunto más saludable de la población objetivo. En general, hubo un gran efecto protector de los audífonos sobre la cognición en la población con alto riesgo en la cohorte ARIC (reducción del 48% en el deterioro cognitivo global a 3 años en comparación con la población de control). La tasa más lenta de deterioro cognitivo en el grupo de voluntarios sanos en comparación con la cohorte ARIC podría haber limitado cualquier efecto sobre la cognición en este grupo dentro de un período de seguimiento de 3 años. La explicación del gran efecto en la cohorte ARIC podría ser que los audífonos en grupos con alto riesgo de demencia también cambian el contacto social, el bajo estado de ánimo, la estimulación cognitiva y mejoran la motivación y la comunicación sobre el tratamiento médico, pero esta evidencia aún no existe.102Anteriormente discutimos la evidencia de que el uso de audífonos protege contra la demencia y reduce las tasas de deterioro cognitivo después de comenzar a usar audífonos.2 Desde entonces, una revisión sistemática y metanálisis de ocho estudios de cohorte con 126 903 participantes, seguidos durante 2 a 25 años, informaron que las personas con pérdida auditiva que usaban audífonos tenían un riesgo significativamente menor de deterioro cognitivo (HR 0,81, 0,76-0,87; Yo2=0%) y demencia (0,83, 0,77–0,90; Yo2=0%; cuatro estudios) que aquellos que no usaron dispositivos de asistencia (Figura 5).103

En otra cohorte de 2114 personas mayores de 50 años con pérdida auditiva autoinformada, 1154 personas tenían deterioro cognitivo leve y las que usaban audífonos tenían un riesgo significativamente menor de desarrollar demencia por todas las causas durante el seguimiento que las que no usaban audífonos (HR 0,73, 0,61-0,89).
105 La mediana del tiempo hasta la aparición de demencia incidente fue de 2 años para los no usuarios de audífonos y de 4 años para los usuarios de audífonos.La evidencia observacional de los beneficios de los audífonos para el riesgo de demencia está aumentando. Incluso si solo se consideran los estudios con seguimiento prolongado, para reducir la posibilidad de causalidad inversa, la evidencia de que los audífonos reducen el riesgo de demencia es consistente y respaldadora. Implementar el uso de audífonos, si es efectivo para prevenir la demencia, probablemente ahorraría costos.
Depresión
En la Comisión Lancet de 2020, concluimos, sobre la base de estudios publicados, que el vínculo entre la depresión y la demencia era probablemente bidireccional y que, en los años anteriores a la presentación de la demencia, la depresión puede ser un síntoma de demencia en evolución; una reacción al deterioro cognitivo; o una causa de deterioro cognitivo. También se observó que pocos estudios habían considerado si el riesgo de demencia se veía afectado por el tratamiento de la depresión.Un nuevo metanálisis identificó que la depresión se asoció con la demencia por todas las causas, aunque hubo un alto grado de heterogeneidad entre los estudios (RR 1,96, IC del 95%: 1,59-2,43; Yo
2=96,5%; 27 estudios).
110 Para esta Comisión, elegimos los siete estudios incluidos por Stafford y colaboradores con un seguimiento de 10 a 14 años
,
,
,
,
,
,
,
117 y realizó un metanálisis de efectos aleatorios de los resultados de estos. Identificamos un mayor riesgo de demencia para las personas con depresión en comparación con las que no la tenían (RR 2,25, IC del 95%: 1,69-2,98; Yo
2=82,8%; Figura 6). Seis estudios que especificaron la edad de los participantes tuvieron una edad media inicial general de 63 años. Aunque los estudios fueron heterogéneos en el tamaño del efecto, informaron sistemáticamente un aumento del riesgo de demencia para las personas con depresión, incluso en estudios que emparejaron a los participantes según la edad, el sexo, el estado socioeconómico y las comorbilidades. De manera similar, un estudio de casos y controles danés de 246 499 adultos diagnosticados con depresión (a la mediana de edad de 50,8 años, IQR 34,7-70,7) y 1 190 302 individuos sin depresión informó un mayor riesgo de demencia en general entre aquellos con depresión (HR 2,41, IC 95% 2,35-2,47) en comparación con aquellos sin depresión. La asociación también se observó en personas para las que el intervalo entre la fecha índice para la evaluación de la depresión y la demencia fue superior a 20-39 años (1,79, 1,58-2,04), y en aquellas diagnosticadas con depresión temprana (es decir, 18-44 años; 3,08, 2,64-3,58), medias (es decir, 45-59 años; 2,95, 2,75-3,17), o en la vejez (es decir, 60 años; 2,31, 2,25-2,38) en comparación con las personas sin depresión.120 En un estudio nacional sueco de 41 727 gemelos, con un seguimiento de 18 años, se informó que el riesgo de demencia aumentaba para la depresión en la mediana edad (odds ratio [OR] 1,46, IC 95% 1,09-1,95), en la vejez (2,16, 1,82-2,56) y de por vida (2,65, 1,17-5,98).121

En general, estos estudios sugieren que la depresión aumenta el riesgo de demencia en todas las edades adultas, aunque en la vejez, parte de la asociación es causada por la demencia preclínica. Por lo tanto, estamos clasificando la depresión como un factor de riesgo en la mediana edad porque existe un claro riesgo en la mediana edad.No hubo diferencias entre gemelos idénticos o no idénticos en el estudio sueco descrito, lo que llevó a la conclusión de que el riesgo de demencia no se explicaba por el riesgo genético o el entorno de vida temprana; Sin embargo, el riesgo de depresión en la mediana edad y demencia futura fue menor en los que tenían 8 o más años de educación que en los que tenían menos de 8 años de educación.
121 Se desconocen los mecanismos que relacionan la depresión con el riesgo de demencia, aunque la depresión podría conducir a una reducción del autocuidado y el contacto social. Otro mecanismo hipotético por el cual la depresión podría aumentar la demencia podría ser la secreción excesiva de cortisol que conduce a la atrofia del hipocampo o a la respuesta inflamatoria.
122Un estudio del Biobanco del Reino Unido sobre intervenciones para la depresión incluyó a 354 313 participantes de 50 a 70 años sin demencia al inicio del estudio, seguidos durante una mediana de 11,9 años (IQR 11,2-12,6).
123 e informó que las personas con un diagnóstico de depresión (n = 46 280) tenían un mayor riesgo de desarrollar demencia (HR 1,51, IC 95% 1,38-1,63). Las personas que fueron tratadas para la depresión con farmacoterapia (n = 14 695; 0,77, 0,65-0,91), psicoterapia (n = 2151; 0,74, 0,58-0,94) o terapia combinada (n = 5281; 0,62, 0,53-0,73) tuvieron menos probabilidades de desarrollar demencia que el grupo no tratado (HR de tratamiento general 0,69, 0,62-0,77). El grupo no tratado que remitió no tuvo un mayor riesgo de demencia que el grupo sin depresión (0,84, 0,56-1,24). Este estudio proporcionó datos para un grupo más grande y durante un período más largo que la evidencia previa
,
125 pero todavía está abierto al sesgo de los estudios observacionales. Sin embargo, es poco probable que haya tales ECA a largo plazo. Los hallazgos sobre el efecto de la medicación y la terapia para la depresión en la reducción del riesgo de demencia sugieren la importancia de tratar la depresión tanto por la calidad de vida como porque podría reducir el riesgo de demencia en el futuro.
Lesión cerebral traumática
Realizamos un metanálisis del riesgo de demencia por todas las causas después de un traumatismo craneoencefálico en la Comisión Lancet de 2020 (RR 1·84, 1·54-2·20).
2 Posteriormente, dos metanálisis informaron estimaciones similares. El primer análisis, que incluyó 21 estudios con un total de 8 684 485 personas, informó una OR de 1,81 (IC del 95%: 1,53-2,14) para el TCE y el riesgo de demencia.
126 Un metanálisis de 32 estudios (n = 7 634 844), que incluyó 17 estudios del otro metanálisis, informó un RR para la demencia después de un TCE de 1,66 (IC del 95%: 1,42-1,93).
127 Ambos estudios identificaron que una edad más temprana en el momento del TCE (es decir, <65 años) y el sexo masculino se asociaron con un mayor riesgo de demencia.En los países de ingresos bajos y medianos, el traumatismo craneoencefálico se produce con mayor frecuencia por accidentes de tráfico, pero en los países de ingresos altos, el traumatismo craneoencefálico se debe con mayor frecuencia a caídas o violencia, siendo el alcohol un factor contribuyente común.
128 Por lo tanto, el riesgo de LCT está relacionado con otros comportamientos de salud que son factores de riesgo para la demencia. Un gran estudio longitudinal prospectivo, nacional, finlandés (n = 32 385) informó que la asociación entre el TCE grave (es decir, >3 días de hospitalización) y la demencia se atenuó (de HR 1,51 [IC 95% 1,03-2,22] a 1,30 [0,86-1,97]) después de ajustar otros factores de riesgo para la demencia, como la educación, el tabaquismo, el consumo de alcohol, actividad física e hipertensión.
129Conmoción cerebral y traumatismo craneoencefálico leve (mTBI, por sus siglas en inglés) son términos que a menudo se usan indistintamente.
130 Hay pocos estudios sobre el riesgo de mTBI y demencia, y los problemas metodológicos incluyen definiciones inconsistentes. Un estudio de cohorte previo que utilizó un registro nacional de pacientes informó un mayor riesgo de demencia incluso con un solo mTBI (OR 1,63; IC del 95%: 1,57-1,70).
131 Desde la Comisión Lancet de 2020, un estudio de cohorte no informó de un aumento del riesgo de demencia por mTBI en 15 años.
129 pero una revisión sistemática y metanálisis de cinco estudios, que incluyeron a 3 149 740 personas que informaron antecedentes de mTBI que cumplían con los criterios de la OMS, identificaron un mayor riesgo de enfermedad de Alzheimer (RR 1,18, IC 95% 1,11-1,25), y un análisis de sensibilidad que incluyó los pocos estudios en los que mTBI precedió a la enfermedad de Alzheimer en más de 10 años (n = 2307) también identificó un mayor riesgo de demencia después de TBI, aunque con intervalos de confianza más amplios (2,02, 0,66-6,21).
132Algunos deportes (p. ej., rugby, fútbol americano y hockey sobre hielo) implican contacto frecuente con la cabeza y eventos de latigazo cervical y se asocian con un mayor riesgo de LCT repetidas que los deportes en los que puede ocurrir una LCT individual de baja frecuencia en accidentes o como parte del deporte (p. ej., ciclismo, equitación y boxeo). Existe una creciente preocupación por el hecho de que los jugadores profesionales y aficionados de fútbol y rugby viven y mueren más a causa de enfermedades neurodegenerativas que la población general, lo que podría estar relacionado con una lesión cerebral traumática grave ocasional o una lesión cerebral traumática leve frecuente por contacto físico con otras personas o por cabecear un balón de fútbol.
133 Un metanálisis que clasificó el riesgo de conmoción cerebral en los deportes de contacto identificó 83 estudios de tasas de conmoción informadas, principalmente de los EE. UU. (n = 66), con cinco estudios de Canadá y cinco estudios del Reino Unido.
134 El rugby tuvo la tasa más alta de conmociones cerebrales (28,3 conmociones cerebrales por cada 10.000 partidos), seguido del fútbol americano (8,7 conmociones cerebrales por cada 10.000 partidos), el hockey sobre hielo (7,9 conmociones cerebrales por cada 10.000 partidos) y la lucha libre (5,0 conmociones cerebrales por cada 10.000 partidos). El deporte universitario tuvo tasas de conmociones cerebrales ligeramente más altas que el deporte de la escuela secundaria (3,8 conmociones cerebrales frente a 3,7 conmociones cerebrales por cada 10,000 juegos).La evidencia sugiere que las personas que juegan fútbol profesional durante más tiempo, en posiciones en las que cabecean la pelota con más frecuencia, son más propensas a sufrir lesiones en la cabeza y tienen un mayor riesgo de demencia. Un pequeño estudio de 60 jugadores informó que la capacidad cognitiva en ex jugadores de fútbol profesional se asoció inversamente con la frecuencia estimada de cabezazos.
135 Un gran estudio realizado en Escocia (Reino Unido) informó que 386 (5,0%) de 7676 ex jugadores de fútbol en comparación con 366 (1,6%) de 23 028 individuos emparejados por edad, sexo y nivel socioeconómico del área desarrollaron una enfermedad neurodegenerativa (HR 3,66, IC 95% 2,88-4,65).
136 Este mayor riesgo fue más alto para los defensas que tenían una alta frecuencia de cabezazos o que habían jugado profesionalmente durante más de 15 años y más bajo para los porteros. Un estudio de futbolistas profesionales franceses informó que la mortalidad por todas las causas fue menor que la de la población nacional (tasa de mortalidad estandarizada 0,69, IC del 95%: 0,64-0,75), pero los futbolistas que murieron tuvieron una tasa más alta de muertes con demencia que los no jugadores (3,38, 2,49-4,50).
,
138 Un estudio de cohorte de 6007 jugadores de fútbol masculinos (excluyendo porteros) de la primera división de Suecia y participantes de control emparejados por sexo, área y región informó que los jugadores de fútbol tenían un mayor riesgo de demencia por todas las causas (HR 1,62, IC 95% 1,47-1,78), pero no enfermedad de la neurona motora ni enfermedad de Parkinson.
139 El riesgo de mortalidad por todas las causas fue menor entre los futbolistas que entre los controles (0,95, 0,91-0,99). De manera similar, la mortalidad por todas las causas fue menor entre los ex jugadores de rugby del equipo nacional hasta los 70 años de edad, pero en una mediana de 32 años, 47 (11%) de 412 ex jugadores de rugby y 67 (5%) de los 1236 participantes en el grupo de control fueron diagnosticados con enfermedad neurodegenerativa (2,67, 1,67-4,27).
137La lesión cerebral traumática puede causar o exacerbar la demencia a través de un trauma directo.
140 Los mecanismos patológicos plausibles para la neurodegeneración a largo plazo después de un TCE incluyen la lesión axonal que promueve la generación temprana de proteinopatías (p. ej., tau hiperfosforilada y β amiloide), la activación microglial y la atrofia cortical.
,
142 Se identificaron tres estudios de cohorte que evaluaron la patología cerebral en personas con antecedentes de TCE y pérdida del conocimiento, sin consistencia entre los estudios para la asociación con neuropatologías. Un estudio de 1589 personas que se sometieron a una autopsia informó un aumento en la patología con cuerpos de Lewy y la esclerosis del hipocampo, pero no placas ni ovillos en personas que tuvieron LCT con pérdida del conocimiento.
143 Un estudio de la Iniciativa de Neuroimagen de la Enfermedad de Alzheimer de 241 participantes, 41 de los cuales informaron una lesión cerebral traumática previa, identificó que los antecedentes de lesión cerebral traumática se asociaron con un aumento de la deposición de β amiloide, adelgazamiento cortical y la aparición de deterioro cognitivo 3-4 años antes que para aquellos sin lesión cerebral traumática previa.
144 Por el contrario, un estudio poblacional del Reino Unido que incluyó a 80 participantes que habían sufrido un traumatismo craneoencefálico con pérdida del conocimiento antes de los 60 años no encontró diferencias en la deposición de β amiloide, el volumen del hipocampo o el grosor cortical, pero una cognición más baja y un volumen cerebral más pequeño en comparación con sus 395 contrapartes sin lesión en la cabeza a la edad de 70 años.
145 El trabajo en curso con neuroimagen y biomarcadores de fluidos de neurodegeneración podría ayudar a identificar patrones superpuestos y distintos de neuropatología en personas con diferentes subtipos de demencia postraumática u otros trastornos neurodegenerativos, incluida la encefalopatía traumática crónica.
,
146En general, la evidencia sugiere que el TCE aumenta el riesgo de demencia, lo que posiblemente conduzca a un inicio más temprano de la demencia en 2-3 años que en las personas sin LCT.
147 lo que podría deberse a la acumulación de neuropatología subyacente. Este riesgo de enfermedades neurodegenerativas no debe oscurecer el mensaje de que el deporte es generalmente bueno para la salud. La protección contra las lesiones en la cabeza, por ejemplo, mediante el equipo de protección de la cabeza adecuado, la limitación de las prácticas de cabeceo y las colisiones de alto impacto, la prevención de los juegos inmediatamente después de una lesión cerebral traumática y, posiblemente, la adaptación de las normas para limitar las lesiones, debería ser ahora una prioridad de salud individual y pública. Algunos organismos deportivos y gubernamentales han comenzado a implementar estas políticas.
Tabaquismo
Anteriormente informamos que fumar en la vejez se asocia con un mayor riesgo de demencia (HR 1,6, 1,2-2,2).
2 Nuevas evidencias muestran ahora que fumar en la mediana edad parece ser un factor de riesgo más fuerte para la demencia que fumar en la vejez, posiblemente debido a las mejoras en el tratamiento de las enfermedades cardiovasculares y los cánceres relacionados con el tabaquismo, lo que lleva a una mayor probabilidad de que los fumadores vivan lo suficiente como para desarrollar demencia. Un metanálisis grande realizado por Zhong y sus colegas informó que fumar en la mediana edad aumentaba el riesgo de demencia (RR 1,30, IC del 95%: 1,18-1,45; 37 estudios), pero no hubo un aumento del riesgo en los ex fumadores.
148 El Framingham Heart Study (n = 4015; seguimiento de 21 años) identificó el riesgo más fuerte de demencia en personas que comenzaron a fumar en la vida adulta temprana (es decir, entre 33 y 44 años; HR 1,42, IC del 95%: 0,05-3,60).
149 Otros estudios de cohortes a largo plazo, como el estudio ARIC (seguimiento a 25 años; n=15 744; 1,41, 1,23–1,61)
150 y el estudio Whitehall II (seguimiento a 32 años; n=9951; 1,36, 1,10-1,68),
151 han reportado un exceso similar de riesgo de demencia en fumadores actuales de mediana edad (es decir, edad media de 44,9 años [DE 6,0]). Un estudio del Biobanco del Reino Unido de 497 401 adultos informó de un HR para la demencia de 1,7 (1,2-2,5) para los fumadores menores de 50 años al inicio del estudio.
152 En la población general danesa, un análisis combinado de dos cohortes prospectivas, que incluía un total de 61 664 individuos, informó que el riesgo de demencia para los fumadores de mediana edad aumentó para los hombres (3,2, 1,4-7,4) y las mujeres (1,7, 1,1-2,8) en comparación con los no fumadores.
153Un seguimiento de 32 años de la cohorte Whitehall II, controlando el estatus socioeconómico, identificó que los fumadores actuales (HR 1,36, IC 95% 1,10-1,68) pero no los exfumadores (0,95, 0,79-1,14) tienen un mayor riesgo de demencia en comparación con las personas que nunca han fumado y que las desigualdades socioeconómicas en el riesgo de demencia estaban mediadas en parte por el tabaquismo.
151 El estudio de Zhong y sus colegas tampoco mostró un aumento en el riesgo en los exfumadores. De manera similar, en un estudio nacional coreano de 789 532 participantes a los que se evaluó el estado de tabaquismo durante 2 años, se informó que los ex fumadores tenían un menor riesgo de demencia por todas las causas (0,92, 0,87-0,97) que los fumadores continuos, que fue más pronunciado entre los adultos que fumaron antes de los 65 años (0,8, 0,7-0,9) que los que fumaron a los 65 años o más (1,0, 0·9–1·0).
154 Otro estudio poblacional coreano que examinó el riesgo de demencia en personas con fibrilación auricular también informó de una reducción del riesgo de demencia en personas que habían dejado de fumar (0,83, 0,72-0,95) en comparación con los fumadores actuales.
155 Estos estudios sugieren que dejar de fumar reduce el riesgo de demencia en comparación con el tabaquismo continuo. Fumar ahora debe considerarse un factor de riesgo en la mediana edad (en lugar de un factor en la vejez, como en la Comisión Lancet de 2020),
2 Y el efecto beneficioso de dejar de fumar es alentador.
Factores de riesgo cardiovascular
Hemos optado por considerar los factores de riesgo individualmente en lugar de la morbilidad cardiovascular general. La demencia vascular generalmente ocurre cuando las personas tienen un accidente cerebrovascular (y el accidente cerebrovascular es parte de los criterios de diagnóstico), y la demencia vascular ocurre con más frecuencia en personas que fuman o que tienen diabetes e hipertensión.
63 El accidente cerebrovascular y la demencia comparten los factores de riesgo de menor educación, ejercicio poco frecuente, hipertensión, enfermedades cardíacas y aislamiento social.
156 Pero algunas personas con estos factores de riesgo no desarrollarán demencia a pesar de la neuropatología, a veces porque mueren a una edad temprana, antes de que se desarrolle la demencia.
23Varios estudios han examinado el efecto de una combinación de factores de riesgo cardiovascular sobre el riesgo de demencia. El grupo Life’s Simple 7 definió los factores ideales de salud cardiovascular (es decir, IMC, dieta, tabaquismo, actividad física, presión arterial, colesterol y concentraciones de glucosa), y las puntuaciones más altas en este índice se asocian con un menor riesgo de demencia.
,
157 De manera similar, en China, un estudio longitudinal de 10 años de duración con 29 072 personas con una edad media de 72 años en el seguimiento (DE 6,6) informó que el deterioro lento de la memoria se asoció con estar en el grupo sano, lo que significaba tener al menos cuatro de seis factores: dieta saludable (es decir, comer al menos siete de 12 alimentos elegibles), ejercicio físico (es decir, ≥150 minutos de ejercicio de intensidad moderada o ≥75 minutos de ejercicio de intensidad vigorosa semanalmente), contacto social activo (es decir, ≥2 contactos sociales por semana, incluso en línea), actividad cognitiva activa (es decir, participar en ≥2 actividades cognitivas por semana), nunca o antes de fumar (es decir, dejar de fumar hace ≥3 años) y nunca beber alcohol (es decir, beber menos de un vaso pequeño de vino al día).
158 Esta asociación se aplicaba tanto a los portadores de APOE ε4 como a los no portadores.
Colesterol LDL
En el momento de las anteriores Comisiones Lancet sobre la demencia, la evidencia disponible sobre si una alta concentración de colesterol LDL era un posible factor de riesgo de demencia no era concluyente.
2 La evidencia metaanalítica identificó evidencia inconsistente de los HIC de que el colesterol LDL alto en la mediana edad, pero no en la edad avanzada, podría ser un factor de riesgo para el deterioro cognitivo, la demencia por todas las causas y la enfermedad de Alzheimer.
,
160Desde entonces, un metaanálisis de tres estudios de cohorte con un total de 1 138 488 participantes, todos del Reino Unido, que analizaron el colesterol LDL en adultos menores de 65 años seguidos durante más de 12 meses, informó que cada aumento de 1 mmol/L en el colesterol LDL se asoció con un aumento del 8% en la incidencia de demencia por todas las causas (tamaño del efecto 1,08, IC del 95%: 1,03–1,14; Yo
2=0,3%).
161 En un estudio de 1 189 090 participantes se informó que el colesterol LDL alto (es decir, >3 mmol/L) se asoció con un mayor riesgo de demencia (HR 1,33, IC 95% 1,26-1,41).
45 En una gran cohorte del UK Clinical Practice Research Datalink (n=1 853 954) a la que se hizo un seguimiento durante una mediana de 7,4 años (IQR 4,6-10,4), un colesterol LDL basal más alto se asoció de manera similar con un mayor riesgo de demencia por todas las causas (razón de tasas ajustada 1,05, IC del 95% 1,03-1,06 por DE aumento del colesterol LDL [es decir, Aumento de 1,01 mmol/L o 39 mg/dL]).
162 Este riesgo fue mayor en las personas menores de 65 años al inicio del estudio para la demencia diagnosticada dentro de los 10 años (1,10, 1,04-1,15) y más de 10 años después del inicio (1,17, 1,08-1,27) que en las personas que tenían más de 65 años al inicio del estudio. En un estudio de cohorte danés de 94.184 personas a las que se les hizo un seguimiento desde una edad media de 58 años (DE 13,0), las personas que no seguían las pautas dietéticas (es decir, comían al menos tres porciones semanales de frutas, verduras y pescado; rara vez bebían bebidas azucaradas; rara vez comían carne preparada como salchichas o comida para llevar) tenían más probabilidades de tener colesterol LDL alto.
163 Después de una mediana de seguimiento de 9 años (rango <1-15), las personas con una baja adherencia a estas pautas tenían más probabilidades de desarrollar tipos de demencia distintos de la enfermedad de Alzheimer que las personas con una alta adherencia (HR 1,54, IC del 95%: 1,18-2,00), pero no eran más propensas a desarrollar enfermedad de Alzheimer, aunque la subtipificación de la demencia podría no haber sido precisa. Las personas que tomaron medicamentos para reducir los lípidos no tuvieron un mayor riesgo de demencia. Un estudio estadounidense de 4392 personas informó que el aumento del colesterol HDL protegía contra el desarrollo de la demencia.
164Otra evidencia de causalidad proviene de un metanálisis de aleatorización mendeliana que incluyó 27 estudios, que incluyeron a 3136 personas con demencia y 3103 controles sanos, que informaron que el colesterol total alto y el colesterol HDL bajo eran factores de riesgo para la demencia.
165 Por el contrario, un metanálisis de participantes individuales de más de 21 000 personas (edad basal media de 76 años) no identificó ninguna asociación entre el colesterol total, el colesterol LDL o el colesterol HDL y el deterioro cognitivo. Este resultado no cambió cuando el análisis se estratificó según el uso de estatinas o el estado de APOE ε4.
166El exceso de colesterol cerebral se asocia con un mayor riesgo de accidente cerebrovascular y la deposición de β y tau amiloide cerebral, lo que sugiere un mecanismo potencial para el vínculo entre el colesterol LDL y la demencia.
161 El HDL reduce el colesterol excesivo y se correlaciona inversamente con la concentración de β de amiloide cerebral.
167El asesoramiento individual sobre dieta y ejercicio tiene un pequeño efecto en la reducción del colesterol LDL.
168 Las estatinas se han convertido en un foco de investigación en el campo de la enfermedad de Alzheimer y tienen un beneficio potencial debido a sus propiedades antiinflamatorias y antioxidantes, así como a la reducción del colesterol.
169 En un metanálisis de 36 estudios de cohortes, se identificó que el uso de estatinas se asoció con un menor riesgo de demencia por todas las causas (OR 0,80; IC del 95%: 0,75–0,86; Yo
2=97,5%) y enfermedad de Alzheimer (0,68, 0,56-0,81; Yo
2=94,5%) en comparación con el colesterol alto no tratado, sin diferencia entre hombres y mujeres.
170 Una revisión Cochrane de ECA de estatinas administradas en la vejez no encontró ningún efecto sobre el riesgo de demencia (un estudio) ni sobre los resultados cognitivos (dos estudios).
171 Los datos observacionales repetidos se pueden utilizar para emular un ensayo objetivo sobre el uso de estatinas. Mediante el uso de datos de 6373 participantes de 55 a 80 años, un ensayo emulado identificó que el uso sostenido de estatinas, pero no el inicio de las estatinas solas, se asoció con un menor riesgo de demencia o muerte a 10 años.
172En general, existe evidencia de alta calidad, consistente y biológicamente plausible de que el colesterol LDL alto en la mediana edad es un factor de riesgo para la demencia. Las directrices de la OMS de 2019 sugirieron que el tratamiento de la dislipidemia en la mediana edad podría ofrecerse para reducir el riesgo de deterioro cognitivo y demencia, pero que la calidad de las pruebas era baja.
124 Aunque no existen ECA de estatinas a largo plazo y de alta calidad para prevenir la demencia, estos estudios serían poco éticos y poco prácticos de realizar. Los metanálisis de los estudios observacionales son heterogéneos, pero muestran un beneficio de las estatinas sobre el riesgo de demencia, posiblemente porque el beneficio depende de la edad de inicio.
Inactividad física, ejercicio y estado físico
Anteriormente concluimos que el equilibrio de la evidencia es que el vínculo entre el ejercicio y la demencia probablemente sea bidireccional.
2 La actividad física cambia a lo largo de la vida de una persona, disminuyendo cuando alguien se enferma; varía según la cultura, el nivel socioeconómico y el sexo; y puede ocurrir en diferentes niveles de intensidad, lo que lo hace complejo de estudiar. Desde la Comisión Lancet de 2020, una revisión sistemática y metanálisis de 58 estudios (n = 257 983) que exploraron el vínculo entre la actividad física y la demencia identificó que la actividad física se asoció con un menor riesgo de demencia por todas las causas (RR 0,80, IC del 95% 0,77-0,84) y enfermedad de Alzheimer (0,86, 0,80-0,93) en seguimientos cortos y largos de al menos 20 años. independientemente de la edad basal.
173 Hubo una disminución del riesgo de demencia vascular en seguimientos más cortos (0,79, 0,66-0,95) de una media de 10,9 años (DE 8,5). Se incluyeron en el metanálisis una variedad de intensidades de ejercicio, y la reducción del riesgo fue mayor cuando se pasó del sedentarismo extremo a alguna actividad física. Un estudio de cohorte (n = 1417) que registró actividad física cinco veces entre las edades de 36 y 69 años informó que ser físicamente activo a todas las edades se asoció con una mejor cognición a los 69 años que ninguna actividad física, con la asociación más fuerte para la actividad física sostenida.
174 En un estudio prospectivo de 29 826 personas a las que se les dio seguimiento durante una mediana de 24,5 años (RIC 24,1-25,0) y cuya actividad física semanal se evaluó dos veces, con 10 años de diferencia, se informó que las personas que mantenían un nivel óptimo de actividad física estimado individualmente tenían un riesgo reducido de demencia en comparación con las personas inactivas persistentemente (HR 0,75, IC del 95%: 0,58-0,97), al igual que aquellos que aumentaron su actividad física a un nivel óptimo (0,83, 0,72-0,96).
175 En un estudio longitudinal de 1718 mujeres durante una mediana de 11,9 años (rango de 0,6 a 13,5) se informó que un mayor nivel de actividad física se asoció con un menor deterioro cognitivo, pero no cuando la estimación se ajustó por diabetes e hipertensión.
176En un ECA, 945 participantes, con una edad media de 78 años (DE 2) y 450 (48%) mujeres y 495 (52%) hombres, fueron asignados aleatoriamente (2:1:1) a un grupo de control de 5 años, entrenamiento continuo de intensidad moderada dos veces por semana o entrenamiento en intervalos de alta intensidad dos veces por semana.
177 A los 5 años, 474 (96%) de los 494 participantes del grupo de control se adhirieron a la guía nacional para la actividad física, 176 (75%) participantes se adhirieron a la intervención de entrenamiento en intervalos de intensidad moderada y 164 (76%) se adhirieron a la intervención de entrenamiento en intervalos de alta intensidad. No hubo diferencias significativas en la cognición (β 0,26, IC del 95%: -0,17 a 0,69) ni en las probabilidades de DCL (OR 0,86; IC del 95%: 0,66 a 1,13) entre los grupos. Los hombres en el grupo combinado de ejercicio de intensidad moderada o alta tuvieron un menor riesgo de deterioro cognitivo leve (0,68, 0,47 a 0,99) y puntuaciones cognitivas ligeramente más altas que los participantes masculinos en el grupo de control. Los participantes que disminuyeron su consumo máximo de oxígeno, en lugar de mantener o aumentar su consumo, tuvieron mayores probabilidades de DCL (1,35, 0,98 a 1,87) en comparación con aquellos con niveles estables de consumo de oxígeno, aunque este resultado se estimó de manera imprecisa. Los hallazgos están en línea con el pequeño beneficio cognitivo mostrado en una revisión general de ECA sobre los efectos del ejercicio físico en la cognición.
178 Los resultados pueden depender no solo de la duración, sino también del tipo y la intensidad de la actividad física. A nivel de políticas, la OMS recomienda intervenciones de diseño urbano y la provisión de espacios verdes de alta calidad para reducir la inactividad física en toda la población.
179El ejercicio a cualquier edad parece ser útil para la cognición, posiblemente a través de cambios en el flujo sanguíneo y la función debido a la reducción de la hipertensión y el aumento del óxido nítrico, que culminan en una mayor plasticidad cerebral y una menor neuroinflamación.
180 Las personas que realizan ejercicio de moderado a vigoroso durante más días tienen volúmenes cerebrales relativamente más grandes que aquellos que hacen menos o ningún ejercicio.
,
182 La evidencia de modelos de ratón también sugiere que la irisina, una mioquina liberada durante el ejercicio, podría ser neuroprotectora.
Diabetes
Anteriormente discutimos la diabetes tipo 2 como un factor de riesgo en la vejez para el desarrollo de demencia. Nuevas evidencias sugieren que la edad de inicio marca la diferencia, ya que el inicio de la diabetes en la mediana edad, pero no necesariamente en la edad tardía, aumenta el riesgo de demencia. En un estudio de cohorte prospectivo de 10 095 participantes, el riesgo de demencia aumentó por cada disminución de 5 años en la edad de inicio de la diabetes tipo 2 (HR 1,24, IC 95% 1,06-1,46), hasta más de 70 años de inicio.
25 La diabetes debe clasificarse como un riesgo de demencia en la mediana edad. No está claro si la diabetes no es un factor de riesgo para la demencia en edades más avanzadas o si la ausencia de evidencia que muestre un riesgo significativo se debe a los seguimientos cortos y a los pocos estudios. La OMS concluye que la diabetes en la vejez podría tener un efecto perjudicial en la salud del cerebro y el riesgo de demencia.
124 La larga duración de la enfermedad y la diabetes mal controlada aumentan el riesgo de demencia.Nuestra comprensión del mecanismo por el cual la diabetes aumenta el riesgo de demencia es incompleta. Las complicaciones microvasculares y macrovasculares a largo plazo están bien establecidas en la diabetes, y es probable que el mecanismo causal incorpore un fuerte componente vascular, incluido el riesgo de accidente cerebrovascular.
184 La resistencia periférica a la insulina conduce a una disminución de la señalización de la insulina en el SNC, seguida de una alteración en el metabolismo cerebral. La resistencia a la insulina es un mecanismo molecular común que vincula la diabetes y la enfermedad de Alzheimer: conduce a un aumento de la toxicidad del β amiloide, hiperfosforilación de tau, estrés oxidativo y neuroinflamación.
185 El aumento de las concentraciones de marcadores inflamatorios sistémicos (p. ej., PCR) se asoció con un mayor riesgo de demencia asociado a la diabetes.
25No está claro si el tratamiento eficaz de la diabetes mejora el riesgo de demencia per se, especialmente porque tomar grandes cantidades de medicamentos orales e insulina se relaciona con una mayor gravedad de la diabetes. Sin embargo, el tratamiento estricto e intensivo en comparación con el control diabético estándar no disminuye el riesgo de demencia.
2 Algunas pruebas sugieren que las personas que toman algunos tipos de medicamentos antidiabéticos podrían tener menos riesgo de demencia. En una revisión sistemática, metanálisis y análisis de redes de 27 estudios (1 590 757 participantes), que no informaron heterogeneidad, se identificó que los estudios de cohorte indicaron que los inhibidores de SGLT2 (OR 0,41, IC del 95%: 0,22–0,76), los agonistas del receptor de GLP-1 (0,34, 0,14–0,85) y los inhibidores de DPP-4 (0,78, 0,61–0,99) se asociaron con la reducción del riesgo de demencia. mientras que las sulfonilureas se asociaron con un mayor riesgo (1,43, 1,11-1,82).
186 La metformina no se asoció con una disminución o aumento del riesgo (0,71, 0,46-1,08). Un estudio realizado en la atención primaria del Reino Unido informó un riesgo significativamente menor de demencia en 114 628 personas con diabetes que iniciaron el tratamiento con metformina que en 95 609 personas que no tomaban medicación para la diabetes (HR 0,88, IC del 95%: 0,84-0,92).
187 Un metanálisis de tres ECA y un estudio de cohorte de agonistas del receptor de GLP-1 en personas con diabetes tipo 2 identificó una tasa de demencia más baja en las personas que fueron asignadas al azar al fármaco que en las que recibieron placebo (15 820 participantes; HR 0,47, IC del 95%: 0,25-0,86) y en personas con agonistas del receptor de GLP-1 en la cohorte danesa nacional (120 054 individuos; 0,89, 0,86-0,93).
188 Otro metanálisis de estudios observacionales de 819 511 personas con diabetes tipo 2 y un seguimiento medio de 4,5 años (rango 1,3-7,2) informó hallazgos similares, con menos demencia posterior en los usuarios de inhibidores de SLGT2 (tres estudios; RR 0,62, IC 95%: 0,39–0,97; Yo
2=82,5%), agonistas del receptor GLP-1 (cuatro estudios; 0,72, 0,54–0,97; Yo
2=91,3%) e inhibidores de la DPP-4 (siete estudios; 0,84, 0,74–0,94; Yo
2=88,6%) que en las personas que no usaban estos medicamentos, pero el análisis reportó una alta heterogeneidad.
189 Es posible que las personas con diabetes no estén tomando medicamentos porque su diabetes está bien controlada sin medicamentos o porque no está bien tratada, lo que podría explicar la heterogeneidad entre los estudios. También existen pruebas de ECA sobre el efecto protector de los agonistas del receptor de GLP-1.
189 En una población taiwanesa de 31 384 parejas de personas con propensión emparejadas (incluida la compatibilidad para la enfermedad renal crónica con diabetes) que fueron seguidas durante 5 años, las personas que se adhirieron a la metformina tenían un 72% menos de riesgo de desarrollar demencia que las personas que no se adhirieron.
190 Los nuevos diseños de estudio, como la aleatorización mendeliana o la emulación de ensayos objetivo, podrían ayudar a abordar los posibles factores de confusión por indicación, en los que el nivel alto de azúcar en sangre conduce a prescripciones particulares o perjudica a las personas que no toman medicamentos.
191La pérdida de peso también podría ayudar a controlar la diabetes y, por lo tanto, también podría afectar la cognición. El estudio Look AHEAD reclutó a 3751 personas de 45 a 76 años con diabetes tipo 2 y sobrepeso u obesidad y las asignó aleatoriamente a una intervención de 10 años de aumento de ejercicio y disminución de la ingesta de calorías o apoyo y educación sobre la diabetes.
192 Este ECA se finalizó porque el análisis intermedio mostró que la intervención no tuvo ningún efecto sobre la muerte por resultados vasculares o infarto de miocardio, accidente cerebrovascular o angina grave. El resultado cognitivo se midió en el seguimiento, controlando la educación inicial, pero no la cognición. Hubo una fuerte relación inversa entre la HbA
1c concentración y cognición en ambos grupos. La función cognitiva no se relacionó con la asignación de grupos ni con la pérdida de peso. En general, un mejor control de la diabetes, pero no un nivel muy bajo de azúcar en la sangre o una pérdida de peso sin un mejor control de la diabetes, podría atenuar el riesgo de demencia y ser una forma de disminuir el riesgo de demencia.
La hipertensión y su trayectoria
Anteriormente discutimos la evidencia de que la hipertensión en la mediana edad aumenta el riesgo de demencia por todas las causas, enfermedad de Alzheimer y demencia vascular, pero que, más cerca del momento de la demencia, la presión arterial de las personas tiende a disminuir.
2 La presión arterial aumenta a lo largo de la vida en las sociedades de altos ingresos, y se evidencia que los aumentos se asocian con las circunstancias socioeconómicas. Una revisión sistemática de estudios longitudinales estimó que la presión arterial primero aumenta y luego comienza a disminuir 5 años antes del diagnóstico de demencia, y el peso disminuye alrededor de 10 años antes del diagnóstico.
193 Un metanálisis de datos de participantes individuales identificó que la presión arterial alta podría seguir siendo un riesgo en la edad avanzada.
194 Pero algunas personas que desarrollan demencia tienen una presión arterial más baja que las personas sin demencia y, por lo tanto, la evidencia es mixta. Estos metanálisis no cubrieron la variabilidad de la presión arterial, pero un estudio de cohorte (n = 2234; edad ≥65 años) midió la variabilidad de la presión arterial con evaluaciones a lo largo de 3, 6, 9 y 12 años e informó que cada aumento unitario en la variabilidad sistólica se asoció con un mayor riesgo de demencia, con HR que oscilaron entre 1,02 (IC del 95%: 1,01-1,04) y 1,10 (1,05-1,16).
195Los afroamericanos tienen presiones arteriales registradas más altas que otros grupos de EE. UU., lo que podría contribuir a un mayor riesgo de demencia que en los estadounidenses blancos. Este riesgo se consideró en un metanálisis de datos de participantes individuales de cinco estudios de cohorte de un total de 19 378 personas con una edad media de 59,8 años (DE 10,4), en los que los estadounidenses de raza negra tuvieron un deterioro cognitivo global significativamente más rápido que los estadounidenses de raza blanca, pero no se identificaron diferencias significativas después del ajuste por la presión arterial sistólica media acumulada.
196Hay tres metanálisis de ECA para la medicación antihipertensiva. Dos metanálisis identificaron que la medicación antihipertensiva protegía contra el deterioro cognitivo y la demencia.
,
197 y uno con un seguimiento corto (es decir, de 1 a 5 años) no identificó un efecto protector.
198 El metanálisis de 12 ECA (n=96 158), con un seguimiento medio de 4,1 años (rango 2,2-5,7), identificó un menor riesgo de demencia o deterioro cognitivo en las personas que tomaban fármacos antihipertensivos que en los controles, que consistían en personas que tomaban placebo, que tomaban antihipertensivos alternativos o cuya presión arterial objetivo era superior a la del grupo de intervención (OR 0,93, IC del 95%: 0,88-0,98) y de deterioro cognitivo solo (0,93, 0,88-0,99).
197 El segundo metanálisis utilizó datos de participantes individuales de cinco ECA (n = 28 008) con controles placebo, tres de los cuales se incluyeron en el primer metanálisis,
197 e identificó un menor riesgo de demencia en el grupo de tratamiento que en el grupo de control con placebo (0,87, 0,75-0,99).
12 Una revisión Cochrane, con tres estudios que coinciden con el metanálisis previo,
12 incluyeron 12 ECA (ocho ensayos controlados con placebo; n = 30 412) con intervenciones que duraron al menos 12 meses. La revisión concluyó que hubo un beneficio modesto de la medicación antihipertensiva sobre el cambio cognitivo medido con el Mini Mental State Examination (MMSE; cinco estudios; diferencia de medias 0,20; IC del 95%: 0,10–0,29), pero la duración fue demasiado corta para mostrar una diferencia en la incidencia de demencia (cuatro estudios; OR 0,89, IC 95% 0,72–1,09).
198 Un metanálisis de datos de participantes individuales de 17 estudios que incluían a personas en países de ingresos bajos y medianos (edad media de 72,5 años [DE 7,5], seguimiento de 4,3 años) identificó que las personas con hipertensión no tratada tenían un mayor riesgo de demencia que los controles sanos (HR 1,42, IC del 95%: 1,15-1,76), pero este riesgo se atenuó o se perdió con el tratamiento (1,13, 0·99–1·28).
194 Un metanálisis de cohortes de datos de participantes individuales que comprendían 31 090 adultos sin demencia al inicio del estudio, con un seguimiento de al menos 5 años, encontró que las personas con hipertensión que tomaban algún fármaco antihipertensivo tenían un menor riesgo de demencia que las que no tomaban fármacos antihipertensivos (HR 0,88, IC del 95%: 0,79-0,98). pero no identificó diferencias entre las clases de fármacos.
199 Aunque hay escasez de comparaciones directas del efecto de diferentes antihipertensivos, un análisis de redes y una revisión sistemática identificaron que los tratamientos con bloqueadores de los receptores de angiotensina 2 y bloqueadores de los canales de calcio (BCC) se asociaron con un menor riesgo de demencia que otros antihipertensivos.
200 Estudios de aleatorización mendeliana que sugieren que la hipertensión arterial es protectora
,
,
,
204 son inconsistentes con los hallazgos del ECA, y es probable que los hallazgos del estudio de aleatorización mendeliana estén influenciados por el sesgo de supervivencia.
,
,
Obesidad y peso
Anteriormente discutimos que la obesidad en la mediana edad es un factor de riesgo para la demencia.
2 Una revisión sistemática adicional y metanálisis que examinó la asociación entre la obesidad y la demencia incluyó 14 estudios con 77 890 participantes e identificó que la obesidad en la mediana edad se asoció con demencia subsiguiente por todas las causas (RR 1,31; IC del 95%: 1,02-1,68).
206 Otro estudio sobre la obesidad central, medido a través de la circunferencia de la cintura o la relación cintura-cadera, incluyó a 5 060 687 participantes de 16 estudios y mostró que la circunferencia de la cintura más grande frente a la más pequeña se asoció con un mayor riesgo de deterioro cognitivo y demencia (HR 1,10, IC del 95%: 1,05-1,15), y este riesgo fue mayor en las personas mayores de 65 años que en otras edades.
207 La obesidad es más común en personas que hacen ejercicio con poca frecuencia y se asocia con diabetes e hipertensión, que también causan enfermedades cardiovasculares.
208 Por lo tanto, esta asociación podría estar mediada por otros factores de riesgo para la demencia. No obstante, la mayoría de los estudios en estos metanálisis ajustaron las condiciones de salud, como la hipertensión, el accidente cerebrovascular, las concentraciones de lípidos en sangre y la diabetes, así como las características demográficas, lo que debería haber minimizado el efecto de estos intermediarios.Un metanálisis de estudios de intervención para la pérdida de peso identificó 13 estudios longitudinales (n = 551) y siete ECA (n = 468) de participantes con sobrepeso (es decir, IMC 25,0-29,9 kg/m
2) u obesidad (es decir, IMC ≥30,0 kg/m
2). La pérdida de peso moderada intencional de incluso 2 kg entre los participantes del ensayo se asoció con mejoras en la cognición en la mediana de seguimiento de 6 meses (rango 8-48).
209 lo que indica que los comportamientos de salud podrían tener un efecto beneficioso, incluso si la pérdida de peso no es suficiente para alterar el estado de obesidad. Estas mejoras fueron más pronunciadas en las personas que cambiaron su dieta o que hicieron ejercicio para perder peso que en las personas que se sometieron a una cirugía bariátrica.
210Además, el estigma en las personas con un IMC alto se asocia con un aumento de las concentraciones de cortisol, inflamación y consecuencias negativas para la salud, lo que a su vez podría contribuir a la asociación con la demencia.
211 Se necesita más trabajo para comprender los mecanismos por los cuales la adiposidad contribuye al riesgo de demencia.Una revisión sistemática de 19 estudios prospectivos, en los que se agruparon los datos, también identificó un mayor riesgo de demencia en personas con bajo peso (es decir, IMC <18,5; HR 1,26, IC 95% 1,20-1,31).
212 Un metaanálisis de datos de participantes individuales de 1,3 millones de personas en 39 estudios de cohorte prospectivos encontró que la obesidad era un factor de riesgo para la demencia en cohortes en las que la medición inicial se tomó más de 15 años antes del inicio de la demencia, pero parecía ser protectora si la medición inicial se tomó menos de 10 años antes del inicio de la demencia.
14 Los autores sugirieron que este resultado se debía a la causalidad inversa, porque las personas a menudo pierden peso antes de desarrollar demencia. El bajo peso también puede estar relacionado con la desnutrición, aunque el bajo peso puede ocurrir por muchas razones.
Consumo excesivo de alcohol
En la Comisión de 2020, informamos que beber más de 21 unidades del Reino Unido (es decir, 12 unidades estadounidenses, 168 g) de etanol por semana en la mediana edad en comparación con el consumo más ligero (es decir, <14 unidades del Reino Unido) se asoció con un mayor riesgo de demencia (RR 1,18, IC del 95%: 1,06-1,31).
2 De manera similar, un metanálisis posterior de participantes individuales de 131 415 participantes de Francia, Reino Unido, Suecia y Finlandia encontró que, después de ajustar los factores de confusión, el consumo excesivo de alcohol (es decir, >21 unidades por semana) en la mediana edad se asoció con un mayor riesgo de demencia en comparación con el consumo más ligero (es decir, 1-21 unidades por semana; HR 1,22, IC del 95%: 1,01-1,48).
213 En línea con este hallazgo, una revisión de 28 revisiones sistemáticas concluyó que el consumo excesivo de alcohol (según lo definido por los estudios individuales) se asoció con un mayor riesgo de demencia por todas las causas y una reducción del volumen de materia gris en los estudios de imagen.
214 La pérdida de conciencia inducida por el alcohol aumentó el riesgo de demencia en personas con un consumo moderado o excesivo.
213Algunos estudios transversales de adultos mayores han reportado un riesgo similar de demencia en bebedores empedernidos de alcohol y no bebedores, pero algunas personas que se cuentan como no bebedores fueron bebedores empedernidos anteriormente.
215 Un estudio prospectivo japonés siguió a 42 870 participantes durante 14,9 años e informó que no beber (HR 1,29, IC del 95%: 1,12-1,47) y beber más de 450 g de alcohol por semana desde la mediana edad (1,34, 1,12-1,60) se asociaron con un mayor riesgo de demencia en comparación con el consumo ligero de alcohol (es decir, <75 g/semana).
216 Un metanálisis de datos de participantes individuales de 24 478 adultos mayores (edad media de 71,8 años [DE 7,5]) en 15 estudios de cohortes prospectivos informó que, durante 151 636 años-persona de seguimiento, el riesgo de demencia fue menor en pacientes ocasionales (0,78, 0,68-0,89), leves a moderados (1,3-24,9 g/día; 0,78, 0,70-0,87), y bebedores moderados a empedernidos (25,0-44,9 g/día; 0,62, 0,51-0,77) que en los no bebedores, pero no fue menor en los bebedores empedernidos (>45 g/día) que en los no bebedores (0,81, 0,61-1,08).
217 La aleatorización mendeliana también indicó un vínculo causal entre el consumo de alcohol y una edad más temprana de inicio de la enfermedad de Alzheimer y sugirió que cualquier vínculo entre no beber y la enfermedad de Alzheimer se debe al sesgo de los supervivientes.
218 Los estudios observacionales generalmente encuentran una dosis-respuesta en forma de J, de modo que no beber se asocia con un mayor riesgo de demencia en comparación con el consumo ligero. Este resultado se debe probablemente a que muchos no bebedores han tenido previamente un alto consumo de alcohol u otras enfermedades que les impiden beber, y los estudios que corrigen el alto consumo previo de alcohol han informado que no hay un exceso de mortalidad en el grupo de no bebedores.
,
219Un estudio de una cohorte nacional de Corea del Sur de 3 933 382 participantes que evaluó en serie el consumo de alcohol durante 3 años informó que los bebedores empedernidos sostenidos (es decir, ≥30 g/día o 3 unidades por día) tenían un mayor riesgo de demencia por todas las causas (HR 1,08, IC del 95% 1,03-1,12), y de reducir el consumo de alcohol de niveles excesivos a moderados (es decir, 15,0-29,9 g/día) redujeron el riesgo de demencia por todas las causas (0,92, 0,86-0,99) en comparación con el consumo excesivo de alcohol sostenido.
220 El consumo sostenido de alcohol leve (es decir, <15 g/día; 0,79, 0,77-0,81) o moderado (0,83, 0,79-0,88) o el inicio de un consumo leve de alcohol (0,93, 0,90-0,96) también se asociaron con un menor riesgo de demencia por todas las causas que el no consumo sostenido de alcohol; Sin embargo, algunos no bebedores podrían haber sido anteriormente bebedores empedernidos. En general, la reducción del consumo excesivo de alcohol o el consumo moderado de alcohol se asocia con un menor riesgo de demencia que el consumo excesivo de alcohol. Existe una falta de evidencia clara de que no beber alcohol aumenta el riesgo de demencia. La evidencia observacional de un exceso de riesgo para los no bebedores podría deberse a personas que previamente han bebido grandes cantidades, se abstuvieron en el momento en que se recopilaron los datos (y se clasificaron como no bebedores) y luego podrían volver a beber.
Aislamiento social
Anteriormente hemos hablado del aislamiento social o del contacto social poco frecuente como factor de riesgo para la demencia.
2 Desde entonces, dos revisiones sistemáticas informaron que un contacto social menos frecuente se asoció con un mayor riesgo de demencia. La primera revisión, que incluyó ocho estudios con un total de 15 762 participantes, informó un mayor riesgo de demencia (RR 1,57; IC del 95%: 1,32-1,85) para las personas con contacto social menos frecuente que para las personas con contacto social más frecuente, con el contacto social dicotomizado como menor o más frecuente dentro de los estudios individuales y la cantidad de contacto variando entre los diferentes estudios.
221 La segunda revisión (que incluyó un estudio que se incluyó en la revisión anterior) informó un aumento menor del riesgo (1,18, 1,08–1,30).
222 La duración del seguimiento podría explicar en parte los resultados inconsistentes de estos estudios; Por ejemplo, siete de los ocho estudios de una de las revisiones tuvieron menos de 4 años de seguimiento, lo que hace probable la causalidad inversa.
221 Sin embargo, dos estudios posteriores de participantes del Biobanco del Reino Unido, con un seguimiento medio de 8,8 años
223 y 12 años (DE 1,7),
224 encontró que el riesgo de demencia era mayor en las personas que estaban más aisladas socialmente (es decir, definidas como que cumplían con al menos dos de tres criterios de: vivir solas, ver a la familia o amigos menos de una vez al mes y no participar en actividades grupales semanales) al inicio que las personas menos aisladas socialmente (es decir, personas que no cumplían con estos criterios).La soledad está vinculada al aislamiento social, pero difiere de él, porque se trata de los sentimientos de las personas de que su contacto social es inadecuado.
225 La soledad también se asoció con un mayor riesgo de demencia en tres revisiones que comprendieron de tres a ocho estudios (RR 1,26, 1,14-1,40; 1,38, 0,98-1,94; y 1,58, 1,19-2,09).
221 En estudios posteriores se informó de un aumento del riesgo de demencia del 34-91% en estudios posteriores, en Estados Unidos durante 10 años, en los Países Bajos y Suecia durante 14 años, y en Japón durante 5 años.
,
,
,
,
230 Algunos de estos estudios, pero no todos, encontraron que la asociación persistía después del ajuste por posibles factores de confusión, incluido el contacto social poco frecuente (figura 7).

La participación en actividades sociales también está vinculada, pero es distinta del aislamiento social, y se ha asociado con un menor riesgo de demencia. Dos estudios con medición seriada de la actividad social informaron que la disminución de la participación en actividades sociales se asoció con un mayor riesgo de demencia a corto plazo, pero no con un seguimiento a largo plazo.
,
236 Este hallazgo sugiere que el vínculo con la participación podría deberse, al menos en parte, a la causalidad inversa, en la que el declive se produce durante la fase preclínica de la demencia.
224El contacto social, en cualquiera de sus formas, tiene un efecto potencialmente beneficioso sobre el riesgo de demencia al aumentar la reserva cognitiva, promover comportamientos saludables y reducir el estrés y la inflamación.
225 Se informó que el riesgo era consistente en individuos con diferentes puntuaciones de riesgo poligénico para la enfermedad de Alzheimer.
223 Y el aislamiento social se relacionó con un menor volumen de materia gris en las regiones temporal, frontal y otras regiones del cerebro que para las personas que no estaban socialmente aisladas.
225Las intervenciones para aumentar el contacto social y la participación en actividades a través de actividades grupales dirigidas por facilitadores han arrojado resultados inconsistentes sobre la función cognitiva general. Un ECA finlandés de una intervención de 3 meses con un resultado primario de cognición reclutó a 235 personas de 75 años o más que se sentían solas y mostró una pequeña mejora significativa en el rendimiento en la Escala de Evaluación de la Enfermedad de Alzheimer-Subescala Cognitiva (diferencia de medias en el cambio de –2,6 puntos por 100 puntos),
237 pero estudios de EE.UU.
238 y China
239 no demostraron que las actividades grupales dirigidas por facilitadores fueran beneficiosas. Los estudios de intervenciones multidominio que incluyeron componentes grupales sugirieron pequeños beneficios cognitivos (d 0,13 de Cohen;
240 diferencia media del MMSE de 0,99 puntos) para intervenciones muy intensivas. Un ECA piloto posterior de una intervención multidominio, que incluyó actividades sociales a través de reuniones grupales y actividades sociales mensuales programadas adicionales, condujo a una mejoría cognitiva general a las 24 semanas a pesar de los números pequeños (diferencia entre grupos de 6,2 puntos en la puntuación de la Batería Repetible para la Evaluación del Estado Neuropsicológico; p = 0,004).
241 La contribución del componente social de la intervención multidominio no está clara. Los estudios existentes son demasiado pequeños y el seguimiento es demasiado corto para identificar si estos componentes sociales de las intervenciones multidominio tienen algún efecto sobre la incidencia de la demencia.
Contaminación atmosférica
La exposición a partículas en entornos domésticos y externos es ahora motivo de gran preocupación e interés. La exposición es de por vida y puede contribuir a muchas afecciones a largo plazo a lo largo del curso de la vida. En la Comisión Lancet de 2020, informamos de un acuerdo en que la contaminación atmosférica por partículas, PM
2·5 (partículas finas con un diámetro ≤2,5 μm), y PM
10 (partículas con un diámetro ≤10 μm) fueron factores de riesgo para la demencia y el deterioro cognitivo, a pesar de la heterogeneidad sustancial entre los estudios en cuanto a la duración de la exposición, las covariables en el análisis, los resultados y el riesgo de sesgo.
2 El interés continuo de la investigación se refleja en la publicación de al menos nueve revisiones sistemáticas y metaanálisis adicionales desde 2019, que han informado de que la contaminación del aire se asocia con un mayor riesgo de demencia. Para manejar la heterogeneidad de los estudios, algunos metanálisis han reducido los criterios de inclusión (p. ej., una revisión analizó solo estudios que proporcionaron CRI, que comprendió 20 estudios con 91 391 296 pacientes y informó un CRI de 1,03 (IC del 95%: 1,02-1,05) por 1 μg/m
3 incremento en PM
2·5.
242 En una estimación conservadora agrupada, obtenida de un metanálisis de cinco estudios que utilizaron la determinación activa de casos de estudios de alta calidad, se informó un CRI de 1,17 (0,96–1,43) por 2 μg/m
3 incremento en PM
2·5, aunque los IC eran amplios e incluían el valor nulo.
243 Se informaron CRI agrupados de cinco estudios de dióxido de nitrógeno (1,02 [0,98–1,06] por 10 μg/m
3) y óxidos de nitrógeno (1,05 [0,98–1,13] por 10 μg/m
3) y cuatro estudios de ozono (1,00 [0,98–1,05] por 5 μg/m
3), ninguna de las cuales fue significativa. Otros contaminantes han sido evaluados por muy pocos estudios para el metanálisis.
243Tanto en los países de ingresos bajos como en los de ingresos bajos y medianos, donde la contaminación atmosférica suele ser alta y va en aumento, las partículas
2·5 y PM
10 Las concentraciones se han asociado con la demencia, el deterioro cognitivo leve y la enfermedad de Alzheimer.
,
,
,
247 La contaminación del aire ambiental (es decir, exterior) y doméstica (es decir, interior) puede tener riesgos distintos o sinérgicos. Los estudios en países de ingresos bajos y medianos han demostrado que, en comparación con los combustibles limpios, el uso de combustibles sólidos, un indicador de la contaminación del aire en el hogar, se asocia con un mayor riesgo de demencia y un deterioro cognitivo acelerado entre los adultos de mediana edad y mayores (es decir, de > a 50 años).
,
249 Las estufas residenciales de leña y carbón son una fuente de contaminación del aire interior y se informa que contribuyen con el 38% de la PM del Reino Unido
2·5 emisiones y riesgos para la salud asociados.
250Un estudio de cohorte de 7 años de duración en Estados Unidos con más de 18 millones de participantes informó que el PM
2·5 El componente con mayor asociación con el riesgo de demencia fue el carbono negro (HR 1,12 [IC del 95%: 1,11-1,14] por 1 μg/m
3 incremento).
251 Los estudios se han realizado principalmente en adultos mayores al inicio del estudio, pero este factor no descarta un efecto más temprano en la vida.En un estudio longitudinal con una media de seguimiento de 6 años en 2927 residentes suecos (1845 [63%] mujeres y 1082 [37%] hombres que no tenían demencia al inicio del estudio; edad media basal de 74 años [DE 10,7]) se consideró la MP
2·5 y óxido de nitrógeno anualmente desde 1990 para examinar si las enfermedades cardiovasculares (es decir, fibrilación auricular, cardiopatía isquémica, insuficiencia cardíaca y accidente cerebrovascular) modificaban o mediaban la asociación entre la contaminación y la demencia e informaron que lo hacían.
252 El efecto de la contaminación del aire es peor entre las personas con estas condiciones preexistentes.Existe evidencia emergente sobre los efectos potenciales de la mejora de la calidad del aire en el deterioro cognitivo y la incidencia de demencia. Un estudio de cohorte francés con un seguimiento de 12 años informó que una dosis de 12,2 μg/m
3 reducción de la mediana de las partículas
2·5 entre 1990 y 2000 se asoció con un menor riesgo de demencia (HR 0,85, IC 95% 0,76-0,95).
253 Mayor mejora de la calidad del aire (reducción de PM
2·5 y NO
2 más de 10 años) se asoció con un menor riesgo de demencia en las mujeres mayores de EE. UU.
254 En un estudio cuasiexperimental, el Plan de Acción para la Prevención y el Control de la Contaminación del Aire de China mitigó el deterioro cognitivo en los adultos mayores, lo que indica que las estrictas políticas de aire limpio podrían reducir el riesgo de envejecimiento cognitivo (medido por el MMSE) asociado con la contaminación del aire.
255 Una diferencia en las políticas de calefacción central de China entre el norte y el sur condujo a diferencias en las concentraciones de contaminación del aire y una mayor contaminación del aire (es decir, PM
10NO
2ASÍ QUE
2, CO y O
3) en la muestra del norte se asoció con un riesgo de demencia un 42,4% mayor que en la muestra del sur.
256A medida que crece la base de evidencia, sería valioso estandarizar el diseño de los estudios, los informes y los análisis para permitir comparaciones y lograr una comprensión granular de la asociación entre la contaminación del aire y la demencia.
257 Dado el estrecho vínculo entre las circunstancias socioeconómicas, las condiciones del hogar y la exposición a la contaminación atmosférica, es difícil minimizar los factores de confusión residuales en estos estudios.En general, existe un apoyo cada vez mayor a la aplicación de las directrices mundiales de la OMS sobre la calidad del aire que, en última instancia, tienen como objetivo la media anual de PM
2·5 Concentraciones inferiores a 5 μg/m
3.
258 No está claro si existe una concentración segura de contaminación atmosférica, ya que cada 1 μg/m
3 aumento de las partículas en calorías
2·5 se asocia con un mayor riesgo de demencia.
259 El PM anual más bajo
2·5 La concentración en las megalópolis del mundo fue de 6,7 μg/m
3 en Miami, FL, EE. UU., y las cinco ciudades más contaminadas tenían concentraciones medias anuales de PM
2·5 entre 89 μg/m
3 y 149 μg/m
3.
259 Se sabe poco sobre el riesgo en relación con los subtipos de demencia y si los componentes individuales de las partículas son importantes (p. ej., carbono negro, sulfatos, nitratos y amonio).
Pérdida visual no tratada
Se estima que la prevalencia mundial de la pérdida de visión evitable y la ceguera, incluidos los problemas visuales comunes para los que se prescriben gafas, en adultos de 50 años o más es del 12,6%, con una prevalencia mucho mayor en los países de ingresos bajos y medianos que en los países de ingresos altos.
260 Esta prevalencia es distinta de la ceguera cortical que se observa en personas con atrofia cortical posterior, que generalmente se debe a la enfermedad de Alzheimer, pero a menudo se diagnostica erróneamente como enfermedad ocular.
261 Nuestra Comisión no ha considerado previamente la pérdida de visión como un factor de riesgo para la demencia, pero han surgido nuevas pruebas considerables. Esta evidencia incluye un metanálisis de 14 estudios de cohorte prospectivos, con un seguimiento de 3,7 a 14,5 años, que incluyó a 6 204 827 adultos mayores que estaban cognitivamente intactos al inicio del estudio, de los cuales 171 888 desarrollaron demencia.
262 La pérdida de visión se asoció con un RR combinado para la demencia de 1,47 (IC del 95%: 1,36-1,60; Figura 8). En un metanálisis adjunto de 12 estudios de cohorte prospectivos con 45 313 participantes, 13 350 desarrollaron deterioro cognitivo, y el RR para la pérdida de visión y el deterioro cognitivo futuro fue de 1,35 (1,28-1,41).

Un segundo metanálisis identificó un mayor riesgo de demencia por todas las causas (RR 1,38, IC del 95%: 1,19-1,59; n=37 705) con pérdida visual.
273 Cuando se desglosó en diferentes afecciones oculares, un mayor riesgo de demencia se asoció con cataratas (tres estudios; 6659 participantes; 1312 casos; HR 1,17, IC 95%: 1,00–1,38; Yo
2=0,0%) y retinopatía diabética (cuatro estudios; 43 658 participantes; 7060 casos; 1,34, 1,11–1,61; Yo
2=63,9%), pero no con glaucoma (seis estudios; 175 357 participantes; 44 144 casos; 0,97, 0,90–1,04; Yo
2=51,5%) o degeneración macular asociada a la edad (tres estudios; 7 800 692 participantes; >2559 casos, no se pudo determinar el número exacto; 1,15, 0,88–1,50; Yo
2=91,0%).Un estudio estadounidense de 16 690 participantes investigó la inclusión de la pérdida de visión como un factor de riesgo adicional potencialmente modificable en el modelo de curso de vida basado en la Comisión Lancet de 2020 e informó que la fracción atribuible a la población (PAF) de discapacidad visual era del 1,8% en esa población.
274 Dado que la prevalencia de la pérdida de visión fue mayor en los grupos minoritarios que en el grupo blanco no hispano (9,9% de 3660 personas negras no hispanas y 11,0% de 1880 hispanos frente al 7,7% de 11 011 personas blancas no hispanas), el riesgo y el beneficio potencial podrían ser mayores en estas poblaciones.Un estudio estadounidense realizó un seguimiento de 3038 adultos mayores (es decir, de >65 años) con cataratas y cognición saludable al inicio del estudio durante más de 20 años.
275 El análisis controló la edad, la raza, el genotipo de APOE, la educación, el tabaquismo y una extensa lista de comorbilidades, e informó que las personas que se sometieron a una extracción de cataratas habían reducido significativamente el riesgo de demencia en comparación con las que no se sometieron a una extracción de cataratas (HR 0,71; IC del 95%: 0,62-0,83; 23 554 años-persona de seguimiento). Aunque un estudio del Biobanco del Reino Unido de 300.823 personas informó que las personas con cataratas tenían un mayor riesgo de demencia (1,21, 1,01-1,46), no hubo diferencias en el riesgo de demencia entre los que se sometieron a una cirugía de cataratas y los controles sanos.
276Los mecanismos detrás de estas asociaciones podrían estar relacionados con enfermedades subyacentes, como la diabetes, que es un factor de riesgo para la demencia;
2 la pérdida de visión en sí misma, como podría sugerir un posible efecto de la cirugía de cataratas; o procesos neuropatológicos compartidos tanto en la retina como en el cerebro.
277 Un estudio longitudinal de la base de datos de seguros de salud coreano de 6 029 657 personas informó que el riesgo de demencia aumentaba con la gravedad de la pérdida visual, lo que respalda la hipótesis de que la pérdida de la visión en sí misma podría ser causal o que hay un efecto dosis-respuesta a un factor causal compartido.
271 Un estudio de los vínculos entre la retinopatía diabética y la demencia identificó que la asociación entre la retinopatía y la demencia se mantuvo después de ajustar la gravedad de la diabetes medida por la glucemia a largo plazo y la función renal después de más de 5 años de retinopatía diabética.
278Cada vez hay más pruebas que respaldan la asociación entre la pérdida de visión no tratada y el riesgo de demencia y la posible modificación por el tratamiento. Por lo tanto, hemos incluido la pérdida visual como un factor de riesgo en nuestro análisis. El tratamiento de la pérdida visual es eficaz y rentable para aproximadamente el 90% de las personas; sin embargo, en todo el mundo, especialmente en los países de ingresos bajos y medianos, la pérdida visual a menudo no se trata.
,
274 Existe una clara oportunidad para la prevención de la demencia con el tratamiento de la pérdida visual.
Estudios de prevención de demencia multicomponente
Las intervenciones multidominio abordan múltiples factores de riesgo de demencia a través de cambios relacionados con la salud y el comportamiento, por lo que, en principio, son apropiadas para una afección multifactorial. Estas intervenciones varían en enfoque, desde enfoques detallados e individualizados respaldados por el establecimiento de objetivos en persona y aquellos vinculados a plataformas digitales o aplicaciones móviles hasta enfoques basados en actividades grupales. La evidencia existente es preliminar porque hay pocos estudios completos, pero hay más de 40 ensayos en curso.
279 Una revisión Cochrane de 2021 identificó nueve ECA de intervenciones multidominio para la prevención de la demencia o el deterioro cognitivo, con 18 452 participantes.
280 Hubo una certeza alta de un beneficio pequeño de una intervención multidominio sobre la cognición general (diferencia de medias de la puntuación Z compuesta 0,03; IC del 95%: 0,01 a 0,06; tres ECA; n = 4617; períodos de seguimiento de 18 a 36 meses),
,
,
282 particularmente en personas con el genotipo APOE ε4 (diferencia de medias para los portadores de 0,14, 0,04 a 0,25; diferencia de medias para los no portadores de 0,04, –0,02 a 0,10; dos ECA; n = 2043; seguimiento de 24 a 36 meses), pero el efecto sobre la incidencia de demencia tuvo IC amplios (RR 0,94; IC del 95%: 0,76 a 1,18; dos ECA; n = 7256; seguimiento de 6 a 13 años).
,
284 El ensayo previo a DIVA que abordó los factores de riesgo cardiovascular (mediana de seguimiento de 10,3 años [IQR 7,0-11,0]; participantes de 70 a 78 años al inicio del estudio) mostró resultados similares con respecto a la incidencia de demencia.
285 Más recientemente, el estudio Age Well reclutó a 1030 adultos en Alemania con puntuaciones superiores a la media en una calculadora de riesgo de demencia que incorporaba la edad, el sexo, la fecha de nacimiento, la altura y el peso, el colesterol sérico, la presión arterial sistólica y diastólica, el estado de actividad física y los años de educación. Las enfermeras instruyeron a los participantes de la intervención para que siguieran una intervención multidominio con dos visitas de seguimiento y cinco llamadas telefónicas durante 2 años.
286 La intervención incluyó la optimización de la nutrición y la medicación y la actividad física, social y cognitiva con objetivos individuales establecidos con los participantes, pero no hubo ningún efecto sobre la cognición durante 24 meses en comparación con los controles que recibieron consejos generales de salud. Los investigadores concluyeron que la intervención no fue lo suficientemente específica o intensa. El ensayo SMARRT evaluó los objetivos personalizados de reducción de riesgos (172 adultos de 70 a 89 años) durante 2 años a través de asesoramiento sanitario y enfermeras visitadoras. La intervención condujo a una mejora en la puntuación cognitiva compuesta (efecto medio del tratamiento de desviación estándar 0,14, IC del 95% 0,03-0,25), una mejora del 74% en comparación con el control de educación para la salud, que incluía información sobre la reducción del riesgo de demenita.
287Una revisión sistemática y metanálisis de intervenciones multidominio para el deterioro cognitivo leve encontró 28 ECA de intervenciones multidominio no farmacológicas que duraron hasta 1 año en adultos mayores con deterioro cognitivo leve (n = 2711) y un efecto moderado sobre la cognición global (diferencia de medias estandarizada 0,41; IC del 95%: 0,23-0,59; Yo
2=62%), con mejoras en la función ejecutiva y la memoria en comparación con un control activo de una sola intervención.
288 Los autores consideraron las razones de la heterogeneidad, entre ellas que algunos estudios tenían un poder estadístico insuficiente, pero no pudieron establecer conclusiones firmes. Una revisión sistemática más pequeña de ECA de estilo de vida en pacientes con DCL encontró solo tres ECA pequeños (n = 156) e informó un beneficio significativo para la cognición con baja heterogeneidad.
289Los estudios a menudo han reclutado participantes en función del alto riesgo cardiovascular.
281 En una revisión sistemática, se informó que el riesgo de demencia a 10 años para las personas elegibles para cuatro ensayos a gran escala de intervenciones multidominio (es decir, dos o más dominios)
,
,
,
,
290 era similar a la de aquellos que se consideraban no elegibles; Por lo tanto, es posible que los ensayos futuros deban mejorar la precisión de la identificación de las personas con mayor riesgo de demencia.
291Algunos estudios han utilizado estrategias para aumentar la eficacia y el cumplimiento de las intervenciones, como los asesores de intervención para apoyar el cambio de comportamiento, las intervenciones de autogestión personalizadas y escalables entregadas digitalmente, y las dirigidas a personas de nivel socioeconómico más bajo y a personas de ingresos bajos y medianos.
,
,
,
,
295 Estos estudios deben aclarar si los beneficios cognitivos informados en los ensayos existentes se pueden replicar o aumentar y si es probable que las intervenciones multidominio sean escalables y clínicamente significativas para prevenir la demencia. Actualmente no está claro si los beneficios cognitivos identificados son sostenibles después del cese de la intervención, si se traducen en una reducción en la incidencia de demencia o si se pueden implementar con una adherencia y efectividad similares en entornos de bajos ingresos y poblaciones de alto riesgo.Una revisión de los ensayos de intervención multidominio para la prevención de la demencia encontró que solo 26 (62%) de los 42 estudios informaron datos étnicos y, en ellos, las personas de grupos étnicos minoritarios no blancos representaron solo una pequeña proporción de los participantes.
296 La raza blanca se informó en 23 ensayos, la etnia negra o afroamericana se informó en 15 ensayos, la etnia asiática se informó en seis ensayos, las etnias indígenas americanas o nativas de Alaska se informaron en tres ensayos y las etnias nativas de Hawái o de las islas del Pacífico se informaron en un ensayo. El estudio FINGERS
240 no informaron sobre la etnia ni la incidencia de demencia, pero informaron que los efectos de la intervención sobre la función cognitiva fueron los mismos en todas las categorías socioeconómicas (aunque dentro de una cohorte bastante acomodada). Todos menos 61 (2%) de los 2700 participantes en el estudio HATICE (es decir, un enfoque basado en Internet, apoyado por un entrenador, para establecer metas) eran blancos.
282 Los resultados no se desglosaron por etnia, pero el efecto de la intervención fue mayor en las personas con el nivel educativo inicial más bajo.En general, incluso las intervenciones con efectos modestos podrían, en teoría, tener efectos preventivos sustanciales a nivel poblacional, incluso para las personas menos prósperas o en entornos de bajos ingresos. Las intervenciones para riesgos individuales y múltiples serían potencialmente rentables, pero la escalabilidad es un desafío.
,
,
,
299 y es posible que sea necesario repetir las intervenciones a intervalos para lograr beneficios sostenidos.
Cálculo del PAF total
Cálculo de PAF
Incorporamos los dos nuevos factores de riesgo, es decir, el colesterol LDL alto y la pérdida de visión no tratada, y los 12 factores de nuestro modelo anterior en nuestro modelo de demencia de curso de vida. Se utilizaron los metanálisis más grandes y recientes a nivel mundial para la prevalencia y el RR de los factores de riesgo o, si no estaban disponibles, los mejores datos. Las fuentes y justificaciones se detallan en el apéndice (pp. 2-6). Realizamos nuevos metanálisis de los RR para depresión y pérdida auditiva descritos anteriormente en este trabajo.Se utilizaron datos de los 37 000 participantes de 45 años o más del estudio HUNT, que es un estudio de salud longitudinal basado en la población entre residentes de 20 años o más en el condado de Nord-Trøndelag, Noruega.
,
,
301 para estimar las comunalidades (es decir, la agrupación de factores de riesgo) de los 14 factores de riesgo. El apéndice (pp. 5-10) muestra la fórmula del PAF, las definiciones de los factores de riesgo y los pasos, incluido el código Stata, para calcular la comunalidad y el PAF. Nuestro análisis identificó cinco componentes principales, explicando el 54% de la varianza total entre los 14 factores de riesgo, lo que indica una superposición sustancial en la prevalencia de factores de riesgo, que luego tuvimos en cuenta en nuestras estimaciones ponderadas de PAF. Estimamos que la FAP para los 14 factores de riesgo fue del 45,3%. La figura 9 muestra el modelo de curso de vida de 14 factores de riesgo potencialmente modificables para la demencia. La Tabla 1 muestra la prevalencia, la comunalidad, el RR y los PAF ponderados y no ponderados ajustados por la comunalidad para los 14 factores de riesgo de demencia potencialmente modificables.

Tabla 1RR, prevalencia y FAP para los 14 factores de riesgo de demencia potencialmente modificables
| RR para la demencia (IC 95%) | Prevalencia de factores de riesgo, % | Comunalidad, % | PAF no ponderado, % | PAF ponderado, % | PAF ponderado redondeado al número entero más cercano, % | ||
|---|---|---|---|---|---|---|---|
| Primeros años | |||||||
| Menos educación | 1·6 (1·3–2·0)302 | 23·2%303 | 0·608 | 12·2% | 4·5% | 5% | |
| Mediana edad | |||||||
| Pérdida de audición | 1·4 (1·0–1·9)* | 59·0%304 | 0·609 | 19·1% | 7·0% | 7% | |
| High LDL cholesterol | 1·3 (1·3–1·4)36 | 76·5%† | 0·469 | 18·7% | 6·9% | 7% | |
| Depression | 2·2 (1·7–3·0)* | 7·2%305 | 0·452 | 8·3% | 3·0% | 3% | |
| Traumatic brain injury | 1·7 (1·4–1·9)127 | 12·1%306 | 0·423 | 7·8% | 2·9% | 3% | |
| Inactividad física | 1·2 (1·2–1·3)173 | 27·5%307 | 0·567 | 6·4% | 2·4% | 2% | |
| Tabaquismo | 1·3 (1·2–1·4)148 | 22·3%308 | 0·650 | 6·3% | 2·3% | 2% | |
| Diabetes | 1·7 (1·6–1·8)309 | 9·3%310 | 0·493 | 6·4% | 2·3% | 2% | |
| Hipertensión | 1·2 (1·1–1·4)311 | 31·1%312 | 0·595 | 5·9% | 2·2% | 2% | |
| Obesidad | 1·3 (1·0–1·7)206 | 13·0%313 | 0·622 | 3·8% | 1·4% | 1% | |
| Consumo excesivo de alcohol | 1·2 (1·0–1·5)213 | 13·3%213 | 0·772 | 2·6% | 1·0% | 1% | |
| Últimos años de vida | |||||||
| Aislamiento social | 1·6 (1·3–1·8)221 | 24·0%314 | 0·408 | 12·6% | 4·6% | 5% | |
| Contaminación atmosférica | 1·1 (1·1–1·1)315 | 75·0%315 | 0·341 | 7·0% | 2·6% | 3% | |
| Pérdida de la visión no tratada | 1·5 (1·4–1·6)262 | 12·7%260 | 0·553 | 6·0% | 2·2% | 2% | |
| PAF general para todos los factores de riesgo | .. | .. | .. | .. | 45·3% | 45% | |
RR=riesgo relativo. PAF=fracción atribuible de población.
* Calculado por los autores en esta Comisión.
† Prevalencia derivada de 37 000 participantes de ≥45 años del estudio noruego HUNT.
Fortalezas y limitaciones
Este documento es el análisis más completo hasta la fecha del PAF para los factores de riesgo potencialmente modificables para la demencia y actualiza los cálculos anteriores con factores de riesgo recientemente incorporados con evidencia convincente y estimaciones mundiales actualizadas de los RR y la prevalencia de los factores de riesgo. Los criterios de selección siempre tienen un grado de subjetividad, que puede afectar a las conclusiones, por lo que hemos presentado las evidencias sobre las que se construyeron para ser transparentes. Hemos utilizado la mejor evidencia actual para la magnitud del riesgo, pero esta evidencia podría haber sobreestimado o subestimado el riesgo. Se utilizaron revisiones sistemáticas para los factores de riesgo elegidos, se identificaron datos para calcular la comunalidad de 14 factores de riesgo y se proporcionaron nuevos metanálisis cuando fue necesario para nuestra síntesis. Se realizaron nuevos metanálisis solo para la depresión y la pérdida de audición (ya que no hubo revisiones recientes) y, por lo tanto, es posible que se hayan pasado por alto algunas pruebas nuevas. Hemos detallado cómo llevamos a cabo estos análisis, pero no los habíamos preregistrado. Nos encontramos con un panorama esperanzador, con una estimación de que casi la mitad de todos los casos de demencia están asociados a 14 factores de riesgo potencialmente modificables.En la medida de lo posible, se utilizaron cifras mundiales de prevalencia, que incluyen cantidades desproporcionadas de datos de los países de ingresos altos, aunque se incluyeron pruebas de que la prevalencia de los factores de riesgo varía de un país a otro.
,
31 La mayor parte de la investigación mundial se realiza en países de ingresos altos, por lo que los países de ingresos bajos y medianos están infrarrepresentados debido a la escasez de datos. Hemos asumido que los factores de riesgo causan demencia y hemos incluido evidencia adicional de que la alteración de estos factores de riesgo tiene el potencial de cambiar la prevalencia de la demencia. No se incluyeron los riesgos con pruebas contradictorias y se reconoció que existen otros factores de riesgo. Es escasa la evidencia sobre cómo los factores de riesgo y protección podrían agruparse o variar dentro de las diferentes naciones y entre ellas. Los participantes en el estudio HUNT tenían una prevalencia más baja de abuso de alcohol que las cifras mundiales y vivían en un HIC con poca diversidad étnica. Además, no fue posible encontrar una estimación mundial de la prevalencia del colesterol LDL y reconocemos que el uso de una estimación de un solo estudio de cohorte no es ideal. Muchos factores de riesgo están relacionados con la privación socioeconómica; Por ejemplo, el lugar donde viven las personas está relacionado con la exposición a la contaminación del aire y la posibilidad de encontrar alimentos saludables a un precio razonable a una distancia razonable a pie y tener los recursos y las habilidades para prepararlos está relacionada con la obesidad y la diabetes. La privación socioeconómica está fuertemente ligada a la educación y su incorporación en nuestros cálculos de comunalidad reducirá los efectos individuales de considerar componentes individuales modificables. No fue posible realizar un metanálisis de los datos sobre la contaminación atmosférica, aunque los datos sugieren sistemáticamente que este factor es un riesgo para la demencia.
Tenemos evidencia adicional de que la exposición prolongada a un riesgo tiene un mayor efecto (p. ej., diabetes) y que los riesgos actúan con más fuerza en las personas vulnerables que en la población general (p. ej., contaminación del aire). Por lo tanto, es importante redoblar los esfuerzos para tratar las condiciones existentes de la mejor manera posible para todas las personas en riesgo. Sin embargo, aunque esta modificación del riesgo afecta a la población, no garantizará que ningún individuo evite la demencia. Además, es crucial pensar en las comunidades y las personas con múltiples riesgos, en las que los enfoques que van más allá del tratamiento individual o la exhortación a un cambio de comportamiento tienen un efecto potencialmente mayor a largo plazo. Se desconoce la duración o la intensidad que se requiere de una intervención para marcar la diferencia, pero se espera que el riesgo asociado con el tabaquismo pueda reducirse con el tiempo y, de hecho, una reducción en la prevalencia del tabaquismo podría ser uno de los factores asociados con la disminución de la prevalencia de demencia observada en algunas poblaciones. Aunque la asociación no es causal, el efecto sobre la cognición observado en los ECA que evaluaron las intervenciones multicomponente, la provisión de audífonos y el tratamiento de la hipertensión y los cambios naturalistas con la reducción de la contaminación del aire, el tabaquismo, el contacto social, los tratamientos auditivos y visuales, y los aumentos en la estimulación cognitiva a través del trabajo continúan sugiriendo una asociación causal con la expresión clínica de la demencia. Las personas con un nivel socioeconómico bajo, tanto en los países de ingresos bajos como en los de ingresos altos, corren un mayor riesgo que el resto de la población y deben ser una prioridad para la intervención. Existe evidencia considerable de que los cambios en el estilo de vida y las políticas para reducir los factores de riesgo son importantes para las personas, ya sea que tengan o no un mayor riesgo genético de demencia. Hemos resumido los puntos clave para enfatizar nuestras recomendaciones basadas en la literatura que hemos presentado. Aunque existen grandes lagunas en nuestra comprensión del riesgo, la acción no debe esperar, porque hay formas de reducir las posibilidades de desarrollar demencia, que benefician a las personas, las familias y la sociedad.
Enfoque de salud pública
Aunque la demencia es uno de los principales desafíos de salud pública, una visión de salud pública es un enfoque bastante novedoso para la prevención de la demencia. Los riesgos pueden conceptualizarse como algo que el individuo puede cambiar, pero un enfoque de salud pública reconoce la generación de mala salud a lo largo de la vida que se asocia con la privación socioeconómica. Los patrones socioeconómicos de enfermedades como la diabetes tipo 2 y la obesidad y comportamientos como el tabaquismo y el consumo excesivo de alcohol comienzan en los primeros años de vida.
317 Comprender la causa de las desigualdades de riesgo, como el acceso desigual a la educación, el acceso desigual a entornos saludables y seguros y las malas condiciones ocupacionales, puede obligar a cambiar las condiciones sociales para maximizar el alcance de la población, la rentabilidad y la equidad sanitaria de las intervenciones.
,
319 Dado que la salud cardiovascular y el tabaquismo median en parte la asociación entre la privación socioeconómica y la demencia,
,
,
,
322 Se espera que los enfoques a nivel poblacional a lo largo de la vida para apoyar la actividad física, no fumar y una dieta saludable y no obesogénica (que también podría afectar a la diabetes) tengan un profundo efecto en las desigualdades en la prevalencia de la demencia.Demostrar un vínculo entre los cambios en estos factores de riesgo y la posterior reducción del riesgo de demencia es difícil debido a la acumulación de riesgo de demencia a lo largo de la vida, y la larga acumulación presintomática de la patología significa que podrían ser necesarios muchos años o décadas de estudio para mostrar una diferencia. Otro enfoque consiste en utilizar los factores de riesgo (y protectores) como resultados indirectos, en los que la causalidad asumida conduce a una reducción de la prevalencia de la demencia. Otros diseños de estudio, como los estudios cuasiexperimentales, también tienen el potencial de aclarar los efectos de las iniciativas para reducir los factores de riesgo sobre el riesgo de demencia.
64 Varias intervenciones a nivel poblacional pueden adaptarse adecuadamente a los contextos culturales y económicos, lo que teóricamente podría reducir sustancialmente la prevalencia de la demencia, las desigualdades y los costos en todo el sistema. Estas intervenciones incluyen políticas fiscales, como subsidios para aumentar la asequibilidad de los alimentos saludables e impuestos para reducir la asequibilidad del alcohol, el tabaco y los alimentos poco saludables; gravámenes para fomentar la reformulación de productos; y la eliminación de las barreras financieras para la educación continua y los combustibles más limpios.
,
,
,
324 También se podrían utilizar políticas de marketing; Por ejemplo, reducir la exposición a anuncios de productos poco saludables y el uso de campañas bien diseñadas en los medios de comunicación que cambien las normas socioculturales.
,
,
,
325 Las políticas legislativas y de disponibilidad incluyen la prohibición de fumar en lugares públicos, la reducción de las horas de venta de alcohol, hacer que los alimentos saludables sean más accesibles de lo que son actualmente, la reducción de la densidad de los establecimientos de comida rápida, la creación de espacios verdes seguros y de alta calidad y la infraestructura de viajes activos, la reducción de la exposición al ruido y la provisión de equipos de protección auditiva en los lugares de trabajo, zonas de bajas emisiones para reducir la contaminación del aire y la obligatoriedad del uso del casco en los viajes y deportes activos.
,
,
323 Las adaptaciones físicas al entorno podrían hacer que el ejercicio y la socialización sean accesibles y seguros al optimizar la planificación urbana, la accesibilidad y la infraestructura, como se recomienda en la Guía Mundial de Ciudades Amigables con las Personas Mayores de la OMS.
326 Por último, las políticas de vivienda podrían utilizarse como una intervención: la provisión de viviendas adecuadas y socialmente conectadas para las personas mayores es un enfoque de varias organizaciones gubernamentales y del tercer sector, con el potencial de reducir el aislamiento social y la soledad y proporcionar redes de apoyo para las personas mayores. Las intervenciones que han demostrado tener un efecto sobre el tabaquismo, el consumo excesivo de alcohol, la obesidad, la hipertensión, la contaminación del aire y las lesiones en la cabeza se modelaron para determinar su efecto sobre la demencia, y todas ahorraron costos y mejoraron la calidad de vida.
Factores de riesgo potenciales considerados sin evidencia suficiente para incluirlos en el modelo
Sabemos que existen otros factores de riesgo potencialmente modificables y consideramos varios de estos factores, pero, en general, juzgamos que no existe suficiente evidencia consistente para cumplir con nuestro alto estándar de inclusión como factores de riesgo modificables. Estos factores de riesgo incluyen muy poco sueño, una dieta poco saludable, infecciones y afecciones de salud mental.
Dormir
Como discutimos en la Comisión Lancet de 2020, no está claro si la duración del sueño corto (es decir, generalmente definida como ≤5 h) y larga (es decir, generalmente definida como ≥10 h) se asocia con un mayor riesgo de deterioro cognitivo y demencia o si las personas que están desarrollando demencia han alterado el sueño en la etapa prodrómica.
,
,
,
330 Dos metanálisis incluyeron estudios que utilizaron varias definiciones de la duración del sueño, con una duración corta que a menudo es menor o igual a 7 h y una duración larga que es más de 8 h, y con un seguimiento de menos de 10 años hasta la demencia incidente, y sus hallazgos de una asociación en forma de U invertida entre la duración del sueño y el riesgo de demencia están sujetos a un posible sesgo de causalidad inversa.
,
331 Algunos estudios son notables debido al seguimiento a largo plazo, pero ningún estudio informó datos para las personas que desarrollaron demencia poco después de la determinación de la duración del sueño por separado de los datos para aquellos que desarrollaron demencia después de 5 a 10 años desde el momento en que se registraron las medidas del sueño.
,
,
,
,
,
,
337 La hipótesis de la causalidad inversa está respaldada por un estudio longitudinal de resonancia magnética cerebral de 3893 adultos sanos, que informó que las tasas de atrofia cerebral no se asociaron con una duración del sueño más larga (es decir, >7 h) o más corta (es decir, ≤7 h) ni con la calidad del sueño cuando se controló el IMC, el estatus socioeconómico y el estado de ánimo.
338 Sin embargo, transversalmente, la duración del sueño se asoció con el grosor cortical, y los autores sugirieron que los cerebros sanos apoyan la duración saludable del sueño.En el estudio Million Women de 830 716 mujeres (edad media de 60,0 años al inicio [DE 4,9]) con un seguimiento de 17 años, hubo un riesgo ligeramente mayor de demencia (RR 1,08, IC 95% 1,04-1,12) entre las que informaron una duración del sueño más corta pero no muy corta (es decir, <7 h) que en las personas que informaron 7-8 h de sueño.
339 En el estudio Whitehall II, la duración corta y persistente del sueño de 6 horas o menos a las edades de 50, 60 y 70 años en comparación con la duración normal persistente del sueño (es decir, 7 horas) se asoció con un aumento del 30% en el riesgo de demencia, independientemente de los factores sociodemográficos, conductuales, cardiometabólicos y de salud mental.
340 En una cohorte noruega de 7492 personas con un seguimiento de 11 años, el insomnio (que podría diferir de la corta duración del sueño) no se asoció con la demencia por todas las causas, la enfermedad de Alzheimer o la puntuación cognitiva.
300El trabajo por turnos, en el que parte del trabajo se realiza fuera de la jornada laboral normal, puede alterar el ritmo circadiano y, a su vez, aumentar el riesgo de enfermedades cardiovasculares y algunas otras enfermedades. Una revisión sistemática encontró pruebas heterogéneas del riesgo de demencia y no pudo establecer conclusiones.
341 Un estudio posterior del Biobanco del Reino Unido examinó si el trabajo por turnos podría estar relacionado con la demencia y realizó un seguimiento de 170 722 personas durante una mediana de 12,4 años, de las cuales 27 450 (16,1%) trabajaban por turnos (edad media al inicio del estudio de 52,8 años [DE 7,1] en trabajadores por turnos y 51,8 años [7,0] en trabajadores sin turnos). El trabajo por turnos se asoció con un mayor riesgo de demencia (HR 1,30, IC 95% 1,08-1,58), pero el riesgo no fue mayor en las personas que trabajaban en turnos nocturnos que en las personas que trabajaban en turnos diurnos, aunque el poder estadístico para detectar diferencias fue bajo.
342En una cohorte sueca de 28.775 individuos de 65 años o más, la asociación entre la larga duración del sueño (es decir, >9 h/noche) y la demencia durante un seguimiento de 13 años se atenuó por completo después de que se excluyeran del análisis los casos ocurridos en los primeros 5 años de seguimiento, lo que enfatiza el papel del sesgo de causalidad inversa.
336 De manera similar, en el estudio US Million Women, no hubo asociación entre la duración prolongada del sueño (es decir, >8 h) o las siestas diurnas y la demencia después de los primeros 5 años de seguimiento.
339 Un estudio de aleatorización mendeliana del Biobanco del Reino Unido informó de una pequeña asociación entre la siesta habitual y el aumento del volumen cerebral (no estandarizado β 15,80 cm
3, IC del 95%: 0,25–31,34), pero no hubo diferencias en el volumen del hipocampo ni en las pruebas cognitivas.
343Junto con la duración del sueño, la evidencia emergente sugiere que la calidad del sueño, específicamente la apnea del sueño, podría estar asociada con la demencia. Una revisión sistemática y metanálisis de 11 estudios que incluyeron 1 333 424 participantes a los que se les dio seguimiento durante un máximo de 14,9 años identificaron que las personas con apnea del sueño tenían un mayor riesgo de desarrollar demencia (HR 1,43; IC del 95%: 1,26-1,62).
344 Pocos de estos estudios se ajustaron a la obesidad. Podría valer la pena considerar la implementación de preguntas de detección sobre la demencia en personas con apnea del sueño.Se postula que los trastornos del sueño aumentan el riesgo de demencia a través de varios procesos.
328 A menudo coexisten con otras afecciones que afectan el riesgo de demencia (p. ej., diabetes, depresión y consumo de alcohol). Además, las personas con problemas de sueño podrían ser tratadas con benzodiacepinas, lo que podría estar relacionado con el deterioro cognitivo. Una revisión sistemática y metanálisis identificó pruebas de muy baja calidad de un mayor riesgo de demencia en pacientes que tomaban benzodiacepinas en 11 estudios con un seguimiento que duró 72–264 meses (OR 1,38; IC del 95%: 1,07–1,77; Yo
2=98%; n=980 860).
345 Un estudio de cohorte prospectivo informó que el riesgo era mayor en las personas que tomaban una dosis baja de benzodiacepinas en comparación con las que tomaban dosis más altas, lo que sugiere que la asociación no es causal.
346 Los estudios experimentales respaldan un efecto perjudicial de la privación aguda del sueño en el rendimiento cognitivo inmediato.
347Los mecanismos biológicos incluyen la neuroinflamación,
348 aterosclerosis
349 α-sinucleinopatías (es decir, demencia con cuerpos de Lewy y demencia con enfermedad de Parkinson),
350 y alteración de la eliminación de β de amiloide porque se reduce la duración del sueño.
351 Sin embargo, la eliminación de la β amiloide generalmente ocurre durante el sueño profundo al comienzo de la noche, que dura de 1 a 2 horas, por lo que es poco probable que se vea afectado en aquellos que informan trastornos del sueño.
,
,
354 La acumulación de placa amiloide contribuye a la falta de sueño en los adultos mayores a través de sus efectos directos sobre las regiones cerebrales reguladoras del sueño y la vigilia.
,
356 También existe cierta evidencia de una asociación de la acumulación de β amiloide con la interrupción del ritmo circadiano y el patrón de sueño en adultos cognitivamente sanos.
Desde la Comisión Lancet de 2020, nuevas pruebas han indicado que el sueño prolongado no es un factor de riesgo para la demencia, aunque la demencia y su pródromo podrían causar un sueño prolongado. Las personas no deben reducir su sueño para reducir el riesgo de demencia. Las benzodiazepinas no parecen causar demencia.
En general, la evidencia parece indicar que la corta duración del sueño podría estar asociada con un pequeño mayor riesgo de demencia, pero la evidencia sobre la caracterización del sueño corto es escasa, y no existe información sobre la calidad del sueño o la alteración del ritmo circadiano, que podrían ser los factores asociados con un mayor riesgo de desarrollar demencia en lugar de la duración del sueño. Por lo tanto, la evidencia sobre el sueño corto aún no se ha aclarado lo suficiente como para estar seguros de la causalidad. No podemos hacer recomendaciones sobre el sueño como factor de riesgo.
Dieta
Como hemos comentado anteriormente, la nutrición y los componentes individuales de la dieta son difíciles de investigar, y los hallazgos son contradictorios en cuanto a su relación con la cognición y la demencia.
2 Una dieta abarca múltiples tipos de alimentos y bebidas saludables y no saludables y, a menudo, es parte de una forma de vida, por lo que los efectos observados pueden estar relacionados con el estilo de vida o ser independientes de él.
358 La disponibilidad de alimentos y bebidas que componen la dieta mediterránea y dietas similares tiende a ser menor en los países de ingresos bajos y medianos que en los países de ingresos altos.Las dietas similares a la dieta mediterránea incluyen la dieta de Enfoques Dietéticos para Detener la Hipertensión (DASH) y la dieta Mediterránea-DASH de Intervención para el Retraso Neurodegenerativo (MIND), que es la dieta mediterránea más alimentos saludables específicos. En 2019, la OMS hizo una recomendación condicional de la dieta mediterránea para reducir el riesgo de demencia, lo que significa que no estaban seguros del equilibrio de la evidencia entre los efectos deseables e indeseables.
124 Desde entonces, ha habido varios estudios nuevos. Una revisión sistemática y metanálisis identificó 16 estudios de cohortes con un seguimiento que osciló entre 2,2 y 41 años.
359 La alta calidad de la dieta en relación con la baja calidad de la dieta se asoció con un menor riesgo de demencia (RR 0,82; IC del 95%: 0,70-0,95; n = 66 930; 12 estudios). Este riesgo fue similar cuando solo se incluyeron los estudios que tuvieron seguimiento durante más de 10 años (0,78, 0,62–0,99; seis estudios) o cuando se limitó al resultado de la enfermedad de Alzheimer (0,61, 0,47–0,79; seis estudios). Por el contrario, los estudios que utilizaron una puntuación continua de la dieta mediterránea no identificaron una asociación significativa entre la adherencia a la dieta mediterránea y el riesgo de demencia. Un metanálisis posterior más grande de tres estudios de cohorte con 224 049 participantes identificó que una mayor adherencia a la puntuación de la dieta MIND se asoció con un menor riesgo de demencia (HR 0,83 [IC 95%: 0,72–0,95] por cada incremento de 3 puntos; Yo
2=0%).
360 Una tercera revisión sistemática informó un efecto protector de la dieta mediterránea contra el deterioro cognitivo global en diez de 21 estudios, contra la demencia incidente en tres de ocho estudios y contra la enfermedad de Alzheimer en dos de cuatro estudios.
361Desde estas revisiones, un estudio de cohorte prospectivo sueco de 28 025 personas en la mediana edad (es decir, edad media en la primera evaluación de 58,1 años [DE 7,6], mediana de seguimiento de 19,8 años [IQR 4,8]) informó que ni la adherencia a las recomendaciones dietéticas ni a la dieta mediterránea modificada (es decir, una dieta basada en la dieta mediterránea tradicional pero ajustada, por ejemplo, para cumplir con las variaciones culturales) disminuyó el riesgo de demencia, enfermedad de Alzheimer o demencia vascular, o patología de la enfermedad de Alzheimer.
362 Estos resultados no cambiaron cuando se excluyeron las personas que desarrollaron demencia en los 5 años posteriores al inicio del estudio. Por el contrario, un estudio del Biobanco del Reino Unido (n = 60 298; edad media al inicio del estudio de 63,8 años [2,7], seguimiento medio de 9,1 años [1,7]) informó que una mayor adherencia a la dieta mediterránea se asoció con un menor riesgo de demencia en comparación con una menor adherencia, independientemente del estado de APOE.
363 Un estudio de cohorte estadounidense de personas mayores (n = 581, edad media en la primera evaluación de 84,2 años [5,8]) informó que los patrones dietéticos MIND y mediterráneos, en particular el consumo de verduras de hoja verde, se correlacionaban inversamente con la carga de β amiloide, los ovillos de tau fosforilados y la patología global de la enfermedad de Alzheimer en la autopsia.
364Los alimentos ultraprocesados son formulaciones de sustancias alimentarias procesadas (es decir, aceites, grasas, azúcares, almidón y aislados de proteínas) que contienen poco o nada de alimentos integrales. Las clasificaciones de los alimentos varían porque la definición es vaga. Un estudio transversal de EE. UU. de 3632 participantes de 60 años o más informó que el rendimiento cognitivo general y la memoria no se asociaron con el porcentaje de ingesta diaria de energía dietética de alimentos ultraprocesados después de la corrección de los factores de confusión.
365 A longitudinal study from Brazil (n=10 775; mean age at baseline of 51·6 years [SD 8·9]; median follow-up of 8 years [range 6–10]) reported a 28% faster rate of global cognitive decline (β –0·004, 95% CI –0·006 to –0·001) and a 25% faster rate of executive function decline (β –0·003, –0·005 to 0·000) in individuals whose ultraprocessed food consumption was in the highest three quartiles than in those in the lowest quartile after adjustment for relevant sociodemographic and clinical variables.
366 These studies are not long enough to rule out reverse causation bias.A French study (n=1279; mean age at baseline of 74·3 years [SD 4·9]; follow-up of 17 years) reported that increased concentrations of omega-3 index in plasma were associated with a decreased risk of dementia (HR 0·87 [95% CI 0·76–0·98] for 1 SD) and less decline in medial temporal lobe volume.
367The gut microbiome encompasses all microbes in the gut. Changes in the gut microbiome occur as people age or as a result of obesity, diet, infection, cardiovascular disease, sleep issues, or little physical activity. Changes in the microbiome might mediate the effects of diet on the brain,
358 facilitate neuroinflammation and cell death, and be a risk factor for dementia.
368 Few studies have examined the associations of the gut microbiome with dementia, and we cannot draw any conclusions.
Dietary interventions
Designing dietary interventions is difficult because the correct doses, forms, timing in life, and duration are unclear.
358 The caveats in long-term RCTs outlined previously in this paper in terms of practicality, ethics, and bias are particularly salient here. The Commission previously identified convincing evidence that vitamins did not prevent cognitive deterioration in the general population, as did WHO.
,
124 Since then, further studies have not produced convincing benefit.Un ECA de 3 años de una intervención educativa dietética, es decir, asesoramiento dietético y dieta MIND o dieta moderada con control de calorías, en 604 personas mayores sin deterioro cognitivo pero con antecedentes familiares positivos de demencia, un IMC superior a 25 y una dieta subóptima, no informó diferencias entre los grupos en la cognición global y un resultado secundario de una resonancia magnética cerebral.
369 Ambos grupos mejoraron en la puntuación cognitiva, tuvieron una pérdida de peso similar de alrededor de 5 kg y tuvieron resultados similares en las resonancias magnéticas.COSMOS-MIND fue un ECA de 3 años, anidado en el ECA cardiovascular COSMOS en 2262 participantes voluntarios (edad media de 72,97 años [DE 5,63]). El ensayo probó por separado el extracto de cacao diario, que contenía flavanoles de cacao (es decir, análisis primario) y mineral multivitamínico.
370 El extracto de cacao (más o menos mineral multivitamínico) no tuvo ningún efecto sobre la cognición global, mientras que la suplementación con minerales multivitamínicos por sí sola condujo a un beneficio cognitivo global pequeño, no clínico sino estadísticamente significativo (puntuación Z media 0,07, IC 95% 0,02-0,12) en la memoria y la función ejecutiva. Los autores sugirieron que los beneficios cognitivos observados de la suplementación con minerales multivitamínicos podrían ser más pronunciados entre los adultos mayores con enfermedad cardiovascular que entre los que no la tienen, y que se deben realizar más estudios en una cohorte más diversa.COSMOS-WEB fue un subconjunto de COSMOS que se superpuso sustancialmente con COSMOS-MIND, pero examinó solo a las personas que fueron asignadas aleatoriamente para recibir extracto de cacao que contenía flavonoides de cacao o placebo, e informó que la intervención con extracto de cacao no mejoró la memoria durante 1 a 3 años.
371 Un ECA de 24 semanas de antocianinas (es decir, un flavonoide que se encuentra en las bayas y la fruta que se cree que es antiinflamatorio, antioxidante y mejora el perfil lipídico) en 206 personas de 60 a 80 años sin demencia no mostró diferencias en los resultados cognitivos.
372 Los autores sugirieron que esta ausencia de efecto podría deberse a una potencia y duración insuficientes, ya que había una diferencia entre los grupos en las pendientes del deterioro cognitivo.
Decisiones
En conclusión, los estudios de epidemiología nutricional a menudo, pero de manera inconsistente, informan una asociación entre la dieta y los biomarcadores, el deterioro cognitivo, la demencia o la enfermedad de Alzheimer. Los estudios son de pocas dietas y se centran principalmente en las de los países de ingresos altos, que consisten en dietas mediterráneas o similares, que son ricas en verduras, frutos secos, bayas, judías, mariscos y cereales integrales. En general, los ensayos clínicos han informado que las intervenciones nutricionales y dietéticas no reducen el deterioro cognitivo. Los resultados de la intervención son pequeños, heterogéneos, generalmente no significativos, y podrían considerarse generadores de hipótesis en el mejor de los casos, pero no apoyan las hipótesis primarias. Los resultados positivos en algunos subgrupos indican que la investigación futura podría ser útil y que podrían ser necesarias intervenciones a largo plazo para mostrar un efecto.
Comer una dieta alta en frutas y verduras y baja en alimentos ultraprocesados es buena para muchas condiciones de salud y afecta los factores de riesgo de demencia de obesidad, diabetes e hipertensión, pero no existe evidencia suficiente para decir que esta dieta es directamente útil para la prevención de la demencia. Los datos sobre el efecto de la malnutrición en los primeros años de vida también son escasos.
Infecciones e inflamación sistémica
En un metanálisis de datos de participantes individuales, las infecciones sistémicas periféricas graves que requirieron ingreso hospitalario se relacionaron con un mayor riesgo de demencia, y las asociaciones persistieron después del ajuste por edad, sexo, estatus socioeconómico, comportamientos de salud, IMC, hipertensión, diabetes y genotipo APOE (HR 1,22, IC 95% 1,09-1,36).
373 Este resultado podría explicarse en parte por un menor volumen cerebral y una menor integridad de la sustancia blanca, lo que indica vulnerabilidad cerebral, en las personas que ingresan en el hospital con infección en comparación con los controles de la misma edad que no están hospitalizados.
,
375 Un estudio posterior de registro electrónico de casi 1 millón de adultos del Reino Unido mostró que las personas con infecciones que resultaron en ingreso hospitalario, pero no las tratadas en atención primaria, tenían un mayor riesgo de demencia o enfermedad de Alzheimer que aquellas sin infección.
376 Varios virus y bacterias se asociaron con el riesgo de demencia, y el riesgo fue mayor no solo en las personas con infecciones del SNC, sino también en las personas con infección fuera del SNC en comparación con las personas sin infección u otros tipos de infección.
,
,
378 En el Estudio Longitudinal del Envejecimiento de Baltimore (n = 1009), se observó atrofia acelerada de la sustancia blanca entre individuos con antecedentes de infecciones herpéticas sintomáticas;
379 Sin embargo, otro estudio no informó ninguna asociación entre la infección por herpes simple y el deterioro cognitivo o la atrofia cerebral.
380La sepsis, la neumonía, las infecciones del tracto respiratorio inferior, las infecciones de la piel y los tejidos blandos y las infecciones del tracto urinario se asocian con mayores tasas de demencia en estudios con humanos y animales.
376 De manera similar, el aumento de las concentraciones de marcadores inflamatorios periféricos está relacionado con un mayor riesgo de demencia: un metanálisis de diez estudios, con un seguimiento que osciló entre 2 y 25 años, informó que las personas con el cuartil más alto de concentraciones de PCR tenían un mayor riesgo de demencia que las personas con el cuartil más bajo (HR 1,34, IC 95% 1,05-1,71), con resultados similares para la IL-6 en cuatro estudios (1,40, 1,13-1,74) y la ACT en tres estudios (1,54, 1,14-2,08) pero no para la PAF acetilhidrolasa (1,06, 0,94-1,18).
381 El aumento de las concentraciones de marcadores inflamatorios también se asocia con un mayor deterioro cognitivo.
382Existe poca evidencia longitudinal sobre los efectos a largo plazo de la COVID-19, y la evidencia en esta área se refiere al efecto de la COVID-19 en la función cognitiva y los biomarcadores, no en el riesgo de demencia. La COVID-19 podría aumentar el riesgo de deterioro cognitivo, con un metanálisis que identificó un ligero deterioro en la cognición global 7 meses después de la infección por COVID-19 que en controles adultos sanos sin antecedentes conocidos de deterioro cognitivo (diferencia de medias en la puntuación de la Evaluación Cognitiva de Montreal: -0,94; IC del 95%: -1,59 a -0,29).
383 Además, se han reportado disminuciones en el grosor de la materia gris y el tamaño total del cerebro 6 meses después de la infección por SARS-CoV-2 en 785 participantes del Biobanco del Reino Unido en comparación con personas que no habían tenido SARS-CoV-2.
384 La COVID-19 también podría haber aumentado los riesgos de demencia al cambiar los hábitos de la población; por ejemplo, los estudios mostraron que la infección por COVID-19 y las últimas etapas de la pandemia se asociaron con una disminución del ejercicio y un mayor riesgo de obesidad que la ausencia de infección o las etapas anteriores de la pandemia.
Mecanismos de los efectos de la infección y la inflamación
Los mecanismos por los cuales las infecciones podrían contribuir a un mayor riesgo de demencia son poco conocidos y es probable que sean bidireccionales, ya que las personas con deterioro cognitivo y demencia se ven más gravemente afectadas por la infección y tienen más probabilidades de ser ingresadas en el hospital que las personas sin demencia. Aunque la barrera hematoencefálica protege el cerebro, existen múltiples mecanismos para la comunicación inmunitaria periférica y central, incluidas las vías directas de infiltración de células inmunitarias periféricas a través de la barrera hematoencefálica y las vías indirectas de modulación de la función microglial del SNC impulsada por la inflamación.
,
387 Animal and in-vitro studies show that inflammatory stimuli might initiate long-term priming of the microglia and peripheral CD4 and CD8 T cells to a proinflammatory state,
++
,
,
390 potentially increasing amyloid plaque deposition.
391 Long-term immune activation and systemic inflammation can also adversely affect brain capillaries, increasing the permeability of the blood–brain barrier and related entry of neurotoxic plasma components, blood cells, and pathogens into the brain.
,
393As hospital-treated infections are more strongly associated with vascular dementia than with Alzheimer’s disease, mechanisms might involve vascular inflammatory pathways.
,
376 Dysfunction of the blood–brain barrier has been linked to microbleeds and perivascular oedema, compromising microcirculation and inducing ischaemic damage.
394 Furthermore, infections and related systemic inflammation can trigger macrovascular events, including stroke, further increasing dementia risk.
Interventions with vaccines, anti-inflammatory, or antibiotic drugs
Meta-analyses of observational studies suggest that vaccinations against rabies, tetanus, diphtheria, pertussis, herpes zoster, influenza, hepatitis A, typhoid, and hepatitis B are associated with decreased dementia risk, although this association might be partly due to confounding factors because people who receive vaccinations might have different health behaviours and better access to health care compared with those who do not receive vaccinations.
395 One population cohort study using UK general practice records of 13 383 431 adults older than 50 years reported no effect of vaccines on the risk of dementia when adjusted for potential confounders.
396One systematic review and meta-analysis concluded that there was no strong evidence from large RCTs that interventions using non-steroidal anti-inflammatory drugs to modify infection and inflammation result in a reduction in cognitive impairment or risk of dementia progression.
397 Non-steroidal anti-inflammatory drugs for Alzheimer’s disease, such as naproxen and celecoxib for 1–3 years or aspirin 100 mg for 9·6 years in older adults (ie, aged ≥70 years) with a first-degree relative with Alzheimer’s disease, did not decrease dementia risk,
398 and these drugs also increased adverse events.
399 Minocycline, a tetracycline antibiotic that protects against the toxic effects of amyloid β in vitro and in animal models of Alzheimer’s disease, did not delay the progression of cognitive impairment in people with mild Alzheimer’s disease over a 2-year period in a multicentre clinical trial.
Interventions that help to avoid infection, such as vaccinations, hand washing, and ventilation, and therefore reduce risk or severity of inflammation and vascular events are good for general health but their effects on dementia risk are unclear.
Dental disease
La enfermedad dental, incluida la inflamación de las encías (es decir, la enfermedad periodontal), se asocia con trastornos crónicos impulsados por la inflamación y podría ser un factor de riesgo para la demencia.
401 Las personas con una mejor función cognitiva infantil tienen una mejor salud dental y, a lo largo de la vida, utilizan más cuidados dentales preventivos y pierden menos dientes que sus contrapartes, lo que precede a los posibles mecanismos de nutrición comprometida, periodontitis crónica e inflamación relacionada con la enfermedad dental por muchas décadas.
402Un estudio sueco a nivel nacional que controló los factores demográficos, los factores socioeconómicos y otras condiciones de salud de las personas de 40 a 80 años no identificó una mayor incidencia de demencia en 7992 individuos con caries y enfermedad periodontal que en 29 182 controles emparejados durante 7,6 años.
403 Un estudio estadounidense que controló los factores demográficos, la salud vascular y el estado socioeconómico informó que, en 3521 personas de 65 años o más, los patógenos periodontales variados se asociaron con demencia por todas las causas, enfermedad de Alzheimer o tener la enfermedad de Alzheimer como causa subyacente de muerte en el certificado de defunción durante 26 años de seguimiento.
404 El grupo con enfermedades dentales tenía menos educación, menores ingresos disponibles y más comorbilidades que el grupo sin enfermedades dentales. Existe una escasez de evidencia consistente y de alta calidad de que la enfermedad dental y periodontal son factores de riesgo para la demencia.
Decisiones
No está claro hasta qué punto las infecciones y la inflamación son factores de riesgo modificables para la demencia, porque la mayoría de los estudios se realizaron en personas mayores con un seguimiento corto. Patógenos específicos atraviesan la barrera hematoencefálica, como la sífilis, el VIH y el herpes, y causan directamente demencia, que no es lo mismo que la infección sea un riesgo en sí mismo. La inflamación podría ser una vía común para muchos factores de riesgo de demencia.
Trastorno bipolar
En una revisión de cinco estudios longitudinales con períodos de seguimiento de 4 a 11 años, se examinaron las asociaciones entre el trastorno bipolar y la demencia.
110 No se realizó ningún metanálisis porque varios estudios utilizaron la misma base de datos y todos se basaron en una de dos cohortes poblacionales (en Australia o Taiwán), pero se identificó una asociación consistente entre el trastorno bipolar y el riesgo de demencia (HR entre 2,31 y 4,55). Un estudio incluido informó que una mayor gravedad del trastorno bipolar (medida por el número de ingresos psiquiátricos) se asoció con un mayor riesgo de demencia que el trastorno bipolar que no requirió ingresos psiquiátricos: la tasa de demencia fue mayor en los individuos que tuvieron uno o dos ingresos psiquiátricos (RR 2,4, IC del 95% 1,9-3,1) y más de dos ingresos (5,7, 4,8-6,8) al año. Hubo heterogeneidad en el grado en que los estudios ajustaron por factores como el riesgo cardiovascular, las comorbilidades y el consumo de alcohol.
Trastornos psicóticos, incluida la esquizofrenia
En una revisión sistemática de 2022 de 11 estudios de cohortes poblacionales que incluyeron a 13 millones de personas, se identificó un aumento general del riesgo de demencia por todas las causas durante una mediana de 11 años (RR 2,52, IC 95%: 1,67-3,80), aunque la heterogeneidad fue alta (I
2=99,7%).
405 La mayoría de los estudios incluidos fueron de individuos con esquizofrenia, y solo un estudio informó específicamente hallazgos para la esquizofrenia de inicio temprano (es decir, a los <40 años), que mostraron un mayor riesgo de demencia que para los individuos sin esquizofrenia, pero un riesgo más bajo que la esquizofrenia de inicio tardío (es decir, a los >40 años).
406 Otro estudio sobre la esperanza de vida incluido en la revisión también informó un menor riesgo de demencia en individuos más jóvenes (es decir, de 18 a 49 años) en comparación con mayores (es decir, de 50 a 64 años y ≥60 años) con esquizofrenia.
407 Sin embargo, un tercer estudio sobre la esperanza de vida informó un mayor riesgo de demencia en personas con inicio de trastornos psicóticos a edades más tempranas (es decir, de 18 a 60 años) que a edades más avanzadas (es decir, de 41 a 80 o 51 a 90 años).
408 lo que podría atribuirse a más muertes en las cohortes de mayor edad que en la cohorte más joven. Los estudios variaron en el grado de ajuste según la edad, el sexo, las comorbilidades, el alcohol, el tabaquismo, los medicamentos, los ingresos y los niveles de educación, y no hubo pruebas concluyentes sobre los efectos potenciales de comorbilidades específicas o medicamentos antipsicóticos sobre el riesgo de demencia o sobre el riesgo de tipos específicos de demencia.Las personas con esquizofrenia tienen volúmenes cerebrales más bajos al inicio que la población de la misma edad, lo que sugiere una causa del desarrollo neurológico.
409 Y el deterioro cognitivo, que es una característica central de la esquizofrenia, ya está presente desde el inicio.
410 No existe una relación clara entre este deterioro cognitivo y una neuropatología específica relacionada con la enfermedad de Alzheimer.
411 Y a pesar de tener principalmente trayectorias típicas de funcionamiento cognitivo relacionadas con la edad durante la mediana edad, las personas con esquizofrenia muestran un envejecimiento cerebral acelerado (en neuroimagen) en comparación con los controles sanos y las personas con depresión o trastorno bipolar.
412 Una revisión sistemática encontró que las personas con esquizofrenia con factores de riesgo cardiovascular, incluido el síndrome metabólico (13 estudios; n = 2800; tamaño del efecto 0,31, IC del 95% 0,13-0,50), diabetes (ocho estudios; n = 2976; 0,32, 0,23-0,42) e hipertensión (cinco estudios; n = 1899; 0,21, 0,11-0,31), tenían una cognición significativamente peor que las personas con esquizofrenia sin factores de riesgo de enfermedad cardiovascular.
413 Una mayor prevalencia de factores de riesgo conocidos de demencia a lo largo de la mediana edad, como la enfermedad cardiovascular, la hiperlipidemia, la obesidad, el tabaquismo y el aislamiento social, contribuye a un mayor deterioro cognitivo en la vejez.
414 Las personas con psicosis similar a la esquizofrenia de inicio muy tardío (es decir, a los >60 años) tienen un riesgo particularmente alto de desarrollar demencia, con un HR de 4,22 (IC del 95%: 4,05-4,41).
415 Aunque parte de este riesgo puede explicarse por un posible diagnóstico erróneo de los síntomas de la psicosis en la demencia como psicosis similar a la esquizofrenia de inicio muy tardío, las tasas de diagnóstico de demencia siguen siendo más altas en las personas con psicosis similar a la esquizofrenia de inicio muy tardío que en las personas sin la afección durante 20 años después del diagnóstico, y la psicosis similar a la esquizofrenia de inicio muy tardío podría representar un pródromo de demencia.En general, existe evidencia consistente de que las personas con esquizofrenia tienen tasas más altas y un inicio más temprano de demencia que otras, incluidas las personas con depresión o trastorno bipolar.
416 Las personas con esquizofrenia tienen una alta morbilidad cardiovascular, menos educación que sus contrapartes sanas y deterioro cognitivo relacionado con la esquizofrenia. Consideramos que no está claro si la esquizofrenia predispone independientemente a la demencia, más allá del hecho de que las personas con esquizofrenia suelen tener otros factores de riesgo. No se sabe si la intervención temprana puede modificar el deterioro cognitivo preexistente específico de la esquizofrenia. Pocos estudios han investigado el riesgo de demencia en personas con trastorno bipolar, pero los hallazgos han sido consistentes con respecto a un mayor riesgo. Recomendamos, de acuerdo con las directrices de la OMS:
417 para abordar el aumento del riesgo de desigualdades en la salud física de las personas con esquizofrenia y las personas con trastorno bipolar, y que también se preste mayor atención al tratamiento de los factores de riesgo de demencia modificables.
Ansiedad
A review of seven longitudinal studies identified no increased risk of dementia in people with anxiety disorders (RR 1·18, 95% CI 0·96–1·45), although individual studies had mixed findings and results were not adjusted for depression.
110 A subsequent study of 2551 adults aged 60–64 years who were followed up for 12 years reported no association of anxiety disorders themselves with cognition (after adjusting for depression) or with cognitive decline.
418 People with anxiety for whom psychological treatment was effective had a lower incidence of all-cause dementia after a median of 3·12 years (IQR 1·72–4·70; HR 0·83, 95% CI 0·78–0·88) than those for whom psychological treatment was not effective.
419 This result might suggest that people who have anxiety as part of preclinical dementia are less likely to find psychological treatment effective. A meta-analysis identified no association between anxiety symptoms and amyloid β (n=5141; 13 studies) or tau (n=1126; four studies) pathology in cognitively healthy adults.
Post-traumatic stress disorder
A systematic review of the associations between post-traumatic stress disorder and dementia identified three studies on this topic in the USA, Denmark, and Taiwan, with sample sizes ranging from 8750 to 489 994, and all studies observed an increased risk of dementia in people with post-traumatic stress disorder versus those without post-traumatic stress disorder in their 11–17 years of follow-up, ranging from an HR of 1·70 to 4·37.
110 The risk was more marked in people with comorbid depression than in people without depression, but the risk remained after adjustment for depression. An earlier systematic review and meta-analysis that included these studies and another five studies suggested that post-traumatic stress disorder is a risk factor for dementia, although there was considerable heterogeneity between the included studies (HR 1·61, 95% CI 1·43–1·81; I
2=85·8%).
421 Despite the increased dementia risk, a follow-up study over 5 years identified no increase in Alzheimer’s disease pathology in people with post-traumatic stress disorder and suggested that the increased dementia risk is from other causes.
422 There is only one meta-analysis, and evidence is too heterogenous to generalise and conclude at this stage that post-traumatic stress disorder is a modifiable risk factor for dementia.
Menopause and hormone replacement therapy
The role of menopause and hormone replacement therapy (HRT) was not discussed in the 2020 Lancet Commission, but it is possible that menopause and HRT might partly explain the higher prevalence of dementia in women than men due to the association between HRT and increased dementia risk.
423 Meta-analytic data found that woman with menopause occurring at age 45 years or older had a lower risk of dementia than those younger than 45 years when menopause occurred (RR 0·87, 95% CI 0·78–0·97; I
2=56·0%).
424Two nested case–control studies that used routinely collected primary care data from 16 291 women with dementia and 68 726 age-matched controls without dementia reported increased risks of developing Alzheimer’s disease in women who had used oestrogen–progestogen therapy for 5–9 years (RR 1·11, 95% CI 1·04–1·20) and for 10 years or more (1·19, 1·06–1·33) compared with women who did not use HRT.
425 In line with these findings, a study of 5589 Danish women who developed dementia and 55 890 age-matched controls aged 50–60 years found increased risk of all-cause dementia and Alzheimer’s disease in women who had used oestrogen–progestogen therapy compared with those who had never used this therapy (HR 1·24, 95% CI 1·17–1·33). Risk increased with more years of use, ranging from an HR of 1·21 (1·09–1·35) for use for 1 year or less to 1·74 (1·45–2·10) for use for more than 12 years.
426 Las personas que tomaban TRH tenían un mayor riesgo tanto si iniciaban el tratamiento a una edad más temprana (es decir, a los ≤55 años) como a edades mayores (es decir, a los >55 años). No se identificó el mismo riesgo para el tratamiento con progesterona sola o con estrógenos solos, y otro estudio mostró un menor riesgo de demencia por todas las causas entre las personas menores de 80 años que habían estado tomando tratamiento con estrógenos solo durante al menos 10 años que entre las mujeres no expuestas a la TRH (OR 0,85; IC del 95%: 0,76-0,94), pero no para las personas que habían tomado el tratamiento durante menos tiempo.
425Un metanálisis de 23 ECA heterogéneos, nueve de los cuales combinaron el uso de estrógenos y progesterona, informó que cualquier uso de TRH tuvo un efecto negativo pequeño pero significativo sobre la cognición global (diferencia de medias estandarizada -0,04; IC del 95%: -0,08 a -0,01; Yo
2=0,0%).
427 El análisis de subgrupos no mostró un efecto positivo en el uso a corto o largo plazo de la TRH en diferentes grupos de edad, pero un efecto más negativo si se inicia después de los 60 años. Un metanálisis adicional de ECA identificó pruebas de alta calidad de que las mujeres no deben tomar tratamiento con estrógenos solos después de la menopausia para prevenir la demencia y algunas pruebas de que este tratamiento aumentó el riesgo de demencia.
En general, no está claro si la menopausia y la TRH se relacionan causalmente con el riesgo de demencia. Existe cierta evidencia de que la terapia con estrógenos solos, la larga duración del tratamiento y la edad avanzada al inicio de la TRH podrían aumentar el riesgo de demencia.
Multimorbilidad y fragilidad
Las personas con multimorbilidad de enfermedades crónicas y graves tienen un mayor riesgo de demencia, especialmente si estas enfermedades comienzan en la mediana edad.
,
429 Se estima que hasta el 24% de las personas de 50 años o más tienen fragilidad, y la fragilidad es más común en las mujeres.
430 En un estudio longitudinal de 14 490 estadounidenses de 50 años o más (edad media de 72,2 años [DE 8,9]), una mayor fragilidad se asoció con una puntuación más baja en las pruebas neuropsicológicas
431 y un mayor riesgo de desarrollar deterioro cognitivo leve y demencia (HR para deterioro cognitivo leve de 1,66, 1,55-1,78 y HR para deterioro cognitivo leve a demencia de 1,14, 1,02-1,28 por aumento de 0,1 en el índice de fragilidad).
432 Un estudio adicional de 1,7 millones de adultos en Nueva Zelanda durante 30 años de seguimiento informó que la enfermedad física (definida como enfermedad coronaria, gota, enfermedad pulmonar obstructiva crónica, diabetes, cáncer, lesión cerebral traumática, accidente cerebrovascular o infarto de miocardio) se asoció con el riesgo de demencia (RR 1,19, IC 95% 1,16-1,21).
408 En un estudio del Biobanco del Reino Unido con 206 960 participantes, la multimorbilidad se asoció con un mayor riesgo de demencia incidente durante 15 años de seguimiento (media de 11,2 años [DE 2,2]) después de ajustar por edad, sexo, etnia, educación, nivel socioeconómico y estado de APOE ε4 (HR 1,63, IC del 95% 1,55-1,71).
429 El riesgo fue mayor en los individuos con grupos de enfermedad cardiovascular y cardiometabólica y en aquellos sin el gen APOE ε4. Los estudios de resultados, como la trayectoria danesa de la enfermedad,
433 Estudios finlandeses sobre la vivienda comunitaria,
434 y la Red de Mejora de la Salud en los registros de medicina general franceses y británicos,
434 El riesgo de demencia vinculado a una amplia gama de enfermedades, que podrían estar relacionadas con otros factores de riesgo, incluidas las secuelas de la enfermedad cerebrovascular, la osteoporosis, las infecciones graves y los trastornos mentales. La salud general, cuantificada por el grado de fragilidad, contribuye de forma independiente al riesgo de demencia en relación con la neuropatología,
435 Biomarcadores de la enfermedad de Alzheimer,
436 y puntuación de riesgo poligénico,
437 Por lo tanto, el riesgo de demencia transmitido por cada uno de estos factores es mayor en los individuos más frágiles.
Intervenciones y cuidados en la demencia
Diagnóstico
El camino hacia el diagnóstico
El diagnóstico oportuno de la demencia es una prioridad en muchos países, ya que el diagnóstico y la identificación de las causas subyacentes y los factores que contribuyen a ella son beneficiosos para permitir el tratamiento y la planificación.
438 Este diagnóstico es distinto del cribado y, como se establece en la Comisión Lancet de 2020, el único ensayo de cribado de la demencia se realizó en pacientes de atención primaria de EE. UU. de 65 años o más. Este ensayo no mostró efectos beneficiosos ni perjudiciales en la calidad de vida o en los síntomas de depresión y ansiedad al mes y en el uso de la atención médica, la planificación anticipada de la atención y el reconocimiento de la demencia por parte de los médicos a 1 año, por lo que no se recomiendan los exámenes de detección.
439Una revisión de las personas que buscaban un diagnóstico de 32 estudios en 13 países identificó que las personas con sospecha de demencia y los cuidadores familiares informaron múltiples barreras y facilitadores para el diagnóstico.
440 Las barreras incluyeron la negación, el estigma y el miedo, la falta de conocimiento, la normalización de los síntomas, el deseo de preservar la autonomía, la falta de necesidad percibida, la falta de conciencia de los cambios, la falta de apoyo de la red de familiares y amigos, las dificultades de los cuidadores, los problemas para acceder a la ayuda y la falta de preparación de los servicios para hacer un diagnóstico. Los facilitadores incluyeron el reconocimiento de los síntomas como un problema, el conocimiento y los contactos previos, y el apoyo de redes informales.
Equidad en el diagnóstico
Gran parte del trabajo sobre las vías hacia el diagnóstico proviene de los HIC. La identificación de la demencia como una afección médica ha sido un desafío en los países de ingresos bajos y medianos, donde, a pesar de la escasez de estudios, la atención médica carece de recursos suficientes y tiende a centrarse en las enfermedades infecciosas, con trastornos de salud mental a menudo estigmatizados y, por lo tanto, ocultos, y donde algunas personas aún desconocen la demencia.
,
442 Las personas en países de ingresos bajos y medianos tienen más probabilidades de acudir a los servicios en etapas tardías de la demencia que las personas en países de ingresos altos, tal vez debido a varios factores, incluido el buen apoyo en el hogar en los países de ingresos bajos y medianos y la falta de educación, concienciación, recursos, accesibilidad, estigma y creencias en materia de salud pública.
,
443 Además, muchos instrumentos de investigación, incluso cuando se denominan transculturales, se desarrollaron en los países de ingresos altos y no son adecuados para personas con bajos niveles de alfabetización o tienen un sesgo cultural.
,
445Incidencia de demencia
,
,
448 y prevalencia
36 es mayor en algunos grupos étnicos minoritarios que en los individuos blancos en países como Estados Unidos y el Reino Unido. En particular, la incidencia y la prevalencia son más altas en estos grupos cuando se miden mediante encuestas basadas en la población en lugar de mediante el uso de historias clínicas electrónicas, lo que indica un subregistro o una infrautilización de los servicios por parte de algunos grupos en los datos de rutina.
449 Las herramientas de detección cognitiva que se han desarrollado principalmente en poblaciones blancas de habla inglesa podrían ser inadecuadas en poblaciones más diversas porque se ven afectadas por la educación y los antecedentes culturales.
450 Por lo tanto, es fundamental que la evaluación cognitiva incluya la conciencia de la diversidad cultural dentro de las poblaciones en las que se utilizan, asegurando que las herramientas no dependan del nivel de alfabetización y educación, según corresponda.
451 Un posible indicador de calidad para la atención de la demencia es la proporción de personas con demencia que reciben un diagnóstico, pero el registro de un diagnóstico de demencia en el registro de atención médica de un individuo es menor para algunas etnias que para otras, por lo que es probable que cualquier suposición de una prevalencia similar en poblaciones minoritarias sea inexacta. Por lo tanto, es probable que estas medidas no sean adecuadas para determinar el acceso al diagnóstico.
Diagnóstico oportuno
There has been little evaluation of the relative clinical and cost-effectiveness of different models of service delivery,
452 resulting in a lack of clarity about what can be defined as good diagnostic services and care, and there is only indirect evidence that diagnosis of dementia is beneficial.
453The rationale for early or timely diagnosis is to sustain the wellbeing and health of people with dementia and their families by making care and treatment available. A diagnosis upholds an individual’s right to know about their illnesses.
438 Across three small studies identified in one review, a total of 92 (89%) of 103 people with a diagnosis of dementia said they wanted to know their diagnosis.
454 Another study reported that 998 (91%) of 1091 people who were diagnosed reported benefits in getting the diagnosis and 655 (60%) people wished they had known their diagnosis earlier.
455 These studies reported the views of people who had a diagnosis, although did not necessarily seek the diagnosis at an early stage. The views of people without a diagnosis were not represented in these studies.Diagnosis can provide psychological benefits and time to adjust. Diagnosis facilitates access to services, when they are available, that provide practical information, advice, guidance, and psychological and drug treatments. These services can support people’s ability to manage their condition, plan for the future, and make decisions about care, support, and financial and legal affairs while they have capacity.
456 Potential economic benefits from reducing health and social care costs by preventing unnecessary admissions to hospitals and care homes have been modelled.
,
,
459There are theoretical harms of a diagnosis of dementia;
,
460 for example, early diagnosis might be associated with increased risks of depression, anxiety, or social withdrawal, particularly if post-diagnostic interventions and care are unavailable. Evidence from a US national cohort study showed a decreased risk of suicide in people with a diagnosis of dementia (n=63 255) or MCI (n=21 085) compared with propensity matched patients (HR 0·71, 95% CI 0·53–0·94) but an increase in short-term suicide attempts (ie, in those diagnosed any time in the 5 years before the study) after people were informed they had MCI (1·34, 1·09–1·65) or dementia (1·23, 1·05–1·44).
461 There was no long-term increase in suicide attempts.Mobile and wearable devices hold promise for detection and diagnosis of neurodegenerative disease because their routine use in the general population is widespread and increasing and they can contain multiple sensors to study physical changes and cognitive abilities.
462 Nonetheless, a review of 20 mobile apps
463 reported that none met the criteria for use as a screening tool. Another review of 275 apps
464 suggested that those with artificial intelligence capabilities and use of machine learning had potential for detection and monitoring and should be further evaluated. There will be challenges in the existing data that inform such artificial intelligence, particularly from the lack of representation of diversity.
The balance of evidence and ethical principles finds that people should have access to timely and accurate diagnosis with appropriate interventions when they are seeking help, but the evidence does not justify screening the whole population for dementia.
Biomarkers in Alzheimer’s disease
Research on biomarkers for Alzheimer’s disease pathology has progressed since the 2020 Lancet Commission. Biomarkers that measure amyloid β, tau, and neurodegeneration are now incorporated into some definitions of Alzheimer’s disease pathology (ie, the amyloid–tau–neurodegeneration or A–T–N approach).
,
466 The presence of these biomarkers does not mean that someone has dementia; however, the absence of these biomarkers indicates the likely absence of Alzheimer’s disease pathology (but does not exclude other causes of dementia).
Neuroimaging
CT can show vascular changes, atrophy, and other reasons for neurodegeneration and is cheaper and more accessible than MRI, although its precision is lower. Although several types of MRI exist, the simplest is structural MRI (for cerebral atrophy, primarily in the hippocampus, entorhinal cortex, and medial temporal lobe).Advanced MRI sequences, including diffusion tensor imaging, arterial spin labelling, and susceptibility-weighted imaging, are needed to improve detection of brain microhaemorrhage and oedema that can occur with amyloid antibody treatment. Magnetic resonance spectroscopy, functional MRI, and PET (ie, in-vivo measurement of disease pathology by use of ligands) are emerging and useful metabolic and functional biomarkers. The limitations of these advanced imaging techniques include cost, patient consent and suitability, and expertise required to perform the procedures and interpret the results, although automated assessment performs nearly as well.
468 Amyloid-PET and tau-PET correlate with post-mortem amyloid plaques and neurofibrillary tangles.
CSF biomarkers
A low CSF Aβ42-to-Aβ40 ratio alone or combined with high phosphorylated tau (p-tau) is correlated with amyloid plaques and Alzheimer’s disease pathology. These CSF biomarkers can be used to evaluate underlying Alzheimer’s disease pathology as a possible cause of dementia or cognitive impairment and, in asymptomatic populations, to identify people at high risk of developing clinical Alzheimer’s disease for inclusion in clinical trial populations,
,
470 but there are important considerations in the interpretation of the biomarker changes. Interpretation depends on the clinical details and the age of the individual, because coincidental amyloid pathology is common at older ages. This interpretation issue applies to amyloid PET as well as CSF and plasma biomarkers. Overall biomarker interpretation depends on the clinical context.Biochemical changes in the brain are reflected in the CSF because of its contact with the extracellular space in the brain. These biomarkers are essentially proteins (ie, total tau, phosphorylated tau, Aβ42 and Aβ40, NF-L, and neurogranin) that have been validated against imaging methods. The advantage of CSF biomarkers, including NF-L, plasma tau phosphorylated at Thr181 (p-tau181), and GFAP (an astrocytic marker that appears to change around the time of amyloid accumulation
471), is their ability to detect early phases of disease. Biomarker changes 9–18 years earlier are associated with subsequent cognitive decline and diagnosis of dementia.
,
,
474 The disadvantages of these biomarkers are lack of infrastructure in many systems, the need for specialised health-care services, and concern around invasiveness.CSF-based protein aggregation and amplification assays, such as real-time quaking-induced conversion, are well established in the clinical diagnosis of Creutzfeldt–Jakob disease.
475 A similar approach has been developed for Lewy body dementia, and assays to detect neuronal α-synuclein in CSF show great promise.
,
477 A meta-analysis showed pooled sensitivities of 0·88 and specificities of 0·95 in distinguishing people with synucleinopathies from healthy controls and people with other types of dementia.
478 As with Alzheimer’s disease, biomarker results for Lewy body pathology become positive before symptoms of clinical dementia or parkinsonism develop and so might not be the cause of cognitive symptoms, especially in older adults. Further work is needed to clarify the position of neuronal α-synuclein assays in clinical practice, but they are likely to have a large role in the future. As with other assays, data from ethnically diverse cohorts are scarce.
Blood-based biomarkers
Since the 2020 Lancet Commission, research has progressed into the validity of blood-based biomarkers for the specific diagnosis of Alzheimer’s disease in individuals with dementia. CSF or PET markers might be replaced by blood-based biomarkers in determining eligibility for clinical trials and cohort studies in the future and for staging the extent of pathology related to Alzheimer’s disease, although further evidence of validity in each specific population of people with dementia is needed. Blood biomarkers might be useful in future to identify people with dementia who do not need more invasive or expensive investigation, either because of very low or very high probability of having Alzheimer’s disease.
479 The Aβ42-to-Aβ40 ratio in plasma detected with a high-precision assay has a strong correlation with amyloid-PET positivity.
,
481 Plasma p-tau181, tau phosphorylated at Thr217 (p-tau217), and tau phosphorylated at Thr231 (p-tau231) might have as good or better accuracy than CSF amyloid β, p-tau, and total tau at predicting a positive amyloid PET and hence Alzheimer pathology.
,
,
484 Los biomarcadores basados en la sangre ofrecen bajo costo, escalabilidad y aceptabilidad, superando varias limitaciones de los biomarcadores PET y los biomarcadores de LCR con una menor carga para el paciente y el médico a través de la recolección de muestras locales y el posible procesamiento central de control de calidad, lo que aumenta el acceso a un diagnóstico específico de patología de la enfermedad de Alzheimer.
Significado de los marcadores predictivos
Múltiples neuropatologías son comunes en las poblaciones de mayor edad y más frecuentes que la patología de la enfermedad de Alzheimer sola (figura 1).
20 La prevalencia de la placa β amiloide está relacionada con la edad (es decir, >20% a partir de los 70 años; >30% a los 80 años),
485 Lo que significa que un resultado positivo de amiloide β biomarcador debe interpretarse con cautela en personas mayores: refleja la patología de la placa β amiloide, pero podría no ser la causa del deterioro. No obstante, si un individuo es negativo para los biomarcadores de β amiloide (es decir, negativo para las placas en la PET o tiene una alta proporción de Aβ42 a Aβ40 en LCR), es poco probable que se diagnostique la enfermedad de Alzheimer, independientemente de la edad. Debido a que la acumulación de amiloide β placa ocurre muchos años antes del inicio de la neurodegeneración o los síntomas cognitivos, se demostró que un resultado positivo de amiloide β biomarcador por sí solo era solo un predictor modesto de deterioro cognitivo futuro en comparación con una TEP de amiloide negativa durante 6 años de seguimiento (HR para desarrollar demencia en participantes con un resultado positivo de β de amiloide pero negativo del biomarcador de tau vs aquellos con resultados negativos de β amiloide y biomarcadores de tau fue de 1,6, IC del 95%: 0,5-5,4).
486Como se discutió en la Comisión Lancet 2020, la mayoría de las personas cognitivamente sanas que son β positivas para el amiloide, ya sea en las imágenes cerebrales o en el líquido cefalorraquídeo, no desarrollan la enfermedad de Alzheimer en los próximos 10 años, ni durante su vida. En una muestra de voluntarios estadounidenses de 1524 participantes (698 mujeres), la prevalencia de positividad para el β amiloide fue del 10% (IC del 95%: 6-14) entre las mujeres a los 70 años, mientras que la prevalencia de la probable enfermedad de Alzheimer definida clínicamente fue del 1% (1-1).
487 A los 85 años, la prevalencia de positividad para el β amiloide era del 33% (24-41), mientras que la prevalencia de la enfermedad de Alzheimer probable clínicamente definida fue del 9% (9-12), con cifras similares para los hombres. En un estudio de cohorte de autopsias basado en la comunidad de marcadores de β amiloide, tauopatía y neurodegeneración, se informó que solo el 8 % de 398 participantes con marcadores de β y tauopatía (pero sin neurodegeneración) en comparación con el 68 % de los participantes con marcadores de β amiloide, tauopatía y neurodegeneración tuvieron demencia incidente en los últimos 5 años de vida.
488La captación de Tau-PET ocurre en una etapa y edad más tardías que la captación de PET de amiloide y se asocia más estrechamente con la disfunción cognitiva que la PET de amiloide.
,
490 Los biomarcadores de neurodegeneración, como la atrofia del hipocampo, el adelgazamiento de la corteza medial, la baja absorción de glucosa en fluorodesoxiglucosa (FDG)-PET o el aumento de la NF-L del LCR (es decir, un marcador no específico de neurodegeneración), están más estrechamente asociados temporalmente con el deterioro cognitivo que los biomarcadores de β amiloide y tau en LCR.
491 Las personas sin deterioro cognitivo que tienen β amiloide y tau en el lóbulo temporal medial o el neocórtex temporal tienen más probabilidades de deteriorarse cognitivamente en comparación con las personas que no tienen ninguno de los dos, y a lo largo de 6 años, el riesgo en los individuos que son tau positivos en el neocórtex temporal podría acercarse al 50%, pero las muestras son pequeñas y las estimaciones imprecisas.
486 Otros biomarcadores y avances en proteómica y metabolómica podrían descubrir nuevas dianas farmacológicas.
,
,
494Desde el punto de vista clínico, es posible que los biomarcadores basados en la sangre no agreguen valor a la predicción de si las personas desarrollarán demencia de Alzheimer (es decir, enfermedad de Alzheimer más deterioro cognitivo sustancial). Una combinación de múltiples biomarcadores sanguíneos e información demográfica, como la edad y el sexo, podría permitir calcular el riesgo individualizado de desarrollar la enfermedad de Alzheimer, como se ha hecho en una población con deterioro cognitivo leve.
495Además, la mayoría de las investigaciones se han realizado casi exclusivamente en poblaciones blancas, y una revisión sistemática identificó cinco estudios, de los cuales ninguno se realizó en participantes africanos negros, pero algunos en participantes afroamericanos.
496 Los participantes del estudio suelen ser más jóvenes que la mayoría de las personas con demencia. Pequeños estudios en afroamericanos informan concentraciones más bajas de p-tau tanto en individuos cognitivamente sanos como en personas con demencia que en estadounidenses blancos, por lo que la generalización de los biomarcadores de las poblaciones blancas no está clara. Una revisión posterior identificó siete estudios y nuevamente informó concentraciones más bajas de tau en las personas negras con demencia que en las personas blancas con demencia, pero ninguno de los estudios identificó una mayor carga vascular como explicación.
497 Los autores de la revisión sugirieron que las diferencias en los determinantes sociales de la salud entre las muestras blancas y negras podrían ser una explicación. El hecho de que esta diferencia se deba a los determinantes sociales es coherente con un estudio de una muestra comunitaria de adultos afroamericanos y blancos no hispanos que no identificó ninguna asociación independiente de biomarcadores plasmáticos para la enfermedad de Alzheimer en función de la raza autoinformada, con la edad, el sexo, la enfermedad renal crónica y los factores de riesgo vascular que contribuyen a la variación observada.
Selección de pacientes en ensayos de enfermedad de Alzheimer: biomarcadores y pruebas genéticas
Otro avance desde la Comisión Lancet de 2020 ha sido el uso de la PET de amiloide como criterio de elegibilidad y como resultado clínico sustituto para los ensayos clínicos de terapias con anticuerpos β antiamiloides para participantes con enfermedad de Alzheimer temprana. Los ensayos de fase 2 y fase 3 de anticuerpos monoclonales (es decir, aducanumab, lecanemab, donanemab y gantenerumab) que se dirigen a placas de β amiloide, fibrillas, protofibrillas solubles y especies de β de amiloide oligomérico requirieron evidencia de patología de placa amiloide para la inscripción en el ensayo, principalmente de PET de amiloide.
,
,
,
502 Los ensayos de fase 3 de lecanemab y donanemab mostraron una eficacia modesta para ralentizar el deterioro cognitivo en la enfermedad de Alzheimer temprana (tanto para el deterioro cognitivo leve como para la demencia). El ensayo de fase 3 de donanemab requirió que las personas con enfermedad de Alzheimer temprana tuvieran PET de amiloide y PET tau-PET positivos, lo que permitió que los participantes se dividieran en grupos de carga de tau positiva baja e intermedia o alta.
503 Tanto en el ensayo de lecanemab como en el de donanemab se utilizó la PET de amiloide para evaluar la disminución del β de amiloide y se observó una eliminación marcada del amiloide en un plazo de 18 meses.
,
501 Además, lograr un nivel bajo de unión a PET amiloide fue un criterio de interrupción en el ensayo de donanemab. En el futuro, los biomarcadores sanguíneos podrían utilizarse para evaluar si se debe realizar una PET y, por lo tanto, reducir el costo de dichos ensayos.
,
505El conocimiento sobre las pruebas genéticas en la demencia ha avanzado rápidamente, pero las pruebas genéticas no se usan ampliamente porque la mayoría de las demencias no son causadas por genes autosómicos dominantes. Una prueba genética positiva para uno de los alelos que conduce a la enfermedad de Alzheimer rara, autosómica dominante y de inicio temprano aumenta la precisión del diagnóstico, ayuda a los miembros de la familia a establecer el riesgo personal, podría informar las decisiones reproductivas y puede ayudar en los ensayos clínicos. Una proporción relativamente mayor (hasta un tercio en algunas estimaciones) de todas las demencias frontotemporales se deben a una mutación genética autosómica dominante, y las pruebas en el entorno clínico adecuado podrían ser importantes.
506Although it is well established that APOE genotype substantially affects Alzheimer’s disease risk,
507 genetic testing for the APOE ε4 allele is not used diagnostically, and many people with Alzheimer’s disease do not carry the ε4 allele. APOE alleles contribute to the heterogeneity of the Alzheimer’s disease course. A post-mortem study (n=1109) reported a 10% faster rate of cognitive decline yearly in APOE ε4 carriers (−3·45 vs −3·03 MMSE points per year) and a 20% lower rate of decline in ε2 carriers (−2·43 vs −3·03 MMSE points per year) compared with APOEε3/ε3 carriers.
Summary of biomarkers now and in the future
Biomarkers identify a particular pathology, not a clinical syndrome, and a biomarker is not a diagnostic test for dementia. Amyloid-PET and CSF amyloid and tau assays are approved by the US Food and Drug Administration (FDA) for marketing and reimbursement as Alzheimer’s disease diagnostic aids to help to establish the presence of amyloid plaques and Alzheimer’s disease pathology.Existen claras implicaciones éticas si las pruebas de biomarcadores se utilizan en personas sin deterioro cognitivo como marcadores de personas con enfermedad de Alzheimer (asintomática), ya que las pruebas tienen el potencial de aumentar las tasas medidas de la enfermedad de Alzheimer sin que haya ningún aumento en el número de personas con deterioro cognitivo o demencia, y podrían identificar erróneamente a las personas que no desarrollarán demencia y podrían causar daño potencialmente. En la actualidad, los biomarcadores por sí solos no deben utilizarse para el diagnóstico y para determinar el tratamiento, ya que la mayoría de las personas con un biomarcador β amiloide positivo por sí solos nunca desarrollarán demencia. La esperanza declarada es que si se desarrollan terapias presintomáticas eficaces y seguras y luego se vuelven accesibles, los biomarcadores rentables para la enfermedad de Alzheimer u otras demencias pueden ser importantes para predecir qué individuos tienen probabilidades de progresar a la enfermedad y cuándo, o como criterios de valoración sustitutos para la eficacia y para aumentar la equidad (figura 10).

Intervenciones una vez realizado el diagnóstico
Principios de intervención en personas con demencia
La demencia es progresiva y las personas que viven con demencia requieren una reevaluación y el uso de enfoques personalizados para abordar sus necesidades de atención cambiantes a lo largo del tiempo. Estas necesidades pueden ser complejas e incluyen multimorbilidad física; síntomas psicológicos, conductuales y cognitivos; y los posibles riesgos derivados de estos síntomas.Las personas con demencia son individuos cuyas necesidades de apoyo e intervención están influenciadas por su propio curso de vida, familia, amistad, cultura y entorno, así como por los cambios en los síntomas cognitivos, neuropsiquiátricos, funcionales y físicos, como discutimos en la Comisión Lancet 2020.
2 A pesar de la disponibilidad de prácticas basadas en la evidencia, la demencia sigue estando poco detectada y las necesidades de muchas personas y cuidadores familiares no se evalúan ni se satisfacen.
3Las mejores prácticas publicadas para la atención de la demencia a nivel mundial incluyen el manejo de afecciones médicas, como la presión arterial alta, la diabetes y la enfermedad pulmonar obstructiva crónica; prevenir y tratar las infecciones y el delirio; adaptaciones ambientales para la seguridad, la prevención de caídas y el mantenimiento de la función; el manejo de la medicación, incluida la simplificación y la reducción de los medicamentos diarios, por ejemplo, reducir o suspender los tratamientos antihipertensivos si la presión arterial está disminuyendo; tratamiento de los síntomas a través de intervenciones conductuales; Uso de servicios sociales y de apoyo, incluida la asistencia con las actividades de la vida diaria, la actividad física, las actividades significativas, la participación social, la nutrición e hidratación saludables, y la atención de las necesidades de los cuidadores familiares.
,
,
10La mayoría de las intervenciones para la demencia se desarrollan en los países de ingresos altos. Las intervenciones deben diseñarse conjuntamente con las comunidades locales para garantizar que sean adecuadas al contexto, la cultura, las creencias y las prácticas, que varían dentro de los países y entre ellos.
509 En los países de ingresos bajos y medianos, la demencia a menudo no se reconoce ni se diagnostica y, cuando se produce, las personas que viven con demencia a menudo se enfrentan a recursos insuficientes para el tratamiento y la atención, incluido el tratamiento de otras enfermedades y el apoyo a las familias.
510 La idoneidad del uso de intervenciones basadas en la evidencia en los países de ingresos bajos y medianos puede ser incierta, no solo debido a la escasez de infraestructura de atención de salud y recursos para realizarlas, sino también debido a las diferencias culturales que podrían hacerlas inapropiadas o menos eficaces que en los países de ingresos altos.La eficacia de las intervenciones desarrolladas en un entorno variará con la aceptabilidad y la viabilidad en diferentes poblaciones y, por lo tanto, aunque los principios básicos deben seguir siendo los mismos en diferentes países, las intervenciones deben adaptarse al idioma y la cultura.
,
512 La adaptación cultural es importante para las intervenciones psicosociales en diversas afecciones de salud mental, y los metanálisis han demostrado que dichas intervenciones son más eficaces que las intervenciones no adaptadas culturalmente.
,
,
515En una revisión sistemática en la que se analizaron intervenciones adaptadas culturalmente para las personas que viven con demencia y los cuidadores familiares, se identificó que las intervenciones adaptadas culturalmente eran tan aceptables, factibles y eficaces cuando se utilizaban en los países de ingresos bajos y medianos como en su contexto original, siempre y cuando los componentes básicos no se vieran comprometidos en el proceso de adaptación.
511 La adaptación implica tener en cuenta las culturas, las necesidades y los recursos locales e identificar las barreras y los facilitadores para la implementación de la intervención. Las opiniones difieren en cuanto a si es necesario realizar un ECA completo en un nuevo entorno cuando ya se ha informado que una intervención es efectiva porque la heterogeneidad biológica, étnica, cultural y socioeconómica podría influir en la respuesta al tratamiento y la seguridad.
,
516 Después de la adaptación cultural, las intervenciones deben ser probadas y sus componentes evaluados en el contexto local para establecer su aceptabilidad y factibilidad y para ayudar a definir y refinar las características de la intervención. Es importante incluir a las partes interesadas clave en el proceso de adaptación e informar sobre los procesos y resultados considerados.
511 Otras consideraciones importantes son la idoneidad cultural de las medidas de resultados, muchas de las cuales se desarrollan en los países de ingresos altos, y la escalabilidad de la intervención.Los modelos de atención multicomponente de la demencia con coordinación de la atención centrada en la persona tienen como objetivo orientar la evaluación del riesgo y la necesidad de la persona que vive con demencia y del cuidador familiar utilizando enfoques basados en la evidencia. Un metanálisis encontró que la coordinación de las intervenciones mejoró los síntomas neuropsiquiátricos (diferencia de medias –9,5; IC del 95%: –18,1 a –1,0; cuatro estudios) y la carga del cuidador (diferencia de medias estandarizada: -0,54; IC del 95%: -1,01 a -0,07; p = 0,02; cinco estudios) con heterogeneidad en el resultado.
517 Los estudios individuales sobre la coordinación de la atención han demostrado una reducción de la admisión en residencias y de la rentabilidad desde una perspectiva social e individual.
518 pero el metanálisis de los ECA de coordinación de la atención no mostró una reducción significativa en el ingreso en el hogar de ancianos o la hospitalización.
517 Los modelos que incluyen una asociación entre la atención primaria y la especializada podrían reducir los costos de la atención médica.
519Although there are often positive aspects of being a family carer, caring for a family member with a deteriorating illness, such as dementia, is usually increasingly difficult. The difficulty can vary across the course of dementia, with greater anxiety and depression for some near the onset of disease than later in the disease course. A meta-analysis (43 studies; 19 911 participants) reported a pooled prevalence of depression in family carers of 31·2% (95% CI 27·7–35·2).
520 Evidence exists that some multicomponent carer interventions are effective in the short and long term, and these interventions usually include information about medical and community-based resources, skills training, stress reduction and coping techniques, emotional support, and future planning.
,
,
,
,
,
525 These interventions reduce the prevalence of family carer depression, burden, and stress and are cost-effective and cost saving. Evidence suggests that the interventions are effective in HICs, but little evidence exists in LMICs.
526 Interventions can be culturally adapted and delivered by trained facilitators without clinical qualifications. The Strategies for Relatives intervention, which was developed in and was clinically and cost effective in the UK, has been adapted for use to widen access by making it culturally appropriate for Black and south Asian carers and was successfully delivered in voluntary settings.
,
528 In another study in the USA, an intervention delivered by daycare staff reduced carer depression at 1 year.
529 A Cochrane review of RCTs on remote delivery of interventions including information and support for family carers identified 26 studies and reported that these interventions were no more effective than usual care.
530 A meta-analysis of internet-based psychoeducation for carers showed a small effect on depressive symptoms (standardised mean −0·19, 95% CI −0·03 to 0·35) but not on anxiety, burden, and quality of life.
Interventions for cognitive symptoms
Symptomatic treatment: cholinesterase inhibitors and memantine
In the previous Lancet Commissions, we discussed cholinesterase inhibitors and memantine, which are the available drugs for the treatment of cognitive symptoms in people with Alzheimer’s disease and Lewy body dementia. Although the drugs were initially evaluated for people with mild-to-moderate Alzheimer’s disease, meta-analyses of RCTs indicate that these drugs are also associated with a reduction in symptom severity (standardised mean difference 0·37, 95% CI 0·26–0·48; four studies), improvement in cognition (mean difference 0·78, 95% CI 0·33–1·23; three studies), improvement in activities of daily living (standardised mean difference 0·15, 95% CI 0·04–0·26; five studies), and decrease in mortality (RR 0·60, 95% CI 0·40–0·89; six studies) in people with severe dementia compared with placebo.
532Since the previous Commissions, longer-term, real-world studies have been published. One study of a register of all incident Alzheimer’s dementia diagnoses in Sweden showed that 11 652 individuals who took cholinesterase inhibitors performed slightly and persistently better on the MMSE, with an average of 5 years of follow-up, than did 5826 propensity-matched individuals who did not take cholinesterase inhibitors (0·13-point [95% CI 0·06–0·20] higher score per year), with a dose–response effect.
533 A similar, propensity-matched, longer-term study reported larger differences between people who did and did not take cholinesterase inhibitors: in 1572 individuals with dementia, the average decrease in MMSE score in people taking cholinesterase inhibitors was 5·4 points compared with 10·8 points in those not taking cholinesterase inhibitors at the end of 13·6 years of follow-up (p<0·001).
534 There was a strong association between cholinesterase inhibitors and lower all-cause mortality (HR 0·59, 95% CI 0·53–0·66). Additionally, in a study of 592 patients with dementia with Lewy bodies, the 100 participants who took cholinesterase inhibitors (0·67, 0·48–0·93) and 273 participants who took cholinesterase inhibitors and memantine (0·64, 0·50–0·83) had significantly lower risk of death than 219 participants who did not take cholinesterase inhibitors or memantine, after controlling for sociodemographic factors, physical and cognitive health, and medication use. People taking cholinesterase inhibitors or both cholinesterase inhibitors and memantine also spent significantly less unplanned time in hospital for physical disorders than people who took neither drug.
These studies are observational, not RCTs, and might reflect residual confounding based on willingness to initiate treatment, so people taking cholinesterase inhibitors might have unmeasured factors that would lead to better outcomes than for people who are unable or unwilling to initiate treatment. Trials show that cholinesterase inhibitors do not cure or stop cognitive decline but have short-term, modest positive effects and that stopping this treatment is associated with worse outcomes in the long term. Clinicians can offer these relatively affordable (compared with other drugs for dementia, and compared with requiring more care), readily available medications (in HICs but not LMICs) with few side-effects for people with Alzheimer’s disease and Lewy body dementia.
Amyloid-β-targeting antibodies for Alzheimer’s disease
Since the 2020 Lancet Commission, there have been positive trials of three anti-amyloid-β monoclonal antibodies for treatment of MCI due to Alzheimer’s disease and mild Alzheimer’s disease dementia in people with positive amyloid β biomarkers as well as three negative trials. In two conflicting, identically designed, phase 3 trials (ENGAGE and EMERGE), aducanumab was associated with a decline of 0·39 points (95% CI 0·09–0·69) compared with placebo on the Clinical Dementia Rating Scale-Sum of Boxes (CDR-SB; out of a total possible score of 18) at 18 months in one study, and a non-significant outcome favouring placebo in the other trial.
500 The CLARITY-AD trial of lecanemab was associated with a difference in CDR-SB points of 0·45 (0·23–0·67) compared with placebo after 18 months of treatment and less decline in secondary cognitive, activities of daily living, and compositive outcomes.
499 Presence of APOE ε4 is an important predictor of amyloid-related imaging abnormalities (ARIA), seen as MRI signal abnormalities. Effusion or oedema (also known as vasogenic odema) ARIA (ARIA-E) and cerebral microhaemorrhage ARIA (ARIA-H) are often present with treatment with anti-amyloid β antibodies. Participants who were treated with lecanemab and were APOE ε4 homozygous had a 33% (46 of 141 participants) incidence of ARIA-E compared with an 12% (58 of 479 participants) incidence in participants who were APOE ε4 heterozygous and 5% (15 of 274 participants) incidence in participants who were not APOE ε4 carriers.
499 Thus, the boxed warning for lecanemab recommends APOE genotyping and patient counselling before treatment.
535 Figures were similar with donanemab: 41% (58 of 143 participants) incidence of ARIA-E in participants who were APOE ε4 homozygous, 23% (103 of 452 participants) incidence for people who were heterozygous, and 16% (40 of 255 participants) incidence for people who were not carriers.
501People in the TRAILBLAZER-ALZ 2 trial who were taking donanemab had a smaller decline than the placebo group on the integrated Alzheimer Disease Rating Scale (cognition and functioning). The decline was −10·19 (95% CI −11·22 to −9·16) in the drug group and −13·11 (−14·10 to −12·13) in the placebo group after 18 months of treatment, and the intervention group had less decline in secondary cognitive, activities of daily living, and composite outcomes.
501 Since these studies were published, two new studies of the subcutaneously administered antibody gantenerumab with 2-year follow-up have shown similar biomarker clearance, with reduction in amyloid plaques but no significant effect on CDR-SB points (–0·31 and –0·19).
,
536 The difference between the drug group and placebo group was of similar size in some domains to the more positive trials but did not reach statistical significance.
536 Similarly, a trial of solanezumab,
537 did not slow cognitive decline in people with preclinical Alzheimer’s disease or affect amyloid plaque concentration but did influence CDR-SB, in line with the other studies (–0·34).
536Biogen, the manufacturer of aducanumab, has subsequently announced that they are withdrawing the drug from the market and that the phase 4 trial will be stopped. The FDA approved lecanemab in July, 2023.
499 The approvals were based partly on the reasonable expectation that a reduction in amyloid-PET load, or plaques, was likely to predict clinical benefit, although correlations between reduction in plaques and change on clinical ratings scales are positive but weak. These antibodies have not been tested in people with moderate or severe dementia, with the lowest participant MMSE score at 22 for lecanemab and 20 for donanemab.The clinical importance of these differences in cognitive outcomes at the end of trials is controversial.
,
,
,
541 There is excitement about positive results, which have been hoped for over the years, but no consensus exists about whether these treatments are a huge advance or not or whether the observed benefits need to be balanced with the known burden, risks, and costs.
Clinical implications and generalisability of amyloid-β-targeting drugs for cognitive symptoms
The modest effectiveness of these drugs is an important advance. In those that are effective, whether clinical benefits with treatment beyond 18 months will increase, remain steady, or reduce is unknown. Future results from open-label extensions of trials might help to answer these questions, but there will be many dropouts and morbidity and mortality from other diseases. The small effect of antibody treatment makes it difficult to discount the potential of unmasking due to adverse effects, such as ARIA-E and ARIA-H and decreased brain volume on MRI.
,
,
543The stringent eligibility criteria for clinical trials of drugs for Alzheimer’s disease often makes the study population’s health better than that of the general Alzheimer’s disease population,
544 and historically excluded racial and ethnic backgrounds are under-represented, although there were higher numbers of people from minoritised groups in the lecanemab trial than in other published immunotherapy trials. Only 237 (27%) of 869 participants in a community-recruited study using data from the Mayo Clinic Study of Aging had a positive amyloid-PET scan and met the criteria for MCI or mild dementia.
546 Of these people, only 19 (8%) would have met the lecanemab trial eligibility criteria, although drug trials by their nature have very constrained inclusion criteria.A meta-analysis of 101 drug trials for Alzheimer’s disease reported that a median of 94·7% (IQR 81·0–96·7) of participants in 46 trials with data were White and most trials excluded people with psychiatric illness (79 [78%] of 101 trials), cerebrovascular disease (68 [67%] trials), and cardiovascular disease (72 [71%] trials) and required a family carer to attend infusions (81 [80%] trials).
546 It is difficult to generalise findings to most people with Alzheimer’s disease who have high levels of multimorbidity and mixed neuropathology and to those who live in countries where health-care systems could not support this level of intervention.So far, the only marketing authorisation outside the USA has been for lecanemab in Japan and China, although other authorities are making decisions. Lecanemab is nominally priced at US$26 500 per patient per year.
547 The price that Medicare, the US Veterans Administration, and private insurers will pay is unknown. Additionally, costs are associated with the many physician visits, biweekly infusions, laboratory tests, MRIs, PET scans, and management of side-effects. Medicare patients are typically required to co-pay up to 20% of these costs. The US Institute for Clinical and Economic Review reported that the cost-effective annual pricing was lower than that charged for lecanemab, falling between $8900 and $21 500.
548 Donanemab infusions are less time consuming, given less frequently (ie, monthly), and less costly overall than lecanemab infusions because donanemab infusions are discontinued when amyloid is removed and so around 60% of people require treatment for only 1 year.
501Based on the US pricing, if lecanemab was available in the 27 EU countries for people qualifying for the drug, then treatment costs are estimated at €133 billion per year, equivalent to over half of the total pharmaceutical expenditures in the EU
549 before treatment-related costs are considered. However, historically the EU and the UK have paid less than the US list price for new and expensive medications.Finding amyloid-β-targeting treatments that influence cognition is an important milestone and might be the beginning of the development of impactful drugs for cognition (panel).
550 Currently, the effects of all drugs are small.
536 Los recursos necesarios para apoyar el diagnóstico precoz basado en biomarcadores, la supervisión de la administración y la seguridad, y la compra de los medicamentos significarán que el despliegue en muchos sistemas de salud será lento o inexistente en algunos. Si se aprueban tratamientos dirigidos a la β amiloide para un grupo menos restrictivo que el utilizado para los ensayos originales, como las personas con enfermedad temprana o multimorbilidad, se recomienda que se utilicen en centros de investigación para investigar tanto los efectos adversos para los pacientes típicos como si los efectos a largo plazo apoyan la modificación de la enfermedad o no. Las terapias subcutáneas, como se ha comentado anteriormente, continúan siendo probadas y reducirían sustancialmente la carga y aumentarían el acceso.
Resumen de las controversias en torno a los anticuerpos dirigidos al amiloide β
Eficacia
El beneficio cognitivo es modesto. No está claro si el beneficio es clínicamente significativo o cuál es la duración del efecto.
Dificultades en la aplicación
Se necesitan infusiones mensuales o quincenales, lo que requiere muchas visitas a un centro de infusión durante un período de tratamiento típico de 18 meses. Se necesitan resonancias magnéticas frecuentes para la vigilancia de la seguridad. Es posible que sea necesaria una reestructuración sustancial de la infraestructura de atención de la salud existente para las visitas al médico, las infusiones, las pruebas de laboratorio, las resonancias magnéticas y las tomografías por emisión de positrones, así como para el tratamiento de los efectos adversos. La infraestructura que podría soportar este nivel de intervención es insuficiente en muchos sistemas de atención de la salud.
Costos
El precio nominal de lecanemab es de 26 500 dólares EE.UU. por paciente y año, sin incluir los costes asociados de la cribado, la administración y el seguimiento de la elegibilidad. Históricamente, la UE y el Reino Unido pagan menos que el precio de lista de Estados Unidos por medicamentos nuevos y caros.
Seguimiento y efectos secundarios
Se requiere un seguimiento clínico y radiológico regular del edema y la hemorragia, que puede ocurrir en el 20% de los pacientes tratados con lecanemab y casi el doble que en los pacientes tratados con donanemab.
Exclusiones
La mayoría de los pacientes comunitarios existentes no cumplirían con los criterios de elegibilidad del ensayo. Por lo tanto, es difícil generalizar los hallazgos a la mayoría de las personas con enfermedad de Alzheimer que son racial y étnicamente diversas y tienen altos niveles de multimorbilidad y neuropatología mixta.
Intervenciones cognitivas para personas con demencia
Anteriormente informamos que la literatura sugería que las personas que completaron las intervenciones cognitivas tuvieron mejoras en las habilidades cognitivas generales y específicas, como la fluidez verbal, que duró de unos pocos meses a 1 año.
2 Una revisión Cochrane de 2023 de 25 estudios que utilizaron el MMSE, con 1893 participantes en total, encontró que había evidencia de calidad moderada de una diferencia clínicamente importante de 1,99 puntos (IC del 95%: 1,24-2,74) entre los grupos de estimulación cognitiva y control y mejoras clínicamente relevantes en la comunicación y la interacción social.
551 Las mejoras fueron mayores cuando las sesiones fueron dos veces, en lugar de una, por semana y en personas con demencia leve en comparación con moderada.
Intervenciones para los síntomas neuropsiquiátricos de la demencia
Intervenciones de actividades
Una revisión sistemática y metanálisis de siete estudios (n = 160) de intervenciones de programas de actividad personalizados identificó un efecto moderado en la mejora de la calidad de vida (tamaño del efecto estandarizado d de Cohen 0,79, IC del 95%: 0,39-1,18), la disminución de los síntomas neuropsiquiátricos (0,62, 0,40-0,83) y la disminución de la carga del cuidador (0,68, 0,29-1,07).552 Esta revisión incluyó pequeños ensayos piloto en países de ingresos bajos y medianos, que mostraron efectos similares y validaron la transferibilidad entre entornos. 553, 554 Estas intervenciones también podrían ser un ahorro de costos debido a la disminución del uso de los sistemas de atención de salud de rutina por parte de las personas que reciben la intervención.555 Los ECA de buena calidad de intervenciones con ejercicios para pacientes con demencia informaron que estas intervenciones no mejoraron los síntomas neuropsiquiátricos, la cognición ni el funcionamiento.556, 557Los estudios varían en cuanto a la calidad de la evidencia y las estrategias de diseño, desde los estudios de factibilidad y los ECA pequeños hasta los ensayos aleatorios multicéntricos multicéntricos (tabla 2).
Tabla 2ECA de programas de actividad para personas con demencia
| Intervención | Población objetivo | Diseño del estudio | Resultados clave | |
|---|---|---|---|---|
| Ballard y otros558 | Intervención para el bienestar y la salud de las personas con demencia: personal asistencial formado para promover actividades e interacciones sociales personalizadas centradas en la persona y un sistema para cambiar los medicamentos inadecuados | El personal capacitado por el equipo del ensayo proporcionó la intervención a los residentes de hogares de ancianos | ECA grupal de 9 meses que utilizó un análisis por intención de tratar en 69 residencias de ancianos del Reino Unido (n = 847) | Mejora de la calidad de vida, la agitación y los síntomas neuropsiquiátricos y ahorro de costes |
| Gitlin y otros559 | TAP en el que se capacitó a los cuidadores para usar actividades y se les brindó educación sobre enfermedades y técnicas de reducción del estrés. | Los terapeutas ocupacionales capacitados proporcionaron actividades adaptadas a los intereses y habilidades en el hogar | ECA paralelo simple ciego en 160 parejas de veteranos con demencia y sus cuidadores familiares | Disminución de los síntomas conductuales y del dolor en la persona con demencia y mantenimiento de la función diaria a los 4 meses, pero sin efecto a los 8 meses |
| Gitlin y otros560 | GRIFO | Los terapeutas ocupacionales proporcionaron ocho sesiones en un TAP en casa a personas con agitación con demencia moderada | ECA simple ciego en 250 parejas de personas con diagnóstico de demencia y agitación o agresión clínicamente significativas y sus cuidadores | Los TAP no ayudaron a la agitación; los cuidadores informaron que el TAP facilitó la vida, aumentó su capacidad para brindar cuidados y mejoró algo o mucho la vida de la persona con demencia; el grupo TAP tuvo menos muertes y hospitalizaciones que el grupo control de atención |
| Gitlin y otros561 | TAP con una submuestra de 153 parejas de cuidadores blancos y 90 negros y personas con demencia | El terapeuta ocupacional proporcionó actividades e instrucciones personalizadas en el hogar a los cuidadores de personas con demencia | RCT simple ciego de dos brazos en 193 pares blancos y negros | Beneficios conductuales para las personas con demencia a los 3 meses, que fueron más fuertes para las parejas negras que para las parejas blancas |
| Cordero y otros557 | Ejercicios aeróbicos y de fuerza adaptados a la condición física y al estado de salud | Fisioterapeutas y asistentes de ejercicio prescritos y supervisados intervenciones para personas con demencia | ECA multicéntrico, pragmático, enmascarado por el investigador (n=494) | No se informó ningún efecto sobre la calidad de vida o los síntomas neuropsiquiátricos, pero se informó un mayor deterioro cognitivo en el grupo de ejercicio que en el grupo de control |
| Sanders y otros556 | El personal de investigación capacitó a los participantes en ejercicios combinados de caminata y fuerza para una intervención de entrenamiento aeróbico y de fuerza | El personal de atención médica seleccionó a los participantes con demencia leve a moderada en la atención diurna o residencial | ECA (n=91) | No hay efectos sobre la cognición, la resistencia, la movilidad, el equilibrio y la fuerza de las piernas, pero la velocidad de la marcha mejoró después del ejercicio de alta intensidad |
| Harwood y otros562 | Programa personalizado y específico para la demencia progresiva que se centra en la fuerza, el equilibrio, la actividad física y la realización de las actividades de la vida diaria | Intervención realizada por el personal sanitario a personas con demencia leve o deterioro cognitivo leve | ECA (n=365) | No mejoró las actividades de la vida diaria, la actividad física o la calidad de vida, ni redujo las caídas. |
ECA=ensayo controlado aleatorizado. TAP=programa de actividades a medida.
En general, la evidencia apoya ensayos anteriores que muestran que la atención coordinada y los diferentes tipos de actividades y la participación activa redujeron la depresión y los síntomas neuropsiquiátricos y mejoraron el bienestar general en las personas con demencia y, en algunos casos, tuvieron beneficios importantes para los cuidadores, como el ahorro de tiempo en el cuidado. Las intervenciones exitosas orientadas a la actividad tienden a adaptarse a los intereses, preferencias y habilidades de los individuos e involucran al cuidador familiar. La escalabilidad y la implementación de intervenciones de actividades personalizadas, y la posible rentabilidad de estas intervenciones, requieren más investigación, con solo dos estudios que evalúan la relación coste-efectividad. Por el contrario, los ECA del ejercicio como actividad no informaron ninguna mejora en los dominios de salud mental en la comunidad o en los hogares de atención.556, 557
Trastornos del sueño en personas con demencia
La desregulación del ciclo sueño-vigilia es común en las personas con demencia debido a múltiples mecanismos, incluidos los procesos fisiopatológicos que afectan al hipotálamo y al tronco encefálico, la actividad y la luz insuficientes, el dolor, la ansiedad y el medio ambiente.563 En un metanálisis, se informó que la prevalencia combinada de trastornos del sueño clínicamente significativos en personas con demencia que viven en la comunidad fue del 19% (IC del 95%: 13-25; n = 2753), y la prevalencia no ha cambiado con el tiempo, lo que sugiere que el tratamiento no ha mejorado el sueño.564 Los trastornos del sueño fueron menos comunes entre las personas con enfermedad de Alzheimer (24%, 16-33, n=310) que entre las personas con demencia con cuerpos de Lewy (49%, 37-61; n=65). La prevalencia fue similar en un metanálisis de residentes de residencias (55 estudios; n=22 780; 20%, 16-24).565Existe poca evidencia de que la medicación sea efectiva. Una revisión que incluyó nueve ECA,566 cada uno calificado como de baja calidad, identificó evidencia de certeza baja en un ensayo pequeño (n = 30) de que 50 mg de trazadona durante 2 semanas podría aumentar el tiempo total dedicado al ALSEEP (diferencia de medias 42,5 min; IC del 95%: 0,9 a 84,0), pero no hubo un efecto claro sobre otros parámetros del sueño. El uso de un antagonista de la orexina durante 4 semanas en 274 pacientes con enfermedad de Alzheimer leve a moderada aumentó el tiempo de sueño (28,2 min, 11,1 a 45,3) y disminuyó el tiempo de vigilia después del inicio del sueño (-15,7 min, -28,1 a -3,3) sin aumentar los efectos adversos, pero no afectó al número de despertares. No hubo evidencia de la eficacia de la melatonina. No existen ECA de benzodiazepinas, zopiclona, zaleplon o zolpidem para el sueño en personas con demencia, pero estos fármacos podrían causar daños notables. En estudios longitudinales de atención primaria, las dosis más altas de los llamados fármacos Z, como zopiclona, zaleplon, zolpidem (equivalente a ≥7,5 mg de zopiclona o >5 mg de diazepam), en personas con demencia se asociaron con un mayor riesgo de fracturas y accidentes cerebrovasculares, por lo que deben evitarse para este propósito.567 No existe evidencia concluyente de que las intervenciones no farmacológicas mejoren el sueño en la demencia, aunque se están realizando ensayos.568
Depresión
Anteriormente describimos la evidencia de que los antidepresivos no son más efectivos que el placebo para la depresión en personas con demencia.2 Las personas en ambos grupos muestran mejoría, y se podría argumentar que los tratamientos farmacológicos se mantienen en un estándar más alto que las intervenciones no farmacológicas cuando el grupo no intervencionista generalmente recibe el tratamiento habitual. Es probable que la depresión en las personas con demencia difiera de la depresión en las que no tienen demencia, y los cambios cerebrales en los diferentes subtipos de demencia podrían reducir la eficacia de los antidepresivos.569Una revisión Cochrane de ECA de tratamientos psicológicos para la depresión y la ansiedad en pacientes con deterioro cognitivo leve o demencia (es decir, cuatro estudios con terapia cognitivo-conductual, ocho con activación conductual y tres con terapia de resolución de problemas) identificó que los tratamientos basados en terapia cognitivo-conductual añadidos a la atención habitual para los pacientes con demencia o deterioro cognitivo leve y síntomas depresivos o diagnóstico depresivo tuvieron un efecto grande (diferencia de medias estandarizada -0,84, IC del 95%: –1,14 a –0,54; Yo2=24%; cuatro estudios, de los cuales tres fueron terapias de resolución de problemas; 194 participantes), pero hubo poco o ningún efecto en aquellos sin síntomas depresivos o diagnóstico al inicio del estudio.570 Los tratamientos de apoyo y asesoramiento no fueron efectivos.
Psicosis, agitación y delirio
La psicosis puede preceder a la demencia y, como se discutió en la sección de riesgos, la esquizofrenia de inicio muy tardío podría ser un pródromo de demencia.571 Los síntomas psicóticos en la demencia se asocian con una tauopatía particular y una disrupción sináptica neocortical, pero se desconoce si esta patología causa síntomas psicóticos.571 También existe una asociación modesta entre la psicosis en la enfermedad de Alzheimer y la APOE ε4, que no explica todo el riesgo.572Anteriormente discutimos cómo la evaluación clínica integral es esencial en la sospecha de psicosis en la demencia, ya que la memoria errónea experimentada por las personas con demencia es distinta de los delirios, y los nuevos síntomas psicóticos podrían deberse al delirio.1
Si una persona con demencia no está angustiada por la psicosis, es posible que no necesite tratamiento. El tratamiento debe continuar comenzando con intervenciones no farmacológicas para maximizar la estimulación, como mejorar la audición y la vista y aumentar la estimulación social y de otro tipo. Los inhibidores de la colinesterasa tienen un efecto muy pequeño en la mejora de la psicosis en los pacientes con enfermedad de Alzheimer, como lo demuestra un metanálisis de los datos de participantes individuales de 12 ECA de inhibidores de la colinesterasa para los síntomas psicóticos como resultados secundarios en la enfermedad de Alzheimer (tamaño del efecto para los delirios -0,08; IC del 95%: -0,14 a -0,03, I2=0%; alucinaciones 0,09, −0,14 a −0,04; Yo2=0%; n=5580).573 Siguen existiendo advertencias sobre cualquier uso de antipsicóticos, que incluyen un aumento de la mortalidad específica por demencia; Por lo tanto, los antipsicóticos pueden ser apropiados para las personas cuya psicosis crea angustia o deterioro funcional y deben recetarse en una dosis lo más baja posible y durante el menor tiempo posible. Los metanálisis sugieren que la risperidona y el aripiprazol son los antipsicóticos con la mejor evidencia para el tratamiento de la psicosis en pacientes con demencia, con evidencia de que hay menos riesgo de accidente cerebrovascular con risperidona para los delirios que para otras indicaciones.2, 571Un ECA de la retirada de pimavanserina (un antipsicótico atípico con efecto agonista inverso selectivo del 5-HT-2A) en la psicosis relacionada con la demencia se detuvo temprano debido a las tasas más bajas de recaída en el grupo de tratamiento en comparación con el grupo de placebo, que pareció estar impulsado por los efectos en las personas con enfermedad de Parkinson.574 Un estudio de cohorte retrospectivo realizado en Estados Unidos que comparó pimavanserina (n = 3227) con antipsicóticos atípicos (n = 18 442) en personas con enfermedad de Parkinson con o sin demencia informó una tasa de mortalidad más baja en aquellos tratados con pimavanserina (HR 0,65, IC 95% 0,53-0,79).575 Un ECA anterior de eficacia en la psicosis de la enfermedad de Alzheimer mostró diferencias a favor de la pimavanserina en la semana 6, pero no en las semanas 2, 4, 9 o 12.576 La pimavanserina está aprobada como tratamiento para la psicosis en la enfermedad de Parkinson, pero la FDA rechazó el medicamento para el tratamiento de la psicosis relacionada con la demencia y la psicosis de la enfermedad de Alzheimer. Anteriormente recomendábamos, y seguimos recomendando, un enfoque para la evaluación integral y el tratamiento de la agitación en la demencia, que es común, heterogénea, angustiante y se asocia con una mayor carga del cuidador y los costos de la atención.1 La acción inmediata requiere la evaluación de las razones subyacentes de la agitación, como el dolor y la angustia, y el manejo de estas antes del uso de la medicación. Ciertos antipsicóticos, como la risperidona, están autorizados en el Reino Unido, Australia, Canadá y la UE para tratar la agitación en personas con demencia. En mayo de 2023, el brexpiprazol se convirtió en el primer antipsicótico en obtener la aprobación de comercialización de la FDA en EE. UU. para tratar la agitación en personas con enfermedad de Alzheimer, pero no ofrece una mayor eficacia ni seguridad que otros fármacos antipsicóticos atípicos para esta indicación.577, 578 579 Un estudio de fase 3 (n = 433) mostró que el tratamiento con brexpiprazol 2 mg por día para la agitación en personas con enfermedad de Alzheimer se asoció con una mejora en el inventario de agitación de Cohen-Mansfield en 3,77 puntos frente a placebo a las 12 semanas.
578 El ECA de fase 3 más reciente, de 12 semanas, de brexpiprazol de 2-3 mg por día para la agitación en la enfermedad de Alzheimer (n = 345) informó una mejora en el Inventario de Agitación de Cohen-Mansfield en -5,3 puntos en comparación con el placebo.580 En comparación, un análisis combinado de tres ECA de risperidona que utilizaron el Inventario de Agitación de Cohen-Mansfield (n = 1150) mostró que una dosis media de 1 mg/día se asoció con una mejora de -5,4 puntos en el Inventario de Agitación de Cohen-Mansfield a las 12 semanas.581 La principal preocupación con los fármacos antipsicóticos en las personas con demencia es el aumento del riesgo de eventos adversos cardiovasculares y mortalidad.582 El tratamiento con brexpiprazol se asoció con más muertes que el placebo (seis muertes frente a una muerte), aunque no se informó la importancia.580 La risperidona es el antipsicótico atípico con la mayor base de evidencia de ECA en el tratamiento de la agitación. Los antipsicóticos deben usarse solo después de una evaluación y un tratamiento exhaustivos de las causas subyacentes de la agitación, la consideración de un ensayo de estrategias no farmacológicas y una discusión de cualquier riesgo potencial con la persona con demencia y sus cuidadores familiares, dependiendo de la capacidad. El delirio es común, poco reconocido y poco tratado en las personas mayores. Un estudio de cohorte informó que la cognición basal fue menor en las personas mayores (es decir, de ≥70 años) que desarrollaron delirio que en toda la cohorte, incluidas las que no desarrollaron delirio.583 En la Comisión Lancet de 2020, discutimos cómo el delirio y la demencia ocurren con frecuencia juntos, pero no existe evidencia definitiva de que algún medicamento mejore el delirio. Las benzodiacepinas sedantes son ineficaces y, al igual que los antipsicóticos, se asocian con un aumento de la mortalidad y la morbilidad.
2El delirio superpuesto a la demencia se asocia con un mayor tiempo de hospitalización, peores resultados cognitivos y funcionales, y un mayor riesgo de ingreso en residencias y mortalidad.584 Un metaanálisis reciente identificó que el delirio se asoció significativamente con el deterioro cognitivo futuro (tamaño del efecto, Hedges g 0,45, IC 95%: 0,34–0,57).585 En un estudio realizado en el Reino Unido, 209 (13,8%) de 1510 participantes de una cohorte prospectiva con una mediana de edad de 77 años (IQR 73-82) fueron ingresados en el hospital al menos una vez durante un seguimiento de 30 meses o más, de los cuales 115 (55,0%) tuvieron al menos un episodio de delirio.586 Las personas con mayor deterioro cognitivo tenían más probabilidades de ser ingresadas en el hospital y más propensas a desarrollar delirio; Además, el delirio era más severo y prolongado que el de las personas con mejor cognición. De manera similar, en una cohorte prospectiva del Reino Unido de personas mayores de 65 años, 82 (40%) de las 205 personas que ingresaron en el hospital desarrollaron delirio. Este resultado se asoció con un deterioro cognitivo a 1 año de –1,8 puntos (IC del 95%: –3,5 a –0,2) en el MMSE.587 El deterioro cognitivo general es un factor de riesgo para el delirio, que a su vez es un factor de riesgo para un mayor deterioro cognitivo y funcional.588 Es importante tratar el delirio con energía, tanto tratando la enfermedad subyacente como utilizando medios no farmacológicos para aumentar la orientación. La maximización de la visión y la audición, el tratamiento del dolor y la hipoxia, el apoyo a los líquidos y la ingesta de alimentos también son cruciales. Además, es fundamental vigilar la salud de las personas que son dadas de alta hospitalarias con delirio. Estas personas a menudo tienen deterioro cognitivo o demencia y no se puede esperar que inicien y trabajen en un plan de tratamiento en casa sin ayuda. La prevención y el tratamiento del delirio en personas sin demencia podrían disminuir el riesgo de demencia, pero actualmente no podemos estar seguros.589
Lecciones aprendidas de la COVID-19 y la demencia
La COVID-19 por sí sola y el aislamiento social y el confinamiento asociados han tenido un impacto sustancial, desproporcionado y negativo en los síntomas y la mortalidad de las personas con demencia y en sus familias y cuidadores.590 Las personas con demencia tuvieron una mayor mortalidad por COVID-19 (metanálisis de diez estudios; OR 5,17, IC 95% 2,31–11,59; n=119, 218) que las personas sin demencia.591 Una revisión sistemática de los efectos del aislamiento social durante la pandemia de COVID-19 identificó que nueve (60%) de 15 estudios con un total de 6442 participantes informaron un deterioro de la cognición peor de lo esperado y 14 (93%) de 15 estudios informaron un empeoramiento o una nueva aparición de síntomas no cognitivos.592Los residentes de las residencias de ancianos suelen necesitar cuidados personales y, por lo tanto, no pueden estar aislados del personal. Durante la pandemia, con frecuencia se restringió o prohibió la visita de las familias para contener el riesgo, lo que dejó a las personas aisladas.590 593 Los hogares de ancianos más grandes y los hogares que utilizaban más personal de la agencia, transferían al personal de un entorno a otro, se hacían pruebas de detección de la COVID-19 con menos frecuencia y tenían menos acceso a equipos de protección personal tenían niveles más altos de infección y mortalidad.594Las lecciones a largo plazo para otras pandemias incluyen una política que garantice que las personas no sean admitidas en un hogar de ancianos cuando su estado de infección sea positivo o desconocido para evitar exponer a los residentes existentes. Ahora conocemos los efectos positivos de restringir el movimiento del personal de las residencias de ancianos entre hogares y garantizar que el personal tenga acceso prioritario y use equipo de protección personal para reducir la infección. Las personas con demencia requieren acceso a una atención que sea adecuada para ellas, y es imposible aislar completamente a las personas que necesitan atención las 24 horas. Se debe alentar a las personas con demencia a tomar decisiones legales sobre lo que quieren mientras tengan la capacidad de tomar estas decisiones. Como discutimos en detalle en la Comisión Lancet 2020, las personas con demencia a menudo tienen otras enfermedades y mueren antes que las personas sin demencia.2
Las personas con demencia u otra persona que toma decisiones, como un miembro de la familia, si no tienen capacidad para tomar decisiones, deben decidir sobre los posibles cuidados curativos y paliativos, en lugar de tomar decisiones generales para las personas con demencia. Las personas con demencia deben tener el mismo acceso a los cuidados paliativos que el resto de la población.
Tecnología y ejecución de intervenciones
La tecnología tiene varias funciones potenciales en el tratamiento de la demencia, como el diagnóstico y la evaluación, el seguimiento para promover la seguridad, la asistencia en las actividades de la vida diaria y la cognición, la facilitación de la interacción social y las actividades de ocio, y el apoyo a los cuidadores familiares.595 Existe una escasez de investigación de alta calidad sobre tecnologías emergentes, debido a la novedad y a un campo en rápida evolución, lo que significa que la evidencia para su uso es a menudo escasa.Las tecnologías para evaluar los síntomas de la demencia tienen poca evidencia sobre su efectividad. Una revisión de 14 estudios de tecnologías de detección para los síntomas de la demencia mostró que, en siete estudios, la actigrafía se correlacionó con la agitación y la agresión en personas con demencia, pero hubo una ausencia de evidencia para otras tecnologías.596 Una revisión de 55 estudios de evaluaciones de la calidad del sueño en la demencia identificó cinco estudios con actigrafía, pero estos estudios no mostraron ningún beneficio de la actigrafía en comparación con los instrumentos basados en cuestionarios.565Una revisión exploratoria indicó que las tecnologías de hogar inteligente, que son electrodomésticos y dispositivos en el hogar conectados a través de Internet para mejorar el entorno de vida, no están listas para su implementación para las personas con demencia y que no había evidencia clara de eficacia.597 Un ECA en 495 personas con demencia informó que la tecnología de asistencia y la teleasistencia recomendadas por un profesional de la salud o de la asistencia social para satisfacer las necesidades evaluadas no eran mejores que un paquete básico de dispositivos relacionados con la seguridad en términos de tiempo que los participantes permanecían en la comunidad, la carga del cuidador, la depresión o la ansiedad, la atención sanitaria y social o los costos sociales. y años de vida ajustados por calidad.598 En una revisión sistemática de 66 estudios, el uso de robots de asistencia social fue generalmente factible y aceptable para las personas con demencia y sus cuidadores y para los profesionales de la salud, pero no hubo evidencia de efectos sobre la cognición, los síntomas neuropsiquiátricos o la calidad de vida.599En general, no hay evidencia que recomiende tecnologías específicas para el tratamiento de la demencia. En la medida de lo posible, las tecnologías deben complementar en lugar de sustituir la atención presencial existente para evitar que conduzca a un aislamiento social perjudicial. Existe la preocupación de que la tecnología futura pueda reducir la equidad al crear problemas de accesibilidad para las personas con pocos recursos financieros.
Conclusiones
El número de personas que viven con demencia va a aumentar en todos los países, y los responsables políticos deben dar prioridad a los recursos que permitan reducir el riesgo para prevenir o retrasar la demencia y las intervenciones para mejorar los síntomas y la vida de las personas con demencia y sus familias.
El enfoque de prevención debe estar dirigido a abordar los niveles de factores de riesgo en una etapa temprana y continuar durante todo el curso de la vida. Las intervenciones individuales clave son la prevención y el tratamiento de la pérdida de audición, el tratamiento de la pérdida de visión y la depresión, la estimulación cognitiva a lo largo de la vida, la disminución del tabaquismo, la reducción y el tratamiento de los factores de riesgo vascular (es decir, colesterol, diabetes, obesidad y presión arterial), la reducción de las lesiones en la cabeza y el mantenimiento y fomento de la actividad física. Los cambios en las políticas pueden mejorar la educación (tanto en calidad como en años de educación) y reducir el tabaquismo, el consumo de alcohol, el riesgo de traumatismo craneoencefálico, la contaminación del aire y la sal y el azúcar en los alimentos, centrándose así en la obesidad, la hipertensión y la diabetes.
Los cambios estructurales pueden ayudar a aumentar el ejercicio y reducir el aislamiento social. En particular, las intervenciones o cambios en el estilo de vida en cualquier etapa de la vida pueden alterar el riesgo de demencia.
Ahora hay mucha más evidencia de la que existía cuando se publicó la Comisión Lancet de 2020 de que las intervenciones pueden ayudar a mantener la cognición y prevenir la demencia. Estas intervenciones deben estar dirigidas a las personas que más las necesitan. En muchos países, las intervenciones que se sabe que benefician a las personas con demencia no están disponibles o son prioritarias. El diagnóstico de buena calidad, la planificación de la atención y el apoyo posdiagnóstico personalizado permiten la prevención de daños, el tratamiento de los síntomas neuropsiquiátricos y la protección de la calidad de vida de las personas con demencia y sus cuidadores familiares. Existen intervenciones eficaces, pero no se llevan a cabo a gran escala para todos los que se beneficiarían de ellas.
El advenimiento de los fármacos modificadores de la enfermedad para la demencia es un avance científico largamente esperado, pero los resultados varían de modestamente positivos a neutros, y las implicaciones clínicas aún no están claras. Existe un progreso emocionante en el campo de los biomarcadores, pero los biomarcadores no son suficientes por sí solos para justificar el diagnóstico. Clínicamente, los biomarcadores deben usarse solo para ayudar a clasificar la neuropatología en las personas con demencia, particularmente la de la enfermedad de Alzheimer. Los tratamientos farmacológicos y psicosociales están progresando, y hay más personas que nunca viviendo con demencia. Por lo tanto, ahora es aún más importante que se mejore la atención a las personas con demencia y a sus familias.