Dr. Haider J. Warraich1; Troy Tazbaz,1; Dr. Robert M. Califf1
Los avances en materia de inteligencia artificial (IA) deben ir acompañados de esfuerzos para comprender y evaluar mejor el desempeño de la IA en la atención médica y la biomedicina, así como para desarrollar marcos regulatorios adecuados. Esta Comunicación especial analiza la historia de la regulación de la IA por parte de la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA); presenta posibles usos de la IA en el desarrollo de productos médicos, la investigación clínica y la atención clínica; y presenta conceptos que merecen consideración a medida que el sistema regulatorio se adapta a los desafíos únicos de la IA.
Observaciones
La FDA ha autorizado casi 1000 dispositivos médicos habilitados con IA y ha recibido cientos de presentaciones regulatorias para medicamentos que utilizaron IA en su descubrimiento y desarrollo. La regulación de la IA en la salud debe coordinarse entre todas las industrias reguladas, el gobierno de los EE. UU. y con organizaciones internacionales. Los reguladores deberán promover mecanismos flexibles para mantenerse al día con el ritmo de cambio en IA en biomedicina y atención médica. Los patrocinadores deben ser transparentes y los reguladores deben ser competentes en la evaluación del uso de IA en el desarrollo previo a la comercialización. Un enfoque de gestión del ciclo de vida que incorpore un monitoreo recurrente del desempeño local posterior a la comercialización debe ser central para el desarrollo de IA en la salud. Se necesitan mecanismos especiales para evaluar grandes modelos de lenguaje y sus usos. Son necesarios enfoques para equilibrar las necesidades de todo el espectro de intereses del ecosistema de salud, desde grandes empresas hasta empresas emergentes. El sistema de evaluación y regulación deberá centrarse en los resultados de salud del paciente para equilibrar el uso de IA para la optimización financiera para desarrolladores, pagadores y sistemas de salud.
Conclusiones y relevancia
La supervisión estricta por parte de la FDA protege el éxito a largo plazo de las industrias al centrarse en la evaluación para promover tecnologías reguladas que mejoren la salud. La FDA seguirá desempeñando un papel central para garantizar herramientas de IA seguras, efectivas y confiables para mejorar las vidas de los pacientes y los médicos por igual. Sin embargo, todas las entidades involucradas deberán abordar la IA con el rigor que esta tecnología transformadora merece.
Introducción
Las nuevas tecnologías suelen ser consideradas prematuramente como fuerzas transformadoras en la atención de la salud. Aunque muchas herramientas de uso general, como los registros médicos electrónicos (EHR), las tecnologías de salud digital y las plataformas de telemedicina, han sido promocionadas como revolucionarias, la inteligencia artificial (IA) las ha superado a todas en términos de esperanzas, expectativas y preocupaciones. 1 La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) se ha estado preparando durante mucho tiempo para la incorporación de la IA en el desarrollo de productos biomédicos y la atención de la salud. Sin embargo, la IA sigue presentando desafíos y oportunidades únicos. Esta Comunicación Especial analiza la historia de la regulación de la IA por parte de la FDA en las industrias que supervisa y 10 conceptos que merecen consideración a medida que el sistema regulatorio se adapta para abordar esta tecnología en rápida evolución.
Historial de regulación de productos médicos basados en IA por parte de la FDA
La IA es un sistema basado en máquinas que, para un conjunto dado de objetivos definidos por humanos, puede hacer predicciones, recomendaciones o decisiones que influyen en entornos reales o virtuales. 2 , 3 Los sistemas de IA utilizan entradas basadas en máquinas y humanos para percibir entornos reales y virtuales, abstraer dichas percepciones en modelos a través del análisis de manera automatizada y utilizar la inferencia de modelos para formular opciones de información o acción. 2 , 3 En realidad, la IA abarca aplicaciones que van desde algoritmos simples hasta enfoques de aprendizaje automático (ML) y modelos de transformadores enormemente complejos y herramientas de IA generativa. Estas diferencias en complejidad requieren esquemas regulatorios flexibles y basados en el riesgo en estas diversas dimensiones. 4
La primera aprobación de un dispositivo médico parcialmente habilitado con IA por parte de la FDA tuvo lugar en 1995, cuando la FDA aprobó PAPNET, un software que utilizaba redes neuronales para prevenir el diagnóstico erróneo de cáncer de cuello uterino en mujeres que se sometían a pruebas de Papanicolaou. Aunque se demostró que PAPNET era más preciso que los patólogos humanos, no se adoptó en la práctica clínica debido a su inadecuada relación costo-beneficio. 5 Desde entonces, la FDA ha autorizado aproximadamente 1000 dispositivos médicos habilitados con IA, siendo su uso más común en radiología, seguido de cardiología ( Figura 1 ). 6
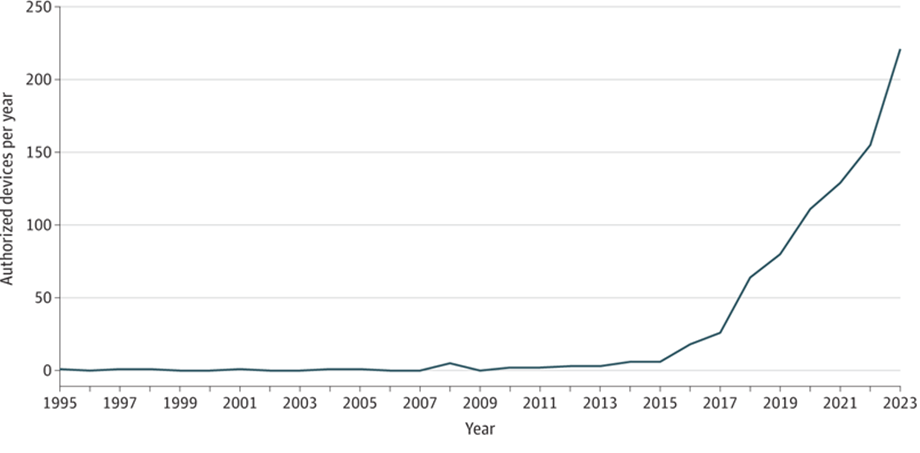
La FDA también ha recibido cientos de solicitudes regulatorias para medicamentos que incluyeron el uso de IA en su descubrimiento y desarrollo. 7 En 2021, se recibieron 132 solicitudes de este tipo, un aumento de diez veces con respecto a 2020. Las aplicaciones más comunes de la IA en el desarrollo de medicamentos incluyen la mejora del descubrimiento y la reutilización de medicamentos, los elementos de diseño de ensayos clínicos, la optimización de dosis, la adherencia a los regímenes farmacológicos, la evaluación de puntos finales y biomarcadores y la vigilancia posterior a la comercialización. Aunque la IA en el desarrollo de medicamentos se utiliza más comúnmente en oncología, le sigue la salud mental, un campo que puede beneficiarse especialmente de las tecnologías de salud digital.
La FDA regula el 20% de la economía estadounidense y debe evolucionar continuamente para supervisar el uso seguro y eficaz de la IA en toda la industria regulada, garantizando el cumplimiento y fomentando la innovación. En enero de 2021, la FDA compartió un plan de acción de 5 puntos para promover el software habilitado para IA y ML, 6,8 que incluía el compromiso de promover un marco regulatorio personalizado para los dispositivos médicos habilitados para IA. Esto se mantuvo en línea con una solicitud posterior del Congreso para que la FDA emitiera un borrador de guía que proporcionara una vía para que los desarrolladores respondieran a la evolución continua de la IA sin tener que volver indebidamente a la FDA para su aprobación.9 En 2022, la FDA también publicó una guía final relacionada con el software de apoyo a la toma de decisiones clínicas, 10 una de varias guías escritas para describir las políticas de la FDA en relación con la definición de dispositivo enmendada por la Ley de Curas del Siglo XXI y el efecto resultante que la definición enmendada tuvo en la supervisión de la FDA de cierto software de dispositivos médicos, que incluía aplicaciones de IA. 11 Más recientemente, los centros de productos médicos de la FDA describieron cuatro áreas de enfoque con respecto al desarrollo y uso de IA en productos médicos: (1) fomentar la colaboración para salvaguardar la salud pública; (2) promover el desarrollo de estándares, directrices, mejores prácticas y herramientas armonizadas; (3) promover el desarrollo de enfoques regulatorios que respalden la innovación; y (4) apoyar la investigación relacionada con la evaluación y el monitoreo del desempeño de la IA. 3
Conceptos pertinentes a la regulación de la IA por parte de la FDA
Regulación de la IA en el contexto más amplio del gobierno estadounidense y del mundo
El enfoque de la FDA se basa en leyes y asignaciones del Congreso y se basa en intereses más amplios del gobierno de los Estados Unidos. 2 La FDA regula las industrias que fabrican y distribuyen productos en los mercados globales; por lo tanto, es importante que las normas regulatorias de los Estados Unidos sean compatibles con las normas globales en la mayor medida posible. La FDA codirige un grupo de trabajo sobre IA del Foro Internacional de Reguladores de Dispositivos Médicos para promover la armonización global de las mejores prácticas de IA. La FDA también lidera grupos de trabajo dentro del Consejo Internacional para la Armonización para modernizar el diseño y la realización de ensayos clínicos mediante la incorporación de enfoques avanzados y proporcionados para la gestión de datos que darían cabida de manera adecuada a la IA en los ensayos clínicos.
Mantenerse al día con el ritmo del cambio en IA
El amplio alcance de la IA y el ritmo de cambio en su desarrollo y adopción plantean interrogantes sobre los marcos regulatorios adecuados para la IA, así como sobre si hay suficiente personal disponible para procesar de manera eficiente el gran volumen de solicitudes de productos basados en IA que se presentan a la FDA. Por lo tanto, el desarrollo, la implementación y el uso de productos basados en IA requerirán un esquema regulatorio adaptativo y basado en la ciencia para prevenir daños y, al mismo tiempo, apoyar la innovación que optimice sus beneficios.
La FDA ya ha sentado las bases para un plan de este tipo para los dispositivos médicos, que utilizan un enfoque de ciclo de vida total del producto ( Figura 2 ). 12 La FDA ha mostrado apertura a programas innovadores para tecnologías emergentes, como el Programa Piloto de Precertificación de Software. Sin embargo, como demostró ese programa, el desarrollo e implementación exitosos de esas vías pueden requerir que se le otorguen a la FDA nuevas autoridades legales. 13 El gran volumen de estos cambios y su impacto también sugiere la necesidad de que la industria y otras partes interesadas externas intensifiquen la evaluación y la gestión de la calidad de la IA en todo el ecosistema más amplio más allá del ámbito de competencia de la FDA.

Este diagrama muestra las fases de un ciclo de vida de desarrollo de software tradicional para la IA. Destaca los métodos sistemáticos relacionados con la evaluación de datos y modelos durante las fases de recopilación y gestión de datos y de creación y ajuste de modelos. También ilustra el seguimiento del software de IA después de la implementación en las fases de operación y seguimiento y evaluaciones del rendimiento en el mundo real. Hay más detalles disponibles a través de la Administración de Alimentos y Medicamentos de los Estados Unidos
Enfoques flexibles en todo el espectro de modelos de IA
El Congreso ha especificado diferentes niveles de regulación para los dispositivos médicos, lo que permite la regulación de los dispositivos médicos habilitados con IA en un enfoque basado en el riesgo. En un extremo del espectro se encuentran los modelos que respaldan el comportamiento saludable y las funciones administrativas que no están reguladas por la FDA, por ejemplo, algunas aplicaciones de IA que automatizan las operaciones generales de la oficina de atención médica. En el otro extremo están los modelos integrados en dispositivos médicos tradicionales, como los desfibriladores cardíacos, que están claramente regulados. Los modelos utilizados para el apoyo a la toma de decisiones clínicas se encuentran en el medio, donde el grado de riesgo informa la aplicación de los requisitos regulatorios por parte de la FDA, en particular cuando la base para el resultado del algoritmo no puede ser descifrada en una explicación mecanicista por un médico. 10 Estos enfoques regulatorios basados en el riesgo necesitarán una consideración y adaptación cuidadosas.
Una aplicación práctica de este esquema es la autorización de comercialización otorgada a Sepsis ImmunoScore (Prenosis, Inc.), un algoritmo de IA al que se le otorgó una clasificación de novo como dispositivo de Clase II. 14 El software identifica a los pacientes en riesgo de tener o desarrollar sepsis utilizando 22 datos predeterminados de los registros médicos electrónicos para generar una puntuación de riesgo, aunque no debe utilizarse como única base para determinar la presencia o el riesgo de sepsis. Dados los riesgos potenciales, que incluyen fallas del algoritmo, sesgo del modelo, confianza excesiva del médico, interpretación incorrecta o datos deficientes, se establecieron controles especiales para proporcionar una garantía razonable de su seguridad y eficacia. Estas medidas de mitigación incluyeron pruebas de rendimiento clínicas y no clínicas, verificación del software, validación y análisis de riesgos, etiquetado, evaluación de factores humanos, características tecnológicas y gestión posterior a la comercialización, incluida la evaluación continua del rendimiento.
El uso de la IA en el desarrollo de productos médicos
El potencial de la IA para informar sobre múltiples aspectos del desarrollo de productos médicos es profundo y ya está en marcha ( Recuadro 1 ). 22 Aunque no respalda específicamente ninguna práctica en particular, la FDA ve un gran potencial en la aplicación de la IA en el desarrollo de medicamentos y la investigación clínica. Al igual que con cualquier producto médico, un elemento clave de la regulación es que el producto final destinado a su uso debe evaluarse en estudios clínicos adecuados y bien controlados para demostrar empíricamente que los beneficios del producto superan sus riesgos para ese uso previsto. Los revisores de la FDA deben tener un conocimiento profundo de la disciplina para poder revisar adecuadamente las solicitudes que se envían para aprobación de comercialización, por ejemplo, solicitudes en las que se envían para aprobación estrategias de intervención o selección de objetivos asistida por IA. Por lo tanto, mantener una fuerza laboral con experiencia técnica y conocimiento del progreso en IA será crucial para la capacidad de la agencia de proporcionar orientación útil y oportuna a la industria a medida que se desarrollan los productos.
Selección de usos actuales y potenciales de la inteligencia artificial (IA) en el desarrollo de fármacos
Identificación, selección y priorización de dianas farmacológicas
- Analizar fuentes de datos complejas y dispares para fundamentar la selección de objetivos biológicos. 15
- Extraer y analizar grandes conjuntos de datos multiómicos y de otro tipo para proporcionar información sobre la estructura y la función de los objetivos para predecir su papel en las vías de las enfermedades. 16 , 17
Selección y diseño de compuestos
- Predecir la eficacia y los eventos adversos en función de la especificidad y la afinidad de los compuestos por un objetivo. 18 , 19
- Predecir clases de medicamentos que potencialmente interactúan con los mismos objetivos o con un mecanismo de acción similar, lo que podría ayudar a predecir la toxicidad de las moléculas.
- Contribuir a la reutilización de medicamentos mediante el análisis de datos de diversas fuentes (por ejemplo, registros médicos electrónicos, registros y tecnologías de salud digital) para identificar efectos previamente desconocidos de los medicamentos sobre las vías de transmisión de enfermedades. 20
Modelado de farmacocinética y farmacodinámica
- Analizar datos de series temporales para complementar modelos farmacocinéticos y farmacodinámicos. 21
- Ayudar en la optimización de la dosis en poblaciones especiales con datos limitados (por ejemplo, enfermedades raras, poblaciones pediátricas y embarazadas).
Fabricación farmacéutica avanzada
- Optimice el diseño de procesos e implemente un control de procesos avanzado, monitoreo inteligente y monitoreo de mantenimiento y tendencias.
Hay detalles adicionales disponibles a través de la Administración de Alimentos y Medicamentos de EE. UU .
El papel de la IA en el desarrollo de productos médicos no se limita sólo al contexto previo a la comercialización, sino que también incluye la investigación clínica, así como la vigilancia y evaluación posteriores a la comercialización ( Recuadro 2 ). 22 , 40 , 41 Al analizar grandes cantidades de datos del mundo real, los sistemas de IA pueden detectar patrones y anomalías que pueden mejorar la capacidad de encontrar posibles problemas de seguridad, beneficios inesperados o ineficiencias de rendimiento. Este enfoque proactivo puede permitir una identificación más rápida de eventos adversos, lo que conduce a intervenciones y correcciones más oportunas. Además, la IA puede sintetizar el análisis de ensayos clínicos, la vigilancia posterior a la comercialización y la retroalimentación de los pacientes, proporcionando una visión general completa del ciclo de vida de un producto en áreas que anteriormente estaban separadas. Esto podría mejorar la seguridad del paciente al tiempo que acelera la innovación de productos médicos.
Selección de usos actuales y potenciales de la inteligencia artificial (IA) en la investigación clínica
Reclutamiento de participantes
- Extraer datos de bases de datos de ensayos clínicos, anuncios de ensayos, redes sociales, literatura médica, registros y datos estructurados y no estructurados en registros y registros médicos electrónicos para vincular a las personas con los ensayos. 23
- Garantizar una representación adecuada de las poblaciones que probablemente usen el producto médico (por ejemplo, por género, raza y etnia, etc.) a medida que se crean algoritmos de coincidencia y para confirmar el logro de una inclusión equitativa.
Selección y estratificación de los participantes y los sitios del ensayo
- Predecir el resultado clínico de un participante individual basándose en las características iniciales para enriquecer los ensayos clínicos, 24 , 25 reducir la variabilidad y aumentar el poder del estudio. 26
- Estratificar a los pacientes en diferentes grupos y estrategias de seguimiento en función de la probabilidad prevista de eventos adversos graves.
- Evalúe el rendimiento del sitio y determine cuál puede estar retrasado según datos anteriores.
Adherencia y retención
- Mejorar la adherencia durante un ensayo clínico a través de herramientas como alertas y recordatorios en teléfonos inteligentes, seguimiento electrónico de medicamentos (por ejemplo, pastilleros inteligentes y herramientas para confirmación visual) y visitas clínicas perdidas, que activan alertas de incumplimiento. 27
- Utilice biomarcadores digitales (por ejemplo, expresividad facial y vocal) para monitorear la adherencia de forma remota.
- Mejore el acceso de los participantes a la información del ensayo habilitando herramientas como chatbots de inteligencia artificial, asistencia de voz y búsqueda inteligente.
- Reducir la carga de los participantes mediante la recopilación pasiva de datos y la extracción de más información de los datos disponibles generados durante la práctica clínica o mediante actividades de estudio. 16
Recopilación, gestión y análisis de datos de ensayos clínicos
- Identificar nuevas características de las condiciones 28 o predecir el estado y la respuesta al tratamiento de una enfermedad crónica. 29
- Evaluar datos multimodales y medidas compuestas. 30
- Armonizar la limpieza de datos, la detección de duplicados, la terminología controlada y la imputación. 31
- Mejorar la conservación de datos mediante el enmascaramiento y la desidentificación de información personal identificable, la creación de metadatos y la búsqueda y recuperación de datos almacenados.
- Evaluar los fármacos candidatos y sus resultados utilizando cohortes virtuales con variabilidad de rasgos que representan la población deseada. 32
- Utilice gemelos digitales para generar registros clínicos simulados para predecir la respuesta del grupo placebo.
- Detectar grupos de síntomas para identificar señales de seguridad. 33 , 34
Vigilancia y evaluación de la seguridad poscomercialización
- Detectar y evaluar asociaciones de eventos adversos a partir de la literatura médica y las redes sociales. 35 , 36
- Identificar eventos adversos para la presentación de informes de seguridad de casos individuales.
- Determinar la validez del caso evaluando los requisitos mínimos de presentación de informes y ayudando a priorizar los casos según lo esperado. 37
- Codifique los informes de seguridad de casos individuales en diccionarios médicos estructurados. 38
- Clasificar la probabilidad de una relación causal entre medicamentos y eventos adversos. 35
- Facilitar la presentación de informes de seguridad de casos individuales y agregados. 39
Hay detalles adicionales disponibles a través de la Administración de Alimentos y Medicamentos de EE. UU .
Preparación para lo desconocido de los grandes modelos lingüísticos y la IA generativa
Las aplicaciones de la IA generativa, como los modelos de lenguaje extenso (LLM), presentan un desafío único debido al potencial de consecuencias imprevistas y emergentes; la FDA aún no ha autorizado un LLM. Sin embargo, muchas aplicaciones propuestas en el ámbito de la atención médica requerirán la supervisión de la FDA dado su uso previsto para el diagnóstico, tratamiento o prevención de enfermedades o afecciones. Incluso los “escritores de IA” destinados a resumir notas médicas pueden alucinar o incluir diagnósticos no discutidos en la visita. La complejidad de los LLM y las permutaciones de los resultados requieren la supervisión de personas e instituciones, además de las autoridades regulatorias. Debido a que no podemos sobrecargar indebidamente a los médicos individuales con dicha supervisión, 42 existe la necesidad de herramientas especializadas que permitan una mejor evaluación de los LLM en los contextos y entornos en los que se utilizarán. Dichas herramientas podrían desarrollarse desde cero o adaptarse a partir de herramientas de evaluación de LLM existentes, por ejemplo, DeepEval y MLflow. A medida que las aplicaciones de los LLM avanzan hacia el apoyo a la toma de decisiones para los médicos, pero también para los pacientes 43 , 44 que conllevan un riesgo significativo, puede ser prudente comenzar con áreas con el cuerpo de evidencia más profundo que respalde la toma de decisiones clínicas, por ejemplo, cardiología, oncología y en flujos de trabajo clínicos de menor riesgo donde hay tiempo para evaluar sus resultados. Los LLM también tienen un gran potencial para elevar la utilidad de las tecnologías existentes, como los EHR 45 y las tecnologías de salud digital ponibles. 43 Por lo tanto, existe la necesidad de innovación regulatoria en este espacio para permitir tanto el análisis de estas fuentes de información como la integración en la toma de decisiones clínicas. La participación proactiva entre los desarrolladores, los médicos, los líderes del sistema de salud y los reguladores en plataformas como el Comité Asesor de Salud Digital de la FDA será fundamental.
La importancia central de la gestión del ciclo de vida de la IA
Dada la capacidad de los modelos “desbloqueados” para evolucionar y la sensibilidad de la IA a los cambios contextuales, resulta cada vez más evidente que el desempeño de la IA debe ser monitoreado en el entorno en el que se está utilizando. Esta necesidad de monitoreo del desempeño de la IA después de su comercialización tiene profundas implicaciones para la gestión de la información por parte de los sistemas de salud y las prácticas clínicas. Para estar a la altura de las circunstancias, los sistemas de salud deberán proporcionar un ecosistema de información muy similar al que se usa para monitorear a un paciente en la unidad de cuidados intensivos. Las herramientas y circunstancias de esta evaluación continua deben ser recurrentes y lo más cercanas a lo continuo posible, y la evaluación debe realizarse en el entorno clínico en el que se está utilizando. Conceptos como los laboratorios de control externo 46 o la validación localizada específica del sitio 47 son prometedores, pero, dada la complejidad del tema, se necesitan más enfoques y herramientas para refinar aún más la evaluación de la IA porque un sistema de IA no monitoreado implementado en la práctica podría causar un daño significativo.
Las responsabilidades de las industrias reguladas
Las industrias reguladas por la FDA deben cumplir con todas las leyes y requisitos aplicables del marco regulatorio administrado por la agencia. Se proporciona una interpretación adicional mediante guías que reflejan el pensamiento actual de la agencia, pero no son vinculantes para la FDA ni para el público. En esencia, la regulación de la FDA comienza con el cumplimiento voluntario por parte de las propias industrias reguladas. Por ejemplo, la FDA revisa los estudios que normalmente son financiados por la industria, pero no realiza ensayos clínicos. Por lo tanto, el concepto de que la regulación de la IA en el desarrollo y la aplicación de productos médicos para productos que supervisa la FDA comienza con una conducta responsable y una gestión de la calidad por parte de los patrocinadores no difiere fundamentalmente del régimen regulatorio general de la FDA.
Además de la evaluación de la seguridad, es importante evaluar si las aplicaciones de IA aportan beneficios para la salud a los pacientes cuando se utilizan para informar, gestionar o tratar a los pacientes. Incluso el apoyo a la toma de decisiones clínicas, si está sistemáticamente sesgado, puede mejorar o reducir la precisión de la toma de decisiones clínicas. 48 Sin embargo, actualmente ni la comunidad de desarrollo ni la comunidad clínica están totalmente equipadas para la evaluación local y recurrente de la IA a lo largo de su ciclo de vida. Los sistemas de salud podrían cumplir esta función, pero actualmente sus sistemas de información clínica no pueden supervisar la seguridad y la eficacia continuas y a largo plazo de estas intervenciones. La evaluación precisa del rendimiento del modelo en un producto médico después de su implementación requiere un rigor similar al de la evaluación previa a la comercialización. Por ejemplo, esto incluye un seguimiento diligente de la población de pacientes pertinente porque normalmente se encuentra información valiosa en aquellos pacientes que se pierden durante el seguimiento debido a la muerte u otros resultados adversos.
La evolución de la IA ilustra un importante dilema de calidad y regulación. Dado que la seguridad y la eficacia de muchos modelos de IA dependen de la evaluación recurrente de sus características operativas, la escala de esfuerzo necesaria podría estar más allá de cualquier esquema regulatorio actual. En el caso de los productos médicos tradicionales, que generalmente siguen siendo los mismos sin importar dónde se distribuyan, los estudios adecuadamente sólidos para una indicación específica pueden brindar garantía de seguridad y eficacia del producto para la población estadounidense, pero esto puede no ser necesariamente el caso de muchos productos médicos habilitados con IA dada su sensibilidad contextual. Por lo tanto, esta es un área importante que requiere un escrutinio minucioso a medida que la IA se vuelve más rutinaria.
Mantener cadenas de suministro sólidas
Los modelos de IA probablemente desempeñen un papel crucial en la gestión de las cadenas de suministro, pero también podrían ser vulnerables a las interrupciones y la escasez. Por lo tanto, es fundamental considerar su doble papel en las cadenas de suministro. Las cadenas de suministro de todos los productos regulados por la FDA se han vuelto cada vez más complejas, globales y centradas en la eficiencia, definida por atributos como la entrega «justo a tiempo» y el inventario mínimo. Este sistema funciona bien cuando la situación es estable, pero los shocks de demanda o oferta causados por desastres naturales, guerras, dificultades económicas o incertidumbre en la fabricación crean escasez, con poca resiliencia en el sistema para permitir una recuperación rápida. Aunque los elementos del inventario y el flujo de la cadena de suministro se mantienen como información confidencial, cuando se producen escasez, la FDA y otras entidades gubernamentales luchan por establecer conexiones entre competidores para proporcionar los suministros necesarios. El uso de modelos de IA sofisticados y el taponamiento de los agujeros en los datos para anticipar o responder rápidamente a la escasez podrían mejorar tanto la escasez de medicamentos genéricos como la calidad y la estabilidad del suministro de dispositivos de bajo costo. Además, minimizar la vulnerabilidad a las amenazas de ciberseguridad y desarrollar copias de seguridad resilientes en caso de interrupciones tecnológicas deben ser parte integral de estas tecnologías.
Encontrar el equilibrio entre las grandes empresas tecnológicas, las empresas emergentes y el mundo académico
El campo de los productos de IA comerciales, especialmente la IA generativa, está dominado por grandes empresas tecnológicas que cuentan con el capital, los recursos computacionales y la experiencia necesarios para su desarrollo. Al mismo tiempo, muchas empresas emergentes y emprendedores están ingresando al campo, mientras que las instituciones académicas están repletas de ideas que podrían contribuir al progreso. Esto también se relaciona con la diversidad de sitios donde se podría utilizar la IA. Entre los numerosos desafíos estará la abrumadora tarea de determinar formas para que todos los desarrolladores, incluidas las pequeñas entidades, garanticen que los modelos de IA sean seguros y efectivos a lo largo de todo el ciclo de vida del producto en diversos entornos. La mayoría de los programas actuales de la FDA tienen iniciativas especiales para apoyar a las pequeñas empresas y al mundo académico que también se aplicarían a la IA.
La tensión entre el uso de la IA para optimizar los rendimientos financieros y la mejora de los resultados sanitarios
Cuando las instituciones y los sistemas de salud compran o invierten en el desarrollo de tecnología de IA, es comprensible que la rentabilidad de la inversión sea un factor clave. Lamentablemente, la relación entre optimizar las finanzas y mejorar los resultados de salud para los pacientes y las comunidades es compleja y, a veces, contradictoria. Debido a los incentivos potencialmente conflictivos, optimizar las decisiones para obtener mejores resultados para los pacientes podría resultar en una desventaja financiera para los sistemas de salud, las organizaciones de proveedores o las compañías de seguros.
Aunque la FDA no regula la práctica de la medicina, tiene la firme misión de promover la salud pública y la innovación biomédica. Por lo tanto, existe la preocupación de que un enfoque desproporcionado de las aplicaciones de IA en el rendimiento financiero de la inversión podría perjudicar los resultados de los pacientes y reducir la aceptación y la confianza en esta tecnología. Muchas innovaciones de IA que podrían beneficiar a los pacientes pueden tener el precio de los empleos tradicionales, las estructuras de capital y los flujos de ingresos en la atención médica. Sin embargo, demasiados residentes de los EE. UU. viven en desiertos de atención médica, 49 con escasez de atención primaria incluso en muchas áreas con gran densidad de médicos, y los algoritmos de IA podrían señalar más servicios preventivos que actualmente no son rentables. Además, la IA podría mejorar significativamente la eficiencia de los servicios clínicos, liberando así a los médicos para hacer lo único que, en última instancia, ninguna máquina puede: forjar una conexión humana con el paciente. 50 Sin embargo, es necesario tener cuidado para garantizar que la capacidad de la IA para optimizar los procesos no se utilice para reducir aún más la interacción humana al comprimir aún más la interacción entre paciente y médico. Los médicos son el puente entre esta tecnología y los pacientes, y pueden desempeñar un papel importante en la defensa de evidencia de alta calidad sobre los beneficios para la salud que fundamentan la aplicación clínica de la IA.
Será necesario centrarse deliberadamente en los resultados sanitarios para superar la presión de poner énfasis en prácticas que conducen a una suboptimización del sistema de atención sanitaria, 51 los riesgos adversos de la financiarización, 52 y el bloqueo de datos. El mandato de la FDA de salvaguardar y promover la salud de las personas y la salud pública ejercerá presión sobre el sistema, pero la necesidad de una amplia colaboración para un avance colectivo responsable se extiende más allá de la FDA.
Conclusiones
Los avances históricos en IA aplicada a la biomedicina y la atención de la salud deben ir acompañados de esfuerzos complementarios continuos para comprender mejor cómo funciona la IA en los entornos en los que se implementa. Esto implicará un enfoque integral que llegue mucho más allá de la FDA y abarque los ecosistemas de consumo y atención de la salud para seguir el ritmo del progreso técnico cada vez más acelerado. De lo contrario, existe el riesgo de que la IA decepcione de manera similar a otras tecnologías de propósito general implementadas en entornos de atención de la salud o incluso genere un daño significativo si el rendimiento de los modelos no atendidos se deteriora o se centra en el rendimiento financiero sin prestar la debida atención al impacto en los resultados clínicos.
La supervisión estricta por parte de la FDA y otras agencias tiene como objetivo proteger el éxito a largo plazo de los productos regulados manteniendo un alto grado de confianza pública en el espacio regulado.
A las industrias biomédica, digital y de atención de la salud les conviene identificar y abordar a los actores irresponsables y evitar hipérboles engañosas. Las industrias reguladas, el mundo académico y la FDA tendrán que desarrollar y optimizar las herramientas necesarias para evaluar la seguridad y la eficacia actuales de la IA en la atención de la salud y la biomedicina.
La FDA seguirá desempeñando un papel central, centrándose en los resultados sanitarios, pero todos los sectores involucrados tendrán que ocuparse de la IA con el cuidado y el rigor que merece esta tecnología potencialmente transformadora.