
Se ha sostenido que el análisis de la relación coste-efectividad de los productos farmacéuticos de marca sólo tiene en cuenta la eficiencia estática, descuida los efectos dinámicos y socava los incentivos para la innovación socialmente valiosa.
Presentamos un marco para diseñar una política de precios de productos farmacéuticos con el fin de lograr una eficiencia dinámica.
Desarrollamos un marco coherente que identifica los beneficios y los costes estáticos y dinámicos a largo plazo de ofrecer a los fabricantes diferentes niveles de recompensa. La proporción de valor que maximizaría la salud de la población a largo plazo depende de cómo la cantidad y la calidad de la innovación responden al pago.
Utilizando evidencia de la respuesta de la innovación al pago, la proporción óptima de valor de los nuevos productos farmacéuticos que se ofrece a los fabricantes es de aproximadamente el 20% (rango: 6%–51%). Un nuevo análisis de una muestra de valoraciones de tecnología del NICE sugiere que, en la mayoría de los casos, la proporción de valor ofrecida a los fabricantes y la prima de precio pagada por el NHS inglés fueron demasiado altas.
En el Reino Unido, la aplicación de proporciones óptimas ofrecería beneficios considerables tanto en el marco de un objetivo de salud pública como de una visión más amplia del bienestar social.
Ilustramos cómo se puede entregar una porción óptima del valor a través de una variedad de mecanismos de pago, incluida la regulación indirecta de precios mediante el uso de diferentes normas de aprobación por parte de un organismo de evaluación de tecnologías sanitarias.
Los responsables de las políticas, los pagadores y la industria farmacéutica han debatido durante mucho tiempo cómo fijar el precio de los nuevos productos farmacéuticos para aportar valor al sistema sanitario, incentivando al mismo tiempo a los fabricantes a invertir en el desarrollo de nuevos productos. Sin embargo, los organismos de evaluación de tecnologías sanitarias (ETS) han tendido a centrarse en si un nuevo tratamiento es rentable o no en comparación con alguna norma de aprobación declarada o implícita, o un «umbral» de coste-eficacia, que representa el coste adicional máximo por AVAC ganado que se considera aceptable. Esto sirve como una forma de regulación indirecta de los precios, ya que los fabricantes suelen fijar precios u ofrecer descuentos para garantizar que el coste por AVAC de su producto sea igual al «umbral» declarado o implícito durante el periodo restante de protección de la propiedad intelectual (PPI). Sin embargo, por lo general no se tienen en cuenta el valor a largo plazo del producto después de la PPI (si los precios caen con la entrada de genéricos) ni la evidencia de cómo la cantidad y la calidad de la innovación responden a los pagos ofrecidos (Neumann et al., 2022 ).
Esto ha llevado a algunos a argumentar que el análisis de costo-efectividad, y las decisiones de los organismos de evaluación de tecnologías sanitarias que informa, tienden a centrarse en la eficiencia estática, descuidan los efectos dinámicos y socavan los incentivos para la innovación socialmente valiosa (Jena y Philipson, 2008 ; Moreno y Ray, 2016 ). Otros se han basado en la teoría de la innovación de Nordhaus (William D. Nordhaus, 1969a , 1969b ) para argumentar que, en la medida en que los fabricantes afrontan el costo total de la investigación y el desarrollo, también deberían ser recompensados con los beneficios completos; y que esto se puede lograr (al menos dentro del período restante de la PPI) adoptando un umbral de costo-efectividad que refleje el valor del consumo de salud basado en evidencia de la disposición individual a pagar (Danzon et al., 2015 ; Jena y Philipson, 2008 ; Lakdawalla, 2018 ; Lakdawalla y Sood, 2012 ; Vernon et al., 2009 ). Sin embargo, esto no aborda directamente cuál debería ser el nivel de recompensa, ya que supone implícitamente que el período de la PPI ya es óptimo. Otros han considerado la dinámica global de los precios farmacéuticos, las implicaciones de los controles de precios y las implicaciones del fortalecimiento de la PPI, todo desde una perspectiva similar (Bennato y Giulietti, 2019 ; Chu, 2008 ; Council of Economic Advisers, 2019 ; Egan y Philipson, 2013 ; Filson, 2012 ; Gigi, Emma van, Jennifer y Jeffrey, 2017 ; Goldman et al., 2011 ; Lakdawalla et al., 2008 ; Santerre y Vernon, 2006 ). Algunos han argumentado que es la evidencia del costo de oportunidad de salud asociado con el gasto en atención médica, en lugar de la disposición individual a pagar, lo que representa el precio máximo que los sistemas de atención médica pueden permitirse pagar por los beneficios de una innovación durante la PPI, al tiempo que reconocen que esto solo es dinámicamente eficiente si el período de la PPI ya se considera óptimo (Claxton, 2007 ; Claxton et al., 2008 ). Otros han sugerido que las normas de aprobación deberían establecerse para maximizar los efectos netos en la salud, teniendo en cuenta los costos de oportunidad de salud asociados con el gasto en atención médica, pero no han tenido en cuenta el valor a largo plazo en el período posterior a la PPI si y cuando los precios caen con la entrada de genéricos (Pandey et al., 2018 ), o no han tenido en cuenta los efectos dinámicos del pago sobre la innovación (Paulden, 2023 ).
Ninguna de esta literatura ha intentado incorporar el creciente cuerpo de evidencia de cómo la cantidad y la calidad de la innovación farmacéutica responde al pago (Acemoglu y Linn, 2004 ; Adams, 2021 ; Bennette et al., 2019 ; Blume-Kohout y Sood, 2013 ; Cerda, 2007 ; Dubois, de Mouzon, Scott-Morton y Seabright, 2015 ; Finkelstein, 2004 ; Myers y Pauly, 2019 ; Rake, 2017 ; Toole, 2012 ) para identificar el nivel óptimo de recompensa para los fabricantes que explica el valor a largo plazo más allá del IPP, al tiempo que se distingue cuidadosamente el valor del consumo de salud y los costos de oportunidad de salud asociados con el gasto en atención médica. De igual modo, la literatura empírica no ha estimado el efecto probable del pago sobre los resultados de salud, u otros argumentos de bienestar, para identificar qué nivel de pago podría ser óptimo y evaluar qué políticas de precios o normas de aprobación permitirían realizar este pago.
El objetivo de este trabajo es desarrollar un enfoque coherente y basado en evidencias para las políticas de fijación de precios de productos farmacéuticos y los mecanismos de pago con el fin de lograr una eficiencia dinámica que: (i) tenga en cuenta el valor a largo plazo de los productos farmacéuticos más allá de la PPI; (ii) incorpore la evidencia de cómo la cantidad y la calidad de la innovación responden a los niveles de pago; y (iii) distinga las normas de aprobación, la disposición a pagar por los beneficios de salud y los costos de oportunidad de salud asociados con el gasto en atención médica (Claxton et al., 2015 ). Mostramos cómo este análisis se puede generalizar a otros aspectos de los beneficios más allá de la salud, incluidas las implicaciones de tener en cuenta el valor potencial asociado con cualquier excedente del productor (las ganancias supernormales de los fabricantes) que se pueda retener.
Aplicamos este marco a una muestra publicada previamente de evaluaciones de tecnología realizadas por NICE (Woods et al., 2021 ). Mostramos cómo se puede utilizar para identificar la parte óptima del valor a largo plazo de un nuevo fármaco que se debe ofrecer a los fabricantes, condicionada a los juicios sobre la evidencia empírica. Mostramos cómo la parte óptima del valor se puede traducir en un pago general a los fabricantes. Un pago óptimo se puede entregar de varias maneras. Por ejemplo, podría entregarse modulando las normas de aprobación aplicadas por los organismos de HTA durante el IPP, cambiando la duración del IPP, asegurando compromisos de precios más bajos más allá del período del IPP, así como modelos de suscripción donde limitar el uso generalizado temprano puede ser importante (por ejemplo, nuevos antimicrobianos). Aunque ilustramos las implicaciones utilizando datos del Reino Unido como estudio de caso, los principios desarrollados son generalizables a través de jurisdicciones y tipos de sistema de atención médica.
2 EVIDENCIA DE CÓMO LA INNOVACIÓN RESPONDE AL NIVEL DE PAGO
Se realizó una revisión sistemática para identificar artículos que cuantificaran los efectos del pago en la innovación (véase la Información complementaria S1 ). Se identificaron 29 artículos que cuantificaban el efecto del pago (a través del precio, el tamaño del mercado o la duración de la patente) en los resultados de la innovación (cantidad y calidad de la innovación farmacéutica) o en los insumos/actividades (gasto en I+D o número de ensayos clínicos). Se consideró que nueve estudios eran particularmente relevantes para la pregunta de investigación, ya que estimaban un efecto causal plausible o sólido de acuerdo con los criterios especificados en la Información complementaria S1 y utilizaban medidas de resultados de la innovación en lugar de medidas de insumos o actividades que no se relacionan fácilmente de manera cuantitativa con los resultados de la innovación.
Los nueve estudios proporcionaron evidencia causal plausible o sólida que relacionaba el pago con la cantidad de innovación (ver Información complementaria S1 : Tabla 1). Seis de los estudios (Acemoglu y Linn, 2004 ; Cerda, 2007 ; Dubois et al., 2015 ; Myers y Pauly, 2019 ; Rake, 2017 ; Toole, 2012 ) estimaron elasticidades examinando la relación entre las variaciones impulsadas demográficamente en el tamaño del mercado (que se argumentó que eran plausiblemente exógenas) y nuevas entidades moleculares a lo largo del tiempo, y por área de enfermedad. Tres estudios (Bennette et al., 2019 ; Blume-Kohout y Sood, 2013 ; Finkelstein, 2004 ) examinaron los efectos de las políticas, que se esperaba que tuvieran efectos diferenciales por área de enfermedad, sobre nuevas entidades moleculares y aprobaciones de medicamentos en esas áreas de enfermedad. Como se muestra en la Información complementaria S1 ; Los resultados de los estudios muestran un grado muy alto de heterogeneidad y asimetría en el gráfico de embudo (es decir, los estudios con los intervalos de confianza más amplios en torno a las estimaciones de elasticidad también tienen las estimaciones puntuales más altas). La razón de esto no está clara, pero podría estar relacionada con el sesgo de publicación, los sesgos de informe o la calidad metodológica. En estas circunstancias, cualquier metanálisis puede considerarse inadecuado, y el uso de métodos basados en regresión para ajustar los sesgos potenciales solo se recomienda cuando hay un mayor número de estudios (Higgins et al., 2022 ).
Teniendo en cuenta estas preocupaciones, presentamos nuestros resultados para una variedad de elasticidades a las que se ha hecho referencia en el reciente debate de políticas sobre precios farmacéuticos adecuados. Como nuestra estimación central, utilizamos el reciente análisis de la Oficina de Presupuesto del Congreso (CBO) del impacto potencial de la Ley de Costos Más Bajos de Medicamentos Ahora (HR 3) (Adams, 2021 ). La CBO proporciona análisis independientes para respaldar el proceso presupuestario del Congreso de los EE. UU. El informe de la CBO utiliza un modelo de simulación del desarrollo de medicamentos calibrado utilizando datos confidenciales de gasto en medicamentos de Medicare y datos publicados sobre los costos de I + D farmacéuticos. El modelo predice el impacto de HR 3 en las decisiones de desarrollo de medicamentos de fase I, II y III y cómo esto influye en el número de medicamentos que ingresan al mercado a lo largo del tiempo. Los hallazgos son consistentes con una elasticidad promedio de largo plazo de 0,45 que relaciona el número de medicamentos que ingresan al mercado con los cambios en los ingresos globales (es decir, un aumento del 1% en los ingresos globales aumenta el número de medicamentos que ingresan al mercado en un 0,45%).
También probamos las implicaciones de usar una elasticidad más baja y una más alta. Una elasticidad más baja de 0,23 se basa en Dubois et al. ( 2015 ), que se incluyó en nuestra revisión. Entre los estudios incluidos en la revisión, este estudio fue particularmente relevante ya que utiliza datos de ingresos (en lugar del tamaño estimado del mercado) y considera el efecto de los ingresos globales. El potencial de causalidad inversa, por el cual el pago es una consecuencia de la innovación, se aborda a través de variables instrumentales basadas en datos demográficos y de ingresos. Una elasticidad más alta se basa en el valor utilizado por Philipson y Durie (Philipson & Durie, 2021 ) en su análisis de HR3. Los autores utilizan un valor de caso base de 1,5 basado en un promedio no ponderado de elasticidades tomadas de una selección de estudios publicados que relacionan los cambios en los ingresos con los cambios en nuevos medicamentos o el gasto en I+D.
Solo un estudio identificado a través de la revisión proporcionó evidencia del efecto del pago en la calidad de la innovación (Bennette et al., 2019 ). Bennette et al. estimaron el efecto de un cambio en el pago a través de la aprobación de la Parte D de Medicare tanto en la cantidad de nuevos medicamentos oncológicos aprobados como en su calidad, medida como mejoras esperadas en la supervivencia media. Este estudio indicó que, por cada aumento del 1% en la cantidad de innovación debido al pago, la calidad de las innovaciones (ganancias de supervivencia) cae un 0,56% en promedio. Esta dirección del efecto es consistente con los rendimientos decrecientes de los esfuerzos de investigación y desarrollo en promedio en un momento dado para un nivel dado de tecnología.
Dada la evidencia limitada sobre la calidad y que el único estudio identificado se limitó al cáncer, nuestro análisis primario no supone ninguna disminución en la calidad (o aumento en los costos de fabricación) a medida que la cantidad de innovación aumenta con el pago. La evidencia sobre la calidad se incorpora como un análisis de sensibilidad, donde la evidencia del informe de la CBO se combina con la evidencia sobre la calidad de Bennette et al. para estimar una elasticidad que relaciona los efectos sobre la salud con el pago de 0,20 (ver la Información complementaria S1 para la derivación). Esta estimación implica que un aumento del 1% en el pago aumenta las ganancias de AVAC asociadas con nuevos medicamentos en un 20%, asumiendo (en ausencia de evidencia alternativa) que las ganancias de años de vida son un indicador razonable de las ganancias de AVAC (Soares et al., 2020 ). Dada la heterogeneidad en la evidencia que relaciona el pago con la cantidad de innovación, y la evidencia limitada relacionada con la calidad y los costos de fabricación, los resultados clave dentro de este documento se presentan para una gama de estimaciones de elasticidad.
3 ESTIMACIÓN DE BENEFICIOS Y COSTOS ESTÁTICOS Y DINÁMICOS
Para determinar la proporción óptima del valor total que se debe ofrecer a los fabricantes y el pago necesario para entregarlo, se requiere un marco cuantitativo que permita equilibrar los beneficios estáticos (actuales) y dinámicos (futuros) para la salud y los costos de oportunidad para la salud de los diferentes niveles de pago. Esto se puede lograr combinando una estimación del valor de la elasticidad de la innovación con una medida de la escala de los beneficios estáticos y dinámicos. En esta sección definimos los beneficios estáticos y dinámicos y en las secciones siguientes mostramos cómo pueden informar una evaluación de la proporción óptima en función de diferentes objetivos de política.Si se lanza al mercado un nuevo producto farmacéutico que sea eficaz en relación con los productos de comparación existentes, ofrecerá el potencial de beneficios netos para la salud a largo plazo ( T b ). Esto refleja las ganancias para la salud asociadas con el uso del producto neto del costo de oportunidad para la salud asociado con el costo de fabricación (mc) y cualquier otro costo no relacionado con el producto (npc) (Woods et al., 2021 ):
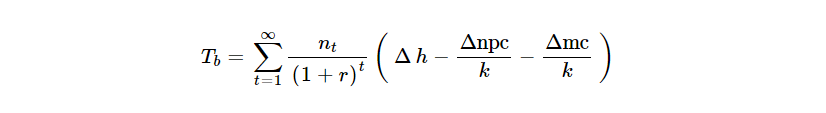
El beneficio estático es una función del número de pacientes que se presentan para tratamiento en un año determinado ( n t ), la tasa de descuento anual ( r ), el beneficio de salud adicional del producto para los pacientes (∆ h ), el costo de oportunidad de salud asociado con los costos no relacionados con el producto(∆npck), y el costo de oportunidad para la salud asociado con cualquier costo de fabricación adicional(∆mck), 1 donde k refleja la productividad marginal del sistema de atención de la salud. El horizonte temporal de estos beneficios estáticos no tiene límites porque el valor del producto persiste, incluso si ya no se utiliza, siempre que el valor (y el precio) de los futuros productos farmacéuticos se juzguen en relación con las versiones genéricas del producto que se está evaluando. Los beneficios dinámicos asociados con las futuras innovaciones se definen de la misma manera: como una función de los beneficios para la salud y los costos de oportunidad para la salud de los costos de fabricación y de no producción.
Se pierde una parte de este beneficio estático si el sistema de atención sanitaria paga más que los costes de fabricación para proporcionar incentivos a la innovación. Esto representa un coste de oportunidad sanitario estático porque los recursos sanitarios adicionales necesarios para realizar este pago podrían haberse utilizado para mejorar la salud en otras áreas. Si la parte fuera cero, el sistema de atención sanitaria captaría todo el beneficio sanitario estático, ya que no se realizaría ningún pago que exceda el coste de fabricación. El pago puede expresarse como un coste en términos de salud ( s . T b ) o como los recursos del sistema de atención sanitaria que se requerirían para generar los mismos beneficios sanitarios ( k . s . T b ) (es decir, en términos monetarios).
La incurrencia de costos estáticos superiores a los costos de fabricación puede justificarse para incentivar el desarrollo de nuevos productos farmacéuticos en el futuro. Estos productos están asociados con un beneficio dinámico ( T d ), medido de la misma manera que el beneficio estático. La proporción del beneficio estático ofrecido a los fabricantes debe considerarse como un compromiso político creíble a largo plazo que impulsará las expectativas de ingresos y, por lo tanto, las decisiones de I+D que determinan T d . Es poco probable que las políticas de precios que se espera que generen solo un pago temporal por beneficios estáticos, en lugar de un compromiso a largo plazo, ofrezcan beneficios dinámicos. 2 Por lo tanto, consideramos políticas de precios que ofrecen un compromiso a largo plazo, donde se renunciará a la misma proporción de los beneficios dinámicos a través de pagos a los fabricantes y esto constituye el costo dinámico de la salud ( s . T d ).
4 ESTABLECER LA PARTICIPACIÓN ÓPTIMA DE VALOR QUE SE OFRECE A LOS FABRICANTES
Centrándonos inicialmente en un objetivo de salud pública, una proporción óptima maximizará los beneficios totales (estáticos y dinámicos) para la salud ( T = T b + T d ) menos los costos totales para la salud ( s . T ). La proporción óptima ( s * ) tomará algún valor entre 0 y menos de 1, porque si la proporción es igual a uno, entonces no solo se pierde el beneficio estático completo sino también los beneficios dinámicos completos.Por lo tanto, es fundamental establecer el vínculo entre la proporción de beneficios perdidos por el sistema de atención sanitaria
y el impacto en el beneficio dinámico ( T d ). Como se analiza en la Sección 2 , la literatura ha analizado la cuestión estrechamente relacionada de cómo el número de nuevos productos desarrollados (y en menor medida su calidad) responde al pago mediante la estimación de un valor de elasticidad de innovación ( ϵ ). Suponemos que las medidas de cantidad y calidad promedio que sustentan estas estimaciones son un indicador razonable del beneficio dinámico y que la elasticidad es constante con el nivel de pago. 3 Esto permite expresar el beneficio dinámico como una función de potencia del pago:

donde α determina la escala (sobre la que hablaremos más adelante) y p denota el pago en términos monetarios (es decir, k . s . T b ).Por lo tanto, el beneficio dinámico también puede expresarse como una función de potencia de la participación:

El beneficio dinámico aumentará en proporción mientras la elasticidad sea positiva; y aumentará a una tasa creciente con la proporción si la elasticidad es mayor que uno, pero a una tasa decreciente si la elasticidad es menor que uno.La participación óptima puede definirse como aquella que maximiza la diferencia entre el beneficio total y el coste total.

No existe una solución general para s * , pero es posible obtener numéricamente la proporción óptima para valores de parámetros dados (véase la Información complementaria S2 ). La proporción óptima dependerá de la escala relativa actual de beneficio estático y dinámico, así como de cómo se espera que el beneficio dinámico responda al pago (es decir, la elasticidad de la innovación), pero no del nivel de T b , T d o k . 4Para cuantificar cómo responde T d a un cambio de largo plazo en la participación utilizando la ecuación ( 3 ), es necesario estimar el parámetro de escala,
α . Si entendemos la relación entre los beneficios dinámicos y estáticos en el entorno de políticas actual ( γ ), entonces podemos reorganizar la ecuación ( 3 ) para calcular α como:

dóndes0ϵes la proporción de valor ofrecida actualmente. Se utiliza una proporción del 50% para reflejar una proporción plausible de valor ofrecida actualmente a los fabricantes, con base en la evidencia de una muestra de evaluaciones de NICE (Woods et al., 2021 ). La escala relativa de beneficios estáticos y dinámicos en la proporción actual de valor ofrecida a los fabricantes no está disponible directamente en la literatura. Los beneficios estáticos relevantes para este análisis se derivan de medicamentos que siguen sujetos a IPP, que, con base en los datos disponibles de duración de patentes (Copenhagen Economics, 2018 ), serían medicamentos desarrollados en los últimos 12 años. Suponiendo un suministro constante de nuevos medicamentos a lo largo del tiempo sin cambios en la escala de beneficios que ofrecen (como predice el modelo de simulación de CBO en su escenario base (Adams, 2021 )) implica una relación de beneficios dinámicos a estáticos de 2,3 cuando estos se descuentan al 3,5% anual.
Para estos (o cualquier otro) valores de parámetros elegidos, ahora es posible trazar los beneficios totales, los costos totales y los beneficios netos contra la participación del valor dada al fabricante como en la Figura 1 donde los valores se expresan en términos de salud. Si se ofrece una participación cero a los fabricantes, el sistema de atención de la salud recibe solo el beneficio neto estático de salud, ya que no hay incentivos para la innovación ni beneficios dinámicos. Con una participación igual a 1 también hay beneficios dinámicos considerables, pero todos los beneficios (estáticos y dinámicos) solo se compensan con los costos estáticos y dinámicos, por lo que los beneficios netos de salud son cero. En la Figura 1 , los beneficios de salud se maximizan con una participación óptima de s * = 0,22. Los valores de T b y k reescalan el gráfico pero no cambian la participación óptima. Sin embargo, junto con s * , determinan el nivel de pago proporcional a esta participación como se analiza en detalle en la Sección 5 de este manuscrito.
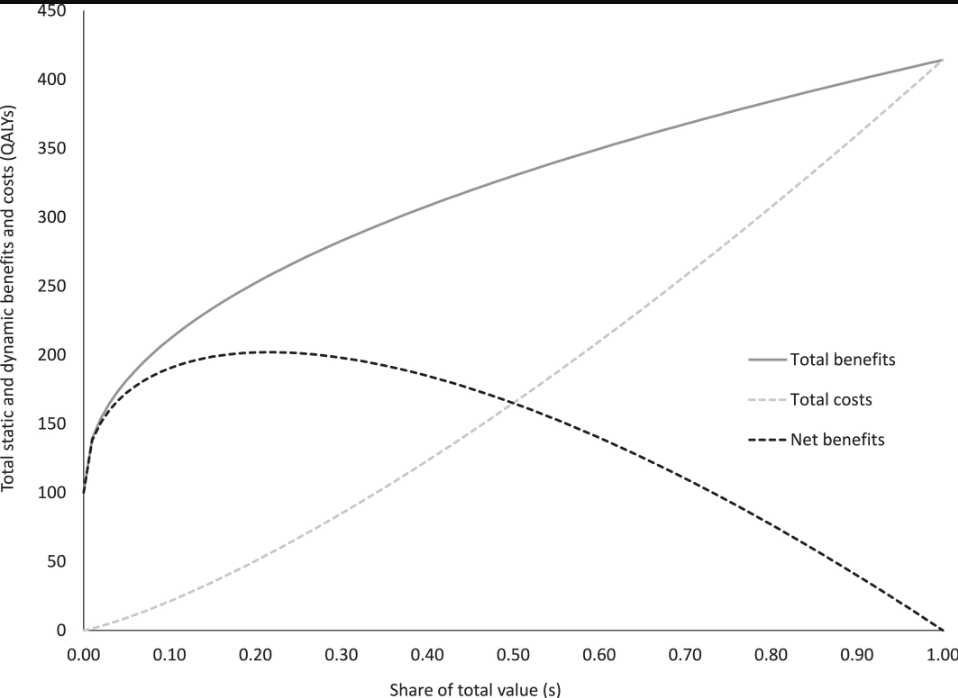
Beneficios, costos y beneficios netos estáticos y dinámicos totales en términos de salud. La escala del beneficio estático se establece, a modo de ejemplo, en un valor de 100 AVAC*, T b = 100; valor de la elasticidad de la innovación, ϵ = 0,45 del modelo de simulación de la CBO; productividad marginal del sistema de atención de salud, k = £15.000/AVAC basada en evidencia del Reino Unido 5 ; relación entre los beneficios dinámicos y estáticos, γ = 2,3 basada en la relación entre el valor de los productos que se espera desarrollar en el futuro y los productos ya desarrollados pero que todavía están dentro de la PPI; y la proporción del valor en la que se observa esta relación entre los beneficios dinámicos y estáticos, s 0 = 0,5 basada en evidencia de una muestra de evaluaciones del NICE. Esto implica una constante, α = 0,52. *Obsérvese que la elección del valor para T b influye en la escala de los resultados previstos, aunque no en la proporción óptima estimada u otras conclusiones (véase la nota al pie 4).
Dadas las incertidumbres en torno a la contribución relativa de los beneficios estáticos y dinámicos, también estimamos la participación óptima bajo el supuesto extremo de que los beneficios dinámicos son ilimitados en relación con los beneficios estáticos (que luego se vuelven insignificantes). Esta participación máxima ( s * U ) es 0,31 utilizando los valores de los parámetros descritos anteriormente (ver la Información complementaria S1 para la derivación). La Figura 2 ilustra el rango posible de participaciones máximas y óptimas de valor para ofrecer a los fabricantes, dado un rango de estimaciones del valor de la elasticidad de la innovación. Esto sugiere una participación óptima de valor para ofrecer a los fabricantes del 22% (rango: 13%–51%) cuando se excluye la evidencia de cómo cambia la calidad con la cantidad de innovación. Cuando se incluye la evidencia disponible sobre los efectos de la calidad, la participación óptima sería menor (11%: 6%–29%). Las participaciones máximas correspondientes son 31% (19%–60%) cuando se excluyen los efectos de la calidad y (17%: 9%–40%) cuando se incluyen los efectos de la calidad.

5 NORMAS DE PAGO, APROBACIÓN Y APLICACIÓN A LAS TASACIONES DE NIZA
El pago global óptimo ( p * ) a los fabricantes es la parte óptima del beneficio de salud estático expresado como los recursos de atención médica adicionales que se requerirían para generar los mismos beneficios de salud ( p * = s * . k . Tb ). Una vez establecido , este pago podría entregarse de varias maneras: la más obvia a través del precio de transacción pagado durante el IPP (por ejemplo, modulando las normas de aprobación aplicadas por los organismos de HTA). De manera equivalente, la duración del IPP podría en principio modularse a una norma de aprobación fija, o podrían asegurarse compromisos para reducir los precios posteriores al IPP. Los modelos de suscripción son otro mecanismo posible, donde limitar el uso generalizado temprano puede ser importante (por ejemplo, nuevos antimicrobianos) (Rothery et al., 2018 ).
En esta sección mostramos cómo, una vez identificado el nivel de pago óptimo, esto se puede traducir a una política de precios específica. A modo de ilustración, mostramos cómo se puede determinar una norma de aprobación óptima suponiendo que otros aspectos de la política (por ejemplo, políticas de precios de medicamentos genéricos y biosimilares) permanecen constantes. Es importante destacar que esta es solo una forma, y no necesariamente la mejor, de realizar los pagos necesarios para una eficiencia dinámica. No obstante, elegimos ilustrar las implicaciones para este mecanismo de pago en particular, ya que la cuestión de las normas de aprobación adecuadas se ha discutido ampliamente en la literatura de HTA (Brouwer, van Baal, van Exel y Versteegh, 2019 ; McCabe et al., 2008 ; Wouterse, van Baal, Versteegh y Brouwer, 2023 ).
Los organismos de evaluación de tecnologías sanitarias, como el NICE, suelen comparar la relación coste-efectividad incremental (RCIE) de un nuevo producto con alguna norma de aprobación ( λ ) o «umbral», que representa su RICE máximo aceptable, y que regula la fijación de precios de los fabricantes o las ofertas de descuentos confidenciales. Nos referimos al precio real pagado por el sistema sanitario, que refleja los descuentos y rebajas, como el precio de transacción. Los fabricantes potencialmente solo recibirán este precio de transacción por su producto durante el período de la PPI. 6 Suponiendo que no haya cambios en la PPI, incluso para productos con los mismos beneficios ( T b ) y, por tanto, el nivel de pago general ( p * ), la norma de aprobación «óptima» ( λ * ) diferirá en función de la proporción de valor que se genere durante el período de la PPI (así como para los diferentes costes de fabricación y no relacionados con el producto).El cálculo de la norma de aprobación óptima requiere la estimación de los costos incrementales por paciente asociados con el pago óptimo.(p∗NIPP+∆npc+∆mc)donde N IPP es el valor actual neto del número de personas tratadas con el nuevo producto dentro del período del IPP. 7 También requiere el cálculo de los beneficios por paciente en términos de salud (QALY).(∆h=TbN+∆npck+∆mck)donde N es el valor actual neto del número de individuos tratados con el nuevo producto en los períodos IPP y post–IPP y se calcula como en la ecuación ( 1 )as∑t=1∞nt(1+r)tLa relación entre los costos incrementales por paciente asociados con el pago óptimo y los AVAC incrementales por paciente proporciona la norma de aprobación óptima:
λ∗=p∗NIPP+∆npc+∆mcTbN+∆npck+∆mck(7)Si los costos adicionales de fabricación y no relacionados con el producto son cero, entonces esto se simplifica a:
λ∗=p∗NIPPTbN=p∗πIPP.Tb=s∗kπIPP(8)donde
π IPP es la proporción de valor que se genera durante el período de IPP. 8 Aunque esta proporción no afecta el pago general durante el período de IPP, sí influye en el pago a nivel de paciente y la norma de aprobación que se debería aplicar. Por ejemplo, una menor proporción de valor generado durante el período de IPP significa que el pago óptimo debe “cargarse” a menos pacientes (Figura 3 ), y esto requeriría una norma de aprobación óptima más alta.

La norma de aprobación óptima puede ser mayor o menor que k , dependiendo de la proporción de valor que se genera durante la IPP. Por ejemplo, si la proporción de valor generado dentro de la IPP fue relativamente baja (por ejemplo, 10%), como podría observarse para un antimicrobiano que se mantiene en reserva para tratar infecciones resistentes emergentes, entonces la norma de aprobación sería £33.000/QALY(λ∗=s∗kπIPP=0.22∗15,0000.10)Si la proporción de valor generado dentro de la PPI fue relativamente alta (por ejemplo, 60%), como podría observarse en una enfermedad crónica con alta prevalencia y baja incidencia, entonces la norma de aprobación óptima sería £5500/QALY. Si se espera que un nuevo producto esté asociado con costos adicionales de fabricación o no relacionados con el producto, u ofrece ahorros en estos costos, entonces esto modificará la norma de aprobación óptima, e incluso puede resultar en una norma de aprobación negativa. 9
Se debe utilizar una medida apropiada del costo de oportunidad de la salud, k , al calcular el nivel de pago óptimo ( p * = s * . k . T b ) para asegurar que el nivel de pago óptimo (y la norma de aprobación óptima asociada, derivada utilizando la ecuación ( 7 )) proporcione la porción óptima deseada de valor al fabricante. Supongamos en cambio, a modo de ilustración, que el beneficio de salud a largo plazo ( T b = 100) se multiplicó por un valor de consumo de salud basado en evidencia de la disposición individual a pagar ( v = £ 70,000) 10 y que el 22% de esto se le dio al fabricante. Este pago sería 4,67 veces mayor, £ 1,540,000. La salud resultante perdida de este pago estaría determinada por k (y no por v ), y sería 103 AVAC.(£1,540,000£15,000perQALY)En este caso, la proporción de valor para el fabricante es del 103% en lugar del 22%. El reembolso del producto a este nivel de pago resultaría en pérdidas netas de salud de 3 AVAC. Esta pérdida estática también se aplicaría a los efectos dinámicos porque las innovaciones futuras, que también atraen esta proporción de valor, también impondrán pérdidas netas de salud. Esto generaría menos beneficios de salud que si se asignara una proporción cero, se renunciara a los beneficios dinámicos y solo se acumularan los beneficios estáticos. Una política de precios de este tipo también generaría menos beneficios de salud que si el producto no se hubiera ofrecido al sistema de atención de salud en absoluto. En general, si la medida del costo de oportunidad de salud, k , es menor que el valor de consumo de salud, v , entonces usar v para calcular el pago reducirá los resultados de salud en general, y esta pérdida será mayor a valores más altos de la elasticidad de la innovación.
Un análisis reciente estimó la proporción de valor otorgada al fabricante para una muestra de 12 evaluaciones de tecnología de NICE (Woods et al., 2021 ). La proporción de valor otorgada al fabricante varió entre el 6% y el 260% (Tabla 1 ). Esta proporción está determinada por los niveles actuales de IPP, el funcionamiento del mercado de genéricos y biosimilares y los procesos regulatorios y de reembolso. El impulsor más fuerte de las diferencias en la proporción para esta muestra de evaluaciones es el ICER asociado con el uso del producto dentro del período de IPP. En general, se incentiva a los fabricantes a fijar un precio de transacción tal que el ICER sea igual a la norma de aprobación (es decir, £20 000-30 000/AVAC para productos evaluados por NICE, con una norma más alta de £50 000/AVAC aplicada para productos que se consideran tratamientos al final de la vida que prolongan la vida 11 ), aunque otros factores como la sensibilidad a los precios locales y la fijación de precios uniformes para todas las indicaciones también pueden influir en el precio de maximización de ingresos y, por lo tanto, en el ICER.CUADRO 1. Prima de precio óptima y normas de aprobación para una muestra de valoraciones de tecnología de NICE.
| Producto (pedido por ICER) | Política actual | Análisis óptimo | ||||||
|---|---|---|---|---|---|---|---|---|
| ICER (£ por AVAC) para el período del IPP | Prima de precio implícita a (£) | Estimación de la participación del valor para el fabricante | Compartir con el fabricante | Prima de precio implícita óptima a (£) | Norma de aprobación óptima (£ por AVAC) | Prima de precio implícita óptima con compromiso con la política de genéricos a , b (£) | Norma de aprobación óptima con compromiso con la política de genéricos b (£ por AVAC) | |
| Nalmefeno | 1110 | 322 | 9% | 22% | 784 | 7910 | 1036 | 10,521 |
| Vortioxetina | 2970 | 49 | 7% | 22% | 157 | 9234 | 198 | 11.657 |
| Rivaroxabán | 5622 | 309 | 6% | 22% | 1136 | 12,519 | 1689 | 16.378 |
| Talidomida | 9174 | 10,862 | 19% | 22% | 12,565 | 10,570 | 16.590 | 13.801 |
| Adalimumab | 19.328 | 26.725 | 114% | 22% | 5143 | −3.632 c | 8090 | −2,586 c |
| Vedolizumab | 21.620 | 2328 | 144% | 22% | 357 | 10,671 | 698 | 9207 |
| Enzalutamida (pre-quimioterapia) | 32,985 | 27.590 | 79% | 22% | 7687 | −6820 °C | 8955 | −4.550 c |
| Pembrolizumab (CPCNP) | 44.490 | 22.756 | 260% | 22% | 1928 | 10,120 | 3500 | 12.039 |
| Cabazitaxel | 45.159 | 10.703 | 118% | 22% | 1993 | 8407 | 2403 | 10,137 |
| Enzalutamida (posquimioterapia) | 45.626 | 11.022 | 168% | 22% | 1442 | 8782 | 1685 | 9471 |
| Pembrolizumab (melanoma) | 46.662 | 36.953 | 243% | 22% | 3347 | 8902 | 5800 | 10.815 |
| Olaparib | 46.973 | 34.883 | 148% | 22% | 5181 | 9845 | 6339 | 11.099 |
- Abreviaturas: ICER, relación coste-efectividad incremental; IPP, protección de la propiedad intelectual; QALY, año de vida ajustado por calidad.
- Una prima de precio es el precio adicional que paga el sistema de salud por encima del comparador existente, neto de los costos de fabricación adicionales.
- b La política de genéricos implica la disponibilidad inmediata y la adopción total de productos genéricos/biosimilares al vencimiento de la patente, junto con una reducción de precios del 25% respecto de los niveles actuales.
- c La norma de aprobación negativa surge debido a un ahorro sustancial de costos. El fabricante solo conserva el 22 % del valor generado por el ahorro de costos, por lo que el numerador en la ecuación ( 7 ) es negativo.
Con base en los resultados de este trabajo, es posible estimar la norma de aprobación óptima para cada producto. Como se discutió anteriormente, esto diferirá en función de la proporción de valor generado durante la IPP y la escala de los costos de fabricación y no relacionados con el producto. Este reanálisis sugiere que, en la mayoría de los casos, con las normas de aprobación actuales, la proporción de valor ofrecido a los fabricantes y la prima de precio pagada por el NHS fue mayor de lo que hubiera sido óptimo (Tabla 1 ), en muchos casos dejando al NHS con un valor negativo a largo plazo. Si la modulación de una norma de aprobación es la única herramienta de política disponible, entonces lograr el nivel de pago óptimo requiere una norma de aprobación que varíe de un producto a otro. Esto indica que es poco probable que la aplicación de una única norma de aprobación brinde una eficiencia dinámica general o incentive la innovación de manera adecuada en todas las indicaciones. Estos análisis reflejan las estimaciones basadas en evidencia de entrada, uso y precio de medicamentos genéricos utilizadas por Woods et al. ( 2021 ) También presentamos la prima de precio óptima si se hubieran podido asumir compromisos para garantizar la entrada de genéricos en el punto de expiración del IPP, no utilizar la marca original más allá de este punto y que los precios de los genéricos reflejen los costos de fabricación. La prima de precio óptima con compromisos creíbles de este tipo en vigor es entre un 16% y un 96% más alta que con supuestos empíricos más realistas.
Esta muestra de valoraciones también se volvió a analizar para evaluar la escala de los efectos netos sobre la salud en los niveles de pago actuales y óptimos. En la actualidad, los fabricantes de los productos considerados acumulan aproximadamente el 50% del valor. Si consideramos que esta proporción del valor proporciona una señal de la recompensa esperada para todos los tipos de productos (es decir, la variación observada en las proporciones entre los productos es aleatoria), entonces podemos comparar los beneficios estáticos y dinámicos que se espera que surjan de la proporción actual del valor con los que esperaríamos en niveles de pago óptimos. Pasar de los niveles de pago actuales a los óptimos para este conjunto de productos crearía beneficios estáticos y dinámicos de 146.297 AVAC, un aumento del 24% en los beneficios netos sobre la salud en comparación con el statu quo (los cálculos se muestran en el archivo Excel complementario en línea, información complementaria S2 ).
Alternativamente, la variación observada en las participaciones entre productos puede interpretarse como una señal a largo plazo de cómo variará la participación entre productos en el futuro. Si este es el caso, se espera que la I+D se centre en aquellos tipos de productos a los que se les asigna una participación mayor, que, por lo tanto, acumularán mayores beneficios dinámicos ( T d ). Los beneficios netos dinámicos que se espera que surjan de los niveles de pago actuales serán menores en este contexto, ya que habrá pérdidas estáticas y dinámicas de aquellos tipos de productos donde la recompensa excede el valor a largo plazo (es decir, la participación en el valor excede el 100%). En este escenario, pasar de los niveles de pago actuales a los óptimos para este conjunto de productos crearía beneficios estáticos y dinámicos de 445.074 AVAC (un aumento del 144% con respecto al statu quo).
6 OTROS ASPECTOS DEL VALOR
El beneficio estático ( T b ) no necesita expresarse como salud o incluir la salud como el único argumento de bienestar. Por ejemplo, los beneficios y costos estáticos y dinámicos podrían expresarse como consumo basado en un valor de consumo de salud ( v ) elegido para reflejar los efectos de bienestar social o la disposición individual a pagar. Independientemente del valor elegido, el único efecto es reescalar el eje Y de la Figura 1. La proporción óptima de valor, ahora expresada como consumo en lugar de salud, y el pago de los recursos de atención médica necesarios para brindarlo, no cambian.
Las innovaciones pueden tener efectos indirectos sobre beneficios sociales más amplios que van más allá de la salud y sobre otros atributos de salud socialmente valiosos que no se reflejan en las medidas de salud que se utilizan actualmente (por ejemplo, los AVAC). Por ejemplo, puede haber preferencias sobre cómo se distribuyen los efectos sobre la salud según el estado de salud actual, los ingresos u otras características. Reflejar estas consideraciones cambia la forma en que se mide la tuberculosis , pero no cambia necesariamente qué proporción de este valor debe ofrecerse a los fabricantes. El hecho de que tales consideraciones aumenten o reduzcan el nivel de pago adecuado depende de: (i) la gama de atributos que ofrece un nuevo producto farmacéutico; (ii) los pesos relativos asignados a estos atributos; (iii) la productividad marginal del gasto en atención de la salud al proporcionarlos y (iv) cómo esta definición modificada de beneficio dinámico responde al pago.
En lugar de centrarse en un objetivo de salud pública, o en uno modificado por otros atributos de valor (pero aún centrado en el excedente del consumidor), un objetivo alternativo podría ser maximizar la suma del excedente del consumidor y del productor. Evaluar las implicaciones de los diferentes niveles de pago para el beneficio neto en términos de bienestar requiere dos evaluaciones adicionales: una evaluación de la proporción del pago al fabricante que se retiene como excedente del productor, y una evaluación del valor marginal de los fondos de atención médica (que pondera el gasto en salud en relación con las ganancias privadas supernormales). No está claro el alcance de cualquier excedente del productor que pueda retenerse después de tener en cuenta los costos de investigación y desarrollo, comercialización, competencia por derechos de monopolio temporal y los efectos de los flujos de capital competitivos. 12 En el caso de los medicamentos ya desarrollados, los costos de investigación y desarrollo son irrecuperables, por lo que podría esperarse razonablemente que una mayor parte del pago realizado por beneficios estáticos se retenga como excedente del productor (los costos de fabricación ya se tienen en cuenta en el cálculo de T b ). Sin embargo, el pago por beneficios dinámicos no puede considerarse excedente del productor, ya que no se han tenido en cuenta los costos de investigación, desarrollo y otros costos de estas innovaciones posteriores (y de todos los demás productos relacionados que no lograron llegar al mercado para lograr estos éxitos). Por lo tanto, interpretar los pagos realizados, netos de los costos de fabricación, como excedente del productor sería una forma de doble contabilización al contabilizar los beneficios de la innovación sin restar los costos de lograrla, es decir, tratar los costos como si también fueran un beneficio.El excedente del consumidor (EC), el excedente del productor (PE) y el beneficio neto en términos de bienestar (NB(W)) se pueden expresar como:
CS=v.(1−s).(Tb+Td)(9)
PS=ϕb.s.k.Tb+ϕd.s.k.Td(10)
NB(W)=CS+PS(11)donde ϕ
b y ϕ d se refieren a la proporción del pago por beneficio estático y dinámico que se retiene como excedente del productor. Las ecuaciones 9-11 indican que el bienestar, y la proporción óptima, también dependerán del valor de los recursos de atención médica ( k ) en relación con el consumo privado ( v ). Las consideraciones teóricas y la evidencia empírica sugieren que el costo marginal de (recaudación de) fondos públicos (MCPF) es probable que sea mayor que uno (Claxton et al., ; Dahlby, 2008 ; Ruggeri, 1999 ) y, por lo tanto, el valor marginal de los fondos públicos (MVPF) también es probable que sea >1 (Finkelstein y Hendren, 2020 ). Condicionado a la función de bienestar utilizada para estimar MCPF y MVPF, se espera que se recauden fondos públicos y esos recursos se asignen de manera que MVPF = MCPF>1. Esto se aplica a los recursos de atención médica, ya sea que se financien pública o privadamente. Nuevamente, por buenas razones teóricas y empíricas, uno esperaría que los recursos de atención de salud fueran más valiosos que el consumo privado, por lo que el valor marginal de los fondos de atención de salud(vk)es probable que sea mayor que 1, porque los costos marginales de los fondos de atención médica serán mayores que 1 13 (Claxton et al., 2019 ). Como consecuencia, cualquier pago que se retenga como excedente del productor es menos valioso que la cantidad equivalente de recursos de atención médica porque es una transferencia de recursos desde dentro del sistema de atención médica al consumo privado. Se espera que el costo marginal de los fondos de atención médica supere 1 debido a varias distorsiones, incluidas las pérdidas de bienestar asociadas con la recaudación de fondos para la atención médica. En el contexto de un sistema de atención médica financiado colectivamente, las pérdidas de bienestar resultan de formas socialmente aceptables de impuestos y seguro social. En un sistema de seguro privado, las pérdidas de bienestar ocurren debido a fallas del mercado resultantes de información asimétrica, riesgo moral y agencia imperfecta (Arrow, 1963 ). Además, en un sistema democrático, el valor marginal de los fondos de atención médica puede superar 1 si los fondos se obtienen (y se diseñan regulaciones) sobre la base de las preferencias medianas sobre la salud y el consumo, en lugar de las preferencias medias, debido a la distribución sesgada del valor del consumo de salud de los individuos (Phelps, 2019 ). La evidencia empírica del Reino Unido 14 y los EE. UU. 15 sugiere un valor marginal de los fondos de atención médica de 4,67(vk=£70,000£15,000)y 2.5(vk=$250,000$100,000)respectivamente. En consecuencia, incluir la consideración de cualquier excedente del productor que pueda retenerse tiene un impacto modesto en la proporción óptima de valor. Por ejemplo, suponiendo que todo el pago asociado con el beneficio estático, y el 20% del pago asociado con el beneficio dinámico, se retiene como excedente del productor (ϕ b = 1; ϕ d = 0,2), aumentaría la proporción óptima a 0,24 utilizando evidencia del Reino Unido sobre el valor marginal de los fondos de atención médica.(vk=4.67)Utilizando la evidencia estadounidense(vk=2.5)La proporción óptima aumenta a 0,27.
7 DISCUSIÓN
Este marco ofrece un enfoque coherente y basado en la evidencia para diseñar políticas de precios y mecanismos de pago de productos farmacéuticos con el fin de lograr una eficiencia dinámica. Según la evidencia disponible que vincula el pago con la innovación, la proporción óptima del valor a largo plazo de los nuevos productos farmacéuticos que se ofrece a los fabricantes es de aproximadamente el 20% (rango 6%–51%). Un nuevo análisis de una muestra de evaluaciones de tecnología del NICE sugiere que, en la mayoría de los casos, la proporción del valor ofrecido a los fabricantes y la prima de precio pagada por el NHS del Reino Unido fueron mayores de lo que habría sido óptimo y, en muchos casos, dejaron al NHS con una proporción de valor a largo plazo inferior a cero. Estos efectos se verán exacerbados si la futura inversión en I+D se centra en aquellas áreas donde las proporciones son más altas. Una política de pagos y precios basada en la evidencia de cómo la cantidad y la calidad de la innovación responden al pago ofrecería beneficios considerables tanto desde el punto de vista de un objetivo de salud pública como desde una perspectiva más amplia de bienestar social. Si bien la aplicación más obvia de estos resultados sería a través de la regulación de precios, ya sea directa o indirectamente a través de procesos de evaluación de tecnologías sanitarias (o ambos), la proporción adecuada de valor podría obtenerse a través de una variedad de modelos de pago alternativos. Estos podrían incluir modelos de suscripción, compromisos para limitar la IPP y vender medicamentos de marca a precios más bajos más allá del período de la IPP, o a través de esquemas nacionales de reembolso a nivel de cartera en lugar de nivel de producto, como el esquema voluntario del Reino Unido para la fijación de precios y acceso a medicamentos de marca.
Estas conclusiones sobre la proporción óptima no son sensibles a los supuestos sobre la escala relativa de los beneficios estáticos y dinámicos; si el valor se expresa en términos monetarios basados en la disposición a pagar o en términos de salud; o la inclusión de atributos adicionales de valor, incluida la adopción de una perspectiva más amplia de bienestar social mediante la inclusión del excedente del productor. La proporción óptima también es insensible a la productividad marginal del sistema de atención de la salud, aunque esto sí influye en el nivel de pago adecuado.
Nuestras conclusiones difieren de estudios anteriores. Varios autores han concluido que se pueden lograr recompensas óptimas para el fabricante utilizando una norma de aprobación igual al valor del consumo de salud, al menos dentro del período restante de IPP (Danzon et al., 2015 ; Jena y Philipson, 2008 ; Lakdawalla, 2018 ; Lakdawalla y Sood, 2012 ; Vernon et al., 2009 ). El estudio actual muestra que no hay razón para que este sea el caso, y que una norma de aprobación óptima dependerá (principalmente) de la capacidad de respuesta del valor de la innovación al pago, la productividad marginal del sistema de salud ( k ) y la proporción de valor generado durante el período de IPP. Otros estudios han concluido que es probable que el aumento de los niveles de pago de los productos farmacéuticos a través de precios o extensiones del IPP mejore el excedente del consumidor (Council of Economic Advisers, 2019 ; Filson, 2012 ; Gigi et al., 2017 ; Goldman et al., 2011 ; Lakdawalla et al., 2008 ; Santerre & Vernon, 2006 ). Sin embargo, estos estudios no consideraron los costos de oportunidad para la salud asociados con pagos más altos.
Nuestros hallazgos también parecen diferir de la literatura económica más amplia relacionada con la economía de la innovación (Gilbert y Shapiro, 1990 ; Green y Scotchmer, 1995 ; Loury, 1979 ; Matutes et al., 1996 ; William D. Nordhaus, 1969a , 1969b ; William D. Nordhaus, 1969a , 1969b ; O’donoghue et al., 1998 ). Esta literatura tiende a tomar la perspectiva de la empresa, con y sin un monopolio temporal, que decide si invertir en una innovación cuando se enfrenta a una curva de demanda de mercado esperada señalada por las elecciones de consumidores individuales completamente informados. Dado que la empresa no puede discriminar perfectamente los precios, se retiene algún excedente del consumidor incluso al precio de monopolio temporal, pero se incurre en una pérdida de peso muerto. La escala óptima de la PPI (longitud, amplitud y anchura) intenta equilibrar estos beneficios y costos de bienestar, incluidos los beneficios asociados con cualquier excedente del productor que pueda retenerse. Es importante destacar que, en estas circunstancias, extender la PPI aumentará la pérdida irrecuperable, pero nunca eliminará los beneficios de la innovación, ya que siempre se conservará algo de excedente del consumidor. Por lo tanto, esta literatura implica una participación óptima por debajo de 1 en lugar de resolver la participación óptima.
El contexto de la atención sanitaria, ya sea financiada por fondos públicos colectivos o seguros privados, es bastante diferente (Arrow, 1963 ). Los consumidores no están completamente informados, por lo que dependen de agentes (imperfectos) que les señalen su demanda. Tampoco afrontan los costes marginales totales de sus elecciones. Por este motivo, nos centramos en la perspectiva de un decisor social (con potencial poder de monopsonio) que considera qué nivel de pago ofrecer a las empresas. Tratan de maximizar el bienestar (ya sea definido como salud, el valor de consumo de la salud o alguna función de bienestar más completa), pero no controlan el nivel de gasto colectivo o privado en atención sanitaria. Sin embargo, pueden fijar la política de precios (elegir s*), teniendo en cuenta cómo es probable que las empresas respondan al pago observando su comportamiento pasado (basándose en la evidencia econométrica y de otro tipo analizada anteriormente). Por lo tanto, tienen plenamente en cuenta los posibles beneficios dinámicos de su elección de política a pesar de su poder de monopsonio. El decisor social o su agente (por ejemplo, los organismos de HTA) es efectivamente capaz de discriminar perfectamente el precio, porque a todos aquellos para quienes se espera que el acceso mejore la salud ( T b > 0 o T d > 0) se les puede conceder el acceso (ya que los pacientes no enfrentan su costo marginal en el punto de acceso) a un precio promedio que podría eliminar la pérdida de peso muerto pero también podría ofrecer todo o más del valor a largo plazo al fabricante (Claxton, 2007 ; Claxton et al., 2008 ). Por esta razón, nos centramos en resolver la parte óptima del valor que se ofrecerá a los fabricantes tomando las decisiones de las empresas como empíricamente reflejadas en la evidencia econométrica y de otro tipo. Por lo tanto, la literatura más amplia intenta resolver para IPP e implica una parte óptima por debajo de 1. Aquí resolvemos la parte óptima directamente, lo que significa que podemos expresar el pago óptimo requerido y examinar las políticas de precios donde la escala de IPP se considera fija o como una variable de decisión.
Sin embargo, existen otras diferencias. Por ejemplo, tenemos en cuenta la evidencia de que el valor marginal de los fondos de atención médica es mayor que 1. También examinamos diferentes perspectivas para los objetivos de un tomador de decisiones sociales y, por implicación, diferentes definiciones de bienestar. También aplicamos el mismo valor de consumo de la salud a todos los efectos de salud, ya sean beneficios dinámicos o costos dinámicos de salud. Esta parece una posición normativa razonable en un sistema de atención médica financiado colectivamente (es una de las razones citadas para la financiación colectiva). También puede ser una suposición positiva razonable en el margen en un sistema de atención médica financiado privadamente, aunque también sería plausible asumir que la disposición individual a pagar por aquellos desplazados por un mayor costo del seguro (el costo dinámico de la salud) es menor que la de aquellos que ganan (el beneficio dinámico de la salud) (Phelps, 2019 ; Vanness et al., 2021 ). Que esta observación positiva deba tener o no importancia normativa para la elección de políticas en materia de atención médica es algo que otros deben juzgar (por ejemplo, los ciudadanos en una socialdemocracia).
Realizamos una revisión sistemática de estudios que informaban un efecto causal plausible o sólido del pago sobre la innovación para comprender los beneficios dinámicos asociados con niveles de pago más altos. Dada la heterogeneidad en las elasticidades de la innovación en los estudios identificados, presentamos resultados clave para una variedad de elasticidades. Nuestra estimación central no incluye la evidencia limitada de una disminución en la calidad, ni supone un aumento en los costos de fabricación, a medida que la cantidad de innovación aumenta con el pago. Esto reflejó la escasez de evidencia sobre ambos efectos. Por lo tanto, es probable que este análisis sobrestime la capacidad de respuesta del valor de la innovación al pago y, por lo tanto, sobrestime la proporción óptima, ya que la literatura teórica y empírica respalda un efecto negativo del pago sobre la novedad del producto con pagos más altos que tienden a alentar productos «me-too» con un valor incremental limitado (Dranove et al., 2014 , 2020 ; Adams, 2021 ; Blume-Kohout y Sood, 2013 ). También es probable que los pagos más altos alienten el desarrollo de medicamentos que son más costosos de producir.
El marco presentado es necesariamente una simplificación del complejo proceso a través del cual el pago impulsa la innovación y los efectos asociados en la salud y el bienestar. Hemos asumido que existe una política multilateral global para recompensar la innovación o que países individuales como el Reino Unido, al actuar unilateralmente, tienen plenamente en cuenta los beneficios dinámicos que se acumulan para otros fuera de sus jurisdicciones. 16 La proporción óptima sería sustancialmente menor si solo se consideran los beneficios dinámicos internos o se les da mayor peso, como se recomienda en la guía del gobierno central del Reino Unido sobre evaluación y valoración (HM Treasury, 2022 ). También asumimos que las elasticidades de la innovación reflejan los efectos del pago sobre la innovación mediada únicamente por inversiones privadas en I+D, y no reflejan los efectos de los esfuerzos de I+D del sector público. En la medida en que la I+D del sector público se controló en los estudios empíricos subyacentes, esta puede ser una suposición razonable. Sin embargo, la proporción óptima solo debería aplicarse a la parte de los beneficios estáticos y dinámicos que son atribuibles a la inversión privada. Por lo tanto, en la medida en que la I+D del sector público aporta una parte de estos beneficios, se esperaría que la proporción óptima de los beneficios estáticos y dinámicos totales que se asignaría al fabricante fuera menor.
En línea con la literatura empírica en la que se basa este artículo, suponemos una relación de elasticidad constante entre el pago y el valor de la innovación. Hicimos esta suposición en ausencia de cualquier base para informar una especificación alternativa; sin embargo, la aplicación de una elasticidad constante puede no ser apropiada para cambios no marginales en el pago. Además, suponemos que aquellos que podrían beneficiarse de un nuevo medicamento tendrán acceso a él. Cuando el nivel de pago influye en el precio y los costos que enfrentan los pacientes, como puede ser el caso en sistemas predominantemente basados en seguros privados o cuando el pago influye en el uso a través de otros mecanismos, una mayor participación implicará un precio más alto y, por lo tanto, un menor acceso. Por lo tanto, el costo de oportunidad de la salud aumentará más rápidamente con la participación a medida que menos personas que se beneficiarán de la intervención la reciban. Por lo tanto, se esperaría que la contabilidad de estos efectos reduzca la participación óptima. También puede haber heterogeneidad en la respuesta de la innovación al pago en diferentes tipos de productos (Dubois et al., 2015 ; Myers y Pauly, 2019 ). Si esto pudiera estimarse con precisión, entonces podría ser apropiado ofrecer diferentes proporciones para productos en diferentes áreas terapéuticas.
Este marco de análisis ofrece una forma coherente, basada en evidencia y factible de establecer niveles de pago para lograr una eficiencia dinámica. Sin embargo, es probable que el mecanismo más apropiado para lograr el nivel de pago óptimo dependa de los mecanismos disponibles para determinar los precios y lograr los niveles de pago dentro de cada país. A modo de ilustración, mostramos cómo se podrían lograr niveles de pago óptimos para un conjunto de evaluaciones NICE mediante el uso de normas de aprobación específicas para el producto. Independientemente de cómo se operacionalice el pago, el enfoque para estimar el nivel de pago óptimo tiene una serie de requisitos informativos. Se necesita una evaluación del valor del producto, que no se aleja mucho de lo que se captura convencionalmente en el análisis de costo-efectividad y se basa en los mismos insumos, además de estimaciones del número de pacientes a lo largo del tiempo (esto a menudo se calcula al estimar el impacto presupuestario). También requiere una estimación del costo de fabricación y el comportamiento esperado del mercado de medicamentos más allá del período de IPP, que se puede estimar utilizando un enfoque similar al de Woods et al. ( 2021 ). Se dispone de estimaciones de k para el NHS y ya son necesarias para la evaluación de impacto por parte del Departamento de Salud y Asistencia Social (Department of Health and Social Care, 2020 ); también se dispone de estimaciones para otros países (Edney et al., 2022 ; Ochalek et al., 2018 ; Vanness et al., 2021 ). En este documento se pueden obtener estimaciones plausibles de otros parámetros que se requieren, como el valor de la elasticidad de la innovación.
