Hay tres desarrollos aplicados a la cirugía, la realidad ampliada, la virtual y la mixta, esta última está avanzando con buenas perspectivas para mejorar la precisión de la cirugía y disminuir la posibilidad de complicaciones, por eso les entrego este artículo de revisión que nos introduce en este aspecto la aplicación de las imágenes de realidad ampliada y virtual en un mismo dispositivo.
Los avances en realidad mixta (RM) han dado lugar a enfoques innovadores en la cirugía guiada por imágenes (IGS).

1. Introducción
Las tecnologías de realidad aumentada (RA), realidad virtual (RV) y realidad mixta (RM) se estudian y utilizan cada vez más en la cirugía guiada por imágenes (IGS). Para diferenciar brevemente estos términos: la RA mejora el mundo real con contenido digital o virtual, la RV sumerge a los usuarios en un entorno completamente virtual y la RM, que combina elementos de ambos, se considera un continuo [Citación1 ] entre los dos extremos de un mundo plenamente real y uno virtual.
Las tecnologías de realidad mixta se han estudiado en varios contextos quirúrgicos, incluidos la educación quirúrgica, la planificación, la capacitación, el ensayo de procedimientos y las tareas de guía en tiempo real, como la planificación de incisiones, la navegación hacia objetivos quirúrgicos, la evitación de estructuras críticas y la determinación del alcance de la resección. La integración de las tecnologías de RM en los sistemas IGS ha generado varios beneficios, incluidos procedimientos más precisos y exactos, menor riesgo de errores y complicaciones, flujos de trabajo quirúrgicos mejorados y mejores resultados para los pacientes.
En este artículo, nuestro objetivo es evaluar el progreso reciente de las tecnologías de RM en IGS. En concreto, queríamos cuantificar los avances desde un artículo de revisión de 2013 sobre la visualización de vanguardia en IGS por RM [Citación2 ]. Las conclusiones extraídas de la revisión de 2013 destacaron que, a pesar de las numerosas innovaciones tecnológicas, solo un número limitado de sistemas de RM fueron probados o utilizados por los médicos en el quirófano (OR) durante procedimientos clínicos reales. En vista de la creciente popularidad de los sistemas IGS de RM durante la última década, nuestro objetivo era determinar si se habían utilizado más sistemas en estudios clínicos o en la práctica. Para garantizar la comparabilidad con los hallazgos de Kersten-Oertel et al. [Citación2 ] revisión, adoptamos el uso de la Taxonomía DVV [Citación3 ] para describir los sistemas IGS de RM y los criterios de inclusión de artículos similares, con una distinción clave: nuestro enfoque principal estuvo en los estudios que informaron pruebas en el quirófano. En la revisión de 2013, el interés en determinar el alcance del sistema IGS utilizado en el quirófano condujo a una sección dedicada a cubrir los sistemas probados en casos clínicos reales. Sin embargo, esta sección consistió en solo 15 artículos y la mayoría de los sistemas descritos solo se utilizaron en unos pocos casos quirúrgicos. Dado el aumento de publicaciones recientes sobre sistemas IGS de RM, nos centramos exclusivamente en artículos que describen pruebas de los sistemas IGS de RM en el quirófano publicados en los últimos 7 años.
En nuestra búsqueda actual se observó un aumento significativo en el uso de sistemas de resonancia magnética en quirófanos. En el período de revisión anterior, la tasa de publicación anual promedio fue de 24,6 artículos por año. En contraste, en el período actual se publicó un promedio de 137,9 artículos por año, lo que refleja un aumento sustancial.
3. Estado del arte en el uso de la taxonomía DVV
Nuestro análisis comienza con un examen exhaustivo de cada componente dentro de la taxonomía DVV, seguido de una exploración del dominio quirúrgico.
3.1. Datos
El primer componente de la taxonomía DVV, Datos, comprende datos específicos del paciente y datos procesados visualmente. Los datos específicos del paciente incluyen datos demográficos, puntuaciones clínicas, datos de imágenes sin procesar e información similar, mientras que los datos procesados visualmente se refieren a los datos presentados a los usuarios a través del componente Ver . El propósito de considerar los datos como un componente de los sistemas IGS es subrayar la importancia de determinar qué tipo de datos se deben mostrar durante la cirugía y en qué etapa del procedimiento.
3.1.1. Datos específicos del paciente
En consonancia con el estudio de 2013 [Citación2 ], la mayoría de los artículos analizados (63,3%) utilizan predominantemente la tomografía computarizada (TC) preoperatoria como su modalidad de imagen primaria. Aproximadamente el 12,7% de las publicaciones utilizan tanto la TC como la resonancia magnética (RM), mientras que la RM sola representa el 11,4% de los casos. Como se ilustra enFigura 2Una mayoría significativa (87,4%) de las publicaciones de este estudio utilizaron TC, RM o una combinación de estas dos tecnologías de imágenes.
Figura 2. Distribución de modalidades de imagen en diferentes estudios.
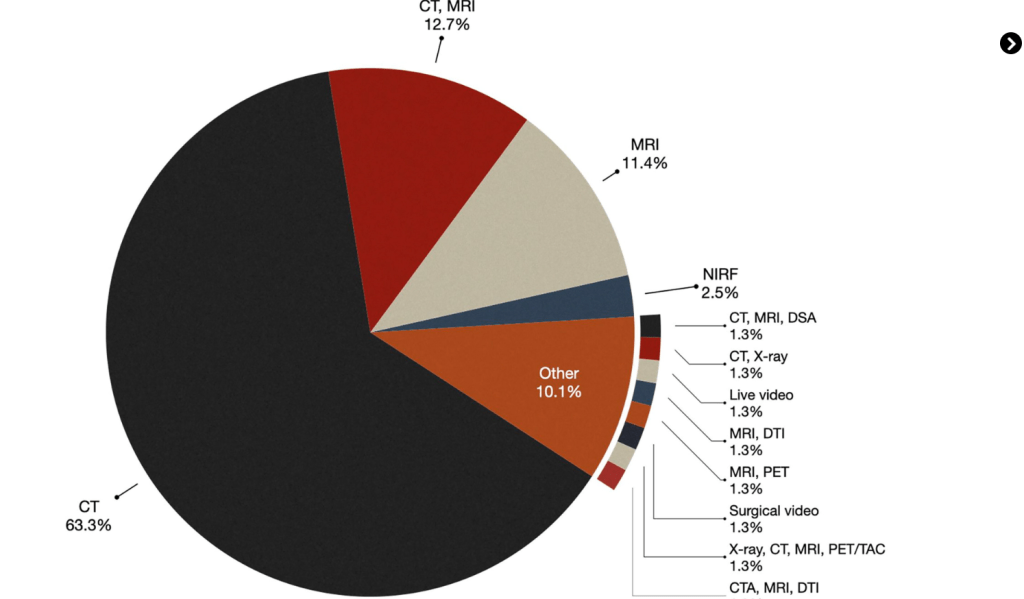
Se han publicado algunos artículos en los que se han utilizado otras modalidades de obtención de imágenes. Por ejemplo, en los estudios de Gorpas et al. [Citación6 ] y Alfonsoso-García et al. [Citación7 ] Se utilizó fluorescencia de infrarrojo cercano (NIRF). La obtención de imágenes moleculares con NIRF implica el uso de agentes de contraste que exhiben propiedades fluorescentes dentro de la ventana del infrarrojo cercano (NIR), que generalmente varía de 700 a 900 nanómetros (nm). Cabrilo et al. [Citación8 ] utilizaron la angiografía por sustracción digital (DSA), una técnica fluoroscópica utilizada en radiología intervencionista para visualizar los vasos sanguíneos, con TC y RMN. En el estudio de Liu et al. [Citación9 ] La tomografía por emisión de positrones (PET), que implica el uso de un fármaco radiactivo (trazador) para visualizar la actividad metabólica normal y anormal en el tejido, se utilizó en combinación con la resonancia magnética. Por último, Simone et al. [Citación10 ] combinaron PET, CT, MRI y rayos X para realizar una cirugía de resección multivisceral abierta para un adenocarcinoma gástrico avanzado.
3.1.2. Datos procesados visualmente
El enfoque principal de los datos procesados visualmente es su aspecto semántico, que se refiere a la interpretación de la información en una etapa quirúrgica específica. Este aspecto semántico puede ser anatómico, operativo o estratégico. La semántica anatómica se relaciona con la anatomía, fisiología o patología del paciente, mientras que la semántica operativa se relaciona con acciones o tareas, y la semántica estratégica implica planificación y orientación. La mayoría de los sistemas IGS de RM emplean una semántica anatómica. En otras palabras, crean representaciones visuales de la anatomía del paciente para ayudar a los cirujanos a localizar y navegar hacia un objetivo designado.
Un nuevo caso de uso que no se vio en el artículo de 2013 sobre semántica operativa proviene del uso de la telecirugía. Lu et al. [Citación11 ] desarrollaron un sistema que permite la videoconferencia en RA así como la presencia virtual de expertos remotos para orientación intraoperatoria en tiempo real. De manera similar, Sauer et al. [Citación12 ] describió el uso de HoloLens para consultas a distancia. El sistema permite una transmisión en vivo desde el HMD de un cirujano, lo que permite que los expertos remotos vean y se comuniquen en tiempo real con el cirujano que realiza la operación. Los expertos también podrían marcar estructuras dentro del sitio quirúrgico utilizando un lápiz en una tableta que luego podría ver el cirujano.
Existen tres subclases de datos procesados visualmente: datos de imágenes analizados, datos de conocimiento previo y datos derivados. Los datos de imágenes analizados se refieren a los datos primitivos utilizados en un sistema IGS de RM para mostrar información, como líneas, contornos, planos, superficies, estructuras alámbricas/mallas y volúmenes. Los datos de conocimiento previo incluyen información derivada de modelos genéricos, como atlas, mediciones o planes previos, modelos de herramientas e información de incertidumbre específica del sistema IGS. Los datos derivados son información procesada a partir de datos específicos del paciente o datos de conocimiento previo e incluyen etiquetas y mediciones intraoperatorias como distancias entre regiones de interés (ROI).
La mayoría de los sistemas se centran principalmente en la visualización de datos de imágenes analizados y, específicamente, modelos de pacientes preoperatorios obtenidos a partir de exploraciones de resonancia magnética y tomografía computarizada. En concreto, la mayoría de los artículos describieron la visualización de la estructura objetivo (por ejemplo, tumor, vértebras, hígado, etc.), la anatomía relevante alrededor de las estructuras objetivo, así como las estructuras de riesgo (por ejemplo, estructuras de riesgo vascular, como el nervio óptico o las arterias carótidas) como objetos anatómicos renderizados en 3D. Un número menor de artículos utilizó líneas o contornos para representar los márgenes de los objetos de interés. Por ejemplo, los investigadores que utilizaron la Navegación Microscópica de BrainLab con Leica ARveo (Brainlab, Múnich, Alemania) [Citación13–22 ] se presentaron con contornos que delineaban las estructuras anatómicas de interés que se proyectaban en el microscopio quirúrgico. Por último, algunos artículos utilizaron datos planos en forma de cortes axiales, sagitales o coronales. En los trabajos de Butler et al. [Citación23 ] y Bhatt y col. [Citación24 ] Se utilizó el sistema de realidad aumentada (RA) aprobado por la FDA para cirugía de columna, el sistema xvision-Spine (XVS) (Augmedics, Ltd, Filadelfia, PA, EE. UU.). En este sistema, no solo se puede proyectar la reconstrucción 3D de los elementos de la columna en la RA, sino que también se pueden mostrar cortes axiales y sagitales de TC en el campo visual. Otro ejemplo de uso de datos planares proviene del trabajo de Borgmann et al. [Citación25 ] que utilizaron gafas inteligentes (Google Glass) durante la cirugía. Debido a las limitaciones de este hardware específico, no se pueden registrar modelos anatómicos 3D para orientación, por lo que se mostraron cortes de TC del paciente en la esquina superior de las gafas (Figura 3(A)).
Figura 3. Diferentes tipos de datos visualizados y procesamiento. (A) Imagen de corte de TC visualizada en la esquina de Google Glass [Citación25 ]. (B) Contornos y transparencia utilizados en el HUD de BrainLab que muestran la lesión (amarillo), las arterias carótidas (azul), el quiasma (amarillo) y los nervios ópticos (naranja) [Citación26 ]. (C) Representación en malla de alambre del útero con tumor mostrado en amarillo [Citación27 ]. (D) Representación superficial de la columna vertebral, la vasculatura y la anatomía del tumor tal como se ve a través de HoloLens [Citación28 ]. (E) Representación del volumen de los vasos en cirugía neurovascular con colores que representan el flujo venoso/arterial [Citación29 ]

Algunos artículos visualizaron datos de conocimiento previo . Por ejemplo, Pratt et al. [Citación30 ] junto con una superposición de RA de la anatomía 3D de los músculos, huesos y articulaciones de la pierna, mostraba flechas codificadas por colores que se utilizan para identificar la ubicación subsuperficial de los perforantes vasculares, guiando al cirujano en la cirugía de reconstrucción de extremidades. Un grupo del Hospital Universitario Karolinska (Estocolmo, Suecia) que ha estado estudiando el impacto clínico de la RA en la cirugía de columna, utilizó la RA para visualizar datos de conocimiento previo en forma de planes quirúrgicos [Citación31–34 ]. Por ejemplo, en las referencias. [Citación32 ,Citación33 ], el punto de entrada del hueso identificado antes de la cirugía se muestra utilizando RA para orientación durante la cirugía. Utilizando el mismo sistema, Burström et al. también determinaron la ubicación de los marcadores de piel adhesivos a partir de transmisiones de video [Citación31 ]. Los marcadores adhesivos se resaltaron en verde y se visualizó una cuadrícula de referencia virtual que conecta los marcadores alrededor del campo quirúrgico para permitir que el cirujano comprenda el seguimiento y registro del paciente.
Un estudio reciente de Lim et al. introdujo un nuevo tipo de datos (vídeos quirúrgicos) que no se había encontrado anteriormente en la revisión de 2013. Los autores investigaron los beneficios ergonómicos de utilizar gafas de realidad aumentada en comparación con los monitores tradicionales en la cirugía asistida por vídeo. Al proyectar el vídeo laparoscópico en gafas de realidad aumentada, observaron una mejor postura del cirujano y una reducción de la fatiga muscular en comparación con el vídeo que se mostraba en un monitor durante la cirugía.
Sólo hubo un par de artículos que informaron sobre el uso de datos derivados . Los trabajos de Alphonso-García et al. [Citación7 ] y Gorpas et al. [Citación6 ] utilizaron medidas intraoperatorias de autofluorescencia (utilizando NIRF) para determinar tipos de tejidos cancerosos/necróticos u otros.
3.2 Procesamiento de la visualización
El segundo componente de la taxonomía DVV, el procesamiento de visualización, describe cómo se transforman y visualizan los datos. El propósito de considerar el procesamiento de visualización es enfatizar la importancia de determinar los métodos óptimos para la transformación y visualización de datos para tareas o escenarios quirúrgicos específicos. El procesamiento de visualización implica determinar si los datos deben segmentarse y renderizarse en superficie o en volumen, cómo deben colorearse y determinar cómo, en un entorno de RM, deben combinarse con el mundo real para permitir una guía quirúrgica intuitiva.
En consonancia con los hallazgos de 2013, la mayoría de los artículos utilizaron técnicas simples de procesamiento de visualización.
La representación de superficies con codificación de colores y/o transparencia fue el enfoque más común para representar objetos virtuales. En las publicaciones seleccionadas, como se ilustra enFigura 4Más de la mitad de los artículos (54,4 %) utilizaron la representación de superficies y la codificación por colores de los datos anatómicos, mientras que el 22,8 % mencionó la representación de superficies sin especificar la codificación por colores. Solo el 5,1 % utilizó la representación de superficies con codificación por colores y transparencia. Curiosamente, a diferencia de los hallazgos de 2013, donde aproximadamente un tercio de las publicaciones no detallaron los métodos de visualización, solo el 3,8 % de los artículos seleccionados no especificaron (o no era evidente a partir de las figuras incluidas) alguna forma de procesamiento de visualización. Esto sugiere un creciente reconocimiento entre los investigadores de la importancia de la visualización de datos reflexiva para proporcionar una guía eficaz a los usuarios finales.
Figura 4. Distribución del procesamiento de visualización en diferentes estudios.

La representación de superficies fue el método más común para representar datos virtuales. Normalmente, los investigadores segmentan los datos anatómicos relevantes para el procedimiento quirúrgico y aplican códigos de colores a diferentes objetos anatómicos para facilitar su identificación. Por ejemplo, en el trabajo de Golse et al. [Citación35 ] que describe un sistema de RA para cirugía abierta de hígado, los autores combinan la representación de la superficie del hígado (en color caqui) con transparencia para revelar el árbol biliar y los vasos (verde y azul) dentro del hígado.
Un ejemplo de uso de la transparencia proviene de los estudios que utilizaron la plataforma de navegación de BrainLab con el HUD de microscopios Zeiss o Leica ARveo (Brainlab, Múnich, Alemania). Aquí, las representaciones 3D semitransparentes de datos preoperatorios, como tumores, tractografía y vértebras, se codifican por colores y se proyectan en la vista del cirujano (verFigura 3(B)). Los estudios que utilizaron este sistema incluyen el trabajo de Carl et al. [Citación17 ] quienes utilizaron el HUD del microscopio quirúrgico Pentero (Zeiss, Oberkochen, Alemania) con el sistema BrainLab para proyectar vértebras semitransparentes codificadas por colores (y ocasionalmente nervios espinales) en la vista del microscopio. Las vértebras podrían ser representadas en superficie, es decir ( modo 3D ) o mostradas como contornos ( modo de línea ). En el modo de línea, se visualizan los contornos de la extensión de la anatomía perpendicular al eje de visualización del microscopio en el plano focal y una línea de puntos indica la extensión máxima del objeto más allá del plano focal. El mismo sistema y procesamiento de visualización fueron utilizados por Carl et al. [Citación36 ] en cirugía transesfenoidal para visualizar datos anatómicos, como tumores, arterias carótidas, nervios ópticos y el quiasma. En trabajos similares [Citación16 ], los autores destacaron la flexibilidad de la visualización, señalando que el color del objeto podría ajustarse fácilmente para lograr un mejor contraste si el color de fondo comienza a parecerse demasiado al color del objeto.
Un pequeño subconjunto de artículos utilizó renderizado de estructura alámbrica/malla (verFigura 3(C)) para visualizar datos anatómicos. Por ejemplo, en el estudio de Bourdel et al. [Citación37 ], que examinó un sistema de RA para cirugía ginecológica para visualizar adenomiomas, los autores emplearon la representación en malla. En este enfoque, el objeto virtual se representa como una malla en lugar de un objeto representado en la superficie, lo que permite a los espectadores percibir la anatomía real a través de la malla. De manera similar, Golse et al. [Citación35 ] utilizaron una malla de superficie virtual superpuesta sobre el hígado en su trabajo. La malla se deforma en función de un modelo elástico del hígado basado en la física, para guiar a los cirujanos durante la cirugía hepática abierta.
A pesar de los avances en hardware gráfico, solo una pequeña fracción de los artículos (<2%) utilizaron renderización de volumen para visualizar los objetos virtuales. Un ejemplo de renderización de volumen proviene de Wierzbicki et al. [Citación38 ] quienes realizaron un estudio con ocho pacientes utilizando HoloLens2 para guiar la ablación por microondas en el contexto de tumores gastrointestinales. Los autores proporcionaron hologramas de imágenes torácicas renderizadas en volumen para facilitar la planificación y servir como herramienta de apoyo a la toma de decisiones durante la operación. Llegaron a la conclusión de que la visualización 3D de la anatomía renderizada en volumen ayudó a la localización del tumor y a la planificación del acceso óptimo a la patología.
3.3. Vista
El tercer componente de la taxonomía DVV, Vista, abarca tres componentes: percepción, ubicación, visualización y herramientas de interacción.
3.3.1. Ubicación de la percepción
La ubicación de percepción se refiere al área específica dentro del entorno del usuario donde se presenta la visualización de RM.Tabla 3clasifica los artículos en función de la ubicación de percepción utilizada en el sistema. Mientras que la revisión de 2013 encontró que el 43% de los artículos identificaron el paciente/campo quirúrgico como la ubicación de percepción, la mayoría de los estudios (63,3%) ahora utilizaron el paciente/campo quirúrgico. Este cambio refleja una tendencia hacia la incorporación de información visual directamente en el campo quirúrgico a través de técnicas, como la proyección de datos sobre el paciente utilizando HMD o integrándolos dentro de la vista del microscopio.
En la revisión de 2013 [Citación2 ], hubo tres artículos (3,4 %) que permitieron que la ubicación de la percepción fuera tanto una pantalla como el paciente, nuestra revisión identificó un subconjunto más grande de artículos (15,6 %) que adoptaron un enfoque híbrido, utilizando tanto el campo quirúrgico como el monitor . Esta combinación tiene las ventajas de la visualización directa dentro del campo quirúrgico y también los beneficios de los sistemas de visualización basados en pantallas externas visibles para todo el personal en el quirófano. Además, esta configuración proporciona un alto grado de flexibilidad en la visualización de información aumentada, lo que permite presentaciones personalizadas según las demandas únicas de cada paso o procedimiento quirúrgico.
Si bien la mitad de los artículos de la revisión de 2013 [Citación2 ], en los que se utilizaron únicamente monitores, observamos que una minoría de los artículos (11,4 %) empleaban pantallas de monitor . Este método puede facilitar la colaboración y la comunicación entre el equipo quirúrgico al proporcionar una visualización compartida durante los procedimientos. Sin embargo, este enfoque requiere desviar la atención de los cirujanos del campo quirúrgico, lo que provoca cambios de enfoque que pueden ser perjudiciales para la tarea quirúrgica [Citación39 ], específicamente en los casos en que el cirujano no navega basándose en transmisiones de video, como en la cirugía endoscópica o laparoscópica.
Cabe destacar en cuatro publicaciones [Citación10 ,Citación12 ,Citación25 ,Citación40 ], identificamos la ubicación de la percepción como el campo de visión . Usamos el término campo de visión (FOV) para caracterizar situaciones en las que las imágenes no se registran en la anatomía del paciente, sino que se muestran a través de anteojos inteligentes o un HMD (verFigura 3(A)). En estos casos, incluso si los cirujanos desvían su atención del campo quirúrgico, aún pueden ver las imágenes. Este grupo representó el (5,1%) del total de estudios que hemos analizado.
La fracción restante de publicaciones, que representa el 6,4% en este estudio, optó por un enfoque más diversificado al combinar dos o tres lugares de percepción diferentes. Por ejemplo, Chengrun Li et al. [Citación41 ] utilizaron una combinación de campo quirúrgico, campo de visión y monitor como su ubicación de percepción. Este enfoque sugiere un esfuerzo deliberado por integrar múltiples configuraciones de visualización, lo que permite una mayor flexibilidad en la forma en que se presentan los datos visualizados al equipo quirúrgico.
3.3.2. Visualización
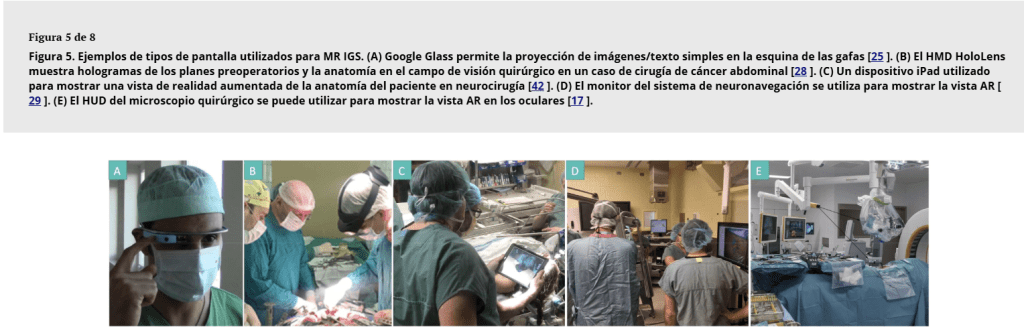
La pantalla se refiere al hardware específico utilizado para presentar la vista de RM a los usuarios, por ejemplo, HMD, monitores, microscopios, etc. (consulteFigura 5).
Figura 5. Ejemplos de tipos de pantalla utilizados para MR IGS. (A) Google Glass permite la proyección de imágenes/texto simples en la esquina de las gafas [Citación25 ]. (B) El HMD HoloLens muestra hologramas de los planes preoperatorios y la anatomía en el campo de visión quirúrgico en un caso de cirugía de cáncer abdominal [Citación28 ]. (C) Un dispositivo iPad utilizado para mostrar una vista de realidad aumentada de la anatomía del paciente en neurocirugía [Citación42 ]. (D) El monitor del sistema de neuronavegación se utiliza para mostrar la vista AR [Citación29 ]. (E) El HUD del microscopio quirúrgico se puede utilizar para mostrar la vista AR en los oculares [Citación17 ].
Dominio quirúrgico
Nuestro objetivo fue identificar tendencias en el uso de IGS por RM en dominios quirúrgicos específicos entre el artículo de 2013 [Citación2 ] y ahora.Figura 7presenta los resultados comparativos de estas dos revisiones de literatura.Figura 8ilustra el porcentaje de cada tipo de cirugía incluido en esta revisión. En el artículo de 2013, la mayoría de los artículos describían sistemas de RM para neurocirugía, en consonancia con que se trata de una de las primeras aplicaciones para cirugía guiada por imágenes o asistida por computadora. Como mencionó Shuhaiber [Citación65 ] esto puede atribuirse a la naturaleza compleja y sensible de la neurocirugía, donde existe la necesidad de minimizar el daño a áreas elocuentes del cerebro. La neurocirugía representa el 20,3% (16 artículos) de los artículos revisados; sin embargo, de ellos, cabe mencionar que cinco artículos [Citación15 ,Citación16 ,Citación18 ,Citación45 ,Citación66 ] se centraron en la neurocirugía de la columna, mientras que el resto, 11 de 16 artículos, se centraron en la cirugía de tumores cerebrales.
Figura 7. Tipo de cirugía: comparación entre la revisión de 2013 [Citación2 ] y la revisión actual para el recuento de artículos para cada tipo de cirugía.


Como se puede ver enFigura 7La cirugía ortopédica ha aumentado significativamente en términos de pruebas en el quirófano, 5 artículos publicados entonces y 18 ahora. Esto representa el 22,8% de las publicaciones revisadas, el dominio más dominante en nuestra revisión. Los sistemas IGS se utilizaron para mejorar la precisión de la colocación de implantes y la reducción de fracturas en procedimientos ortopédicos. Cabe destacar que, dentro de este dominio, 16 artículos (88%) se centraron en la cirugía de columna, mientras que 2 artículos [Citación30 ,Citación67 ] estaban en el ámbito de la cirugía articular.
La cirugía craneomaxilofacial también ha experimentado un aumento en los sistemas IGS de RM que se han incorporado al quirófano (de 12 artículos a 15 artículos). La cirugía craneomaxilofacial surgió como el tercer dominio quirúrgico más prevalente, representando el 19,0% de las publicaciones revisadas. Dentro de este dominio, un subconjunto notable de la investigación (13,3%) se dedicó a la condición específica de la craneosinostosis [Citación49 ], una anomalía congénita caracterizada por la fusión prematura de las suturas craneales que conduce a una forma anormal del cráneo y posibles complicaciones neurológicas.
Las cirugías endoscópicas y laparoscópicas, en las que se utiliza una lente telescópica con una cámara de video para guiar los instrumentos quirúrgicos hacia la anatomía del paciente a través de pequeñas incisiones o cerraduras, representaron la cuarta proporción más alta de estudios, lo que representa el 7,6% del total [Citación21 ,Citación22 ,Citación35 ,Citación36 ,Citación59 ,Citación68 ,Citación69 ]. Sin embargo, en términos de recuento, se trata de una reducción con respecto a la revisión de 2013, donde 14 artículos analizaron los sistemas de RM para cirugía endoscópica, mientras que en nuestras publicaciones seleccionadas solo lo hicieron 6. La cirugía endoscópica y laparoscópica se utilizó en el contexto del hígado [Citación35 ,Citación59 ,Citación68 ], basado en el cráneo [Citación21 ,Citación22 ], transesfenoidal [Citación36 ], y cirugía de los senos nasales [Citación22 ].
Procedimientos de hepatectomía (hígado) [Citación12 ,Citación35 ,Citación52 ,Citación62 ,Citación70 ] representaron el 6,3% de los artículos publicados en esta área y fueron consistentes en términos de conteo con respecto a la revisión de 2013 (6 artículos entonces y 5 ahora).
Además de los dominios quirúrgicos mencionados anteriormente, la RM en IGS encontró aplicación en otros dominios quirúrgicos, urología [Citación25 ,Citación71 ], torácico [Citación41 ,Citación54 ,Citación64 ], tiroidectomía [Citación40 ,Citación53 ,Citación72 ], y laparotomía [Citación10 ,Citación28 ], que en conjunto constituyen el 13,9% de las publicaciones revisadas. Por ejemplo, en cirugía hepática, se utilizó la guía por RM para identificar y navegar alrededor de estructuras anatómicas críticas, incluidos los vasos sanguíneos y los conductos biliares [Citación70 ]. En cirugía vascular, la RM se utilizó para guiar los procedimientos de cateterización y optimizar la colocación del stent para mejorar los resultados clínicos [Citación14 ].
Aproximadamente el 10,1% de los estudios abarcaron el uso de RM examinado en otras especialidades quirúrgicas, incluida la cirugía plástica de mama [Citación54 ], cirugía colorrectal, ginecología [Citación37 ], tumorectomía de mama [Citación73 ], cirugía gastrointestinal [Citación38 ], prostatectomía [Citación74 ], cirugía vascular [Citación14 ] y colecistectomía (es decir, extirpación de la vesícula biliar) [Citación75 ]. Dentro de estos dominios quirúrgicos, la RM se estudió para tareas como la localización de tumores, la resección precisa de ganglios linfáticos y la identificación de estructuras anatómicas críticas.
Por último, si bien las cirugías cardíacas representaron el 7% de los sistemas IGS en la revisión de 2013 [Citación2 ], no encontramos ningún artículo reciente que introduzca sistemas IGS de RM en este dominio. Esto indica un alejamiento de la adopción de la RM en la cirugía cardíaca, posiblemente debido a la complejidad de estos procedimientos.
4. Validación y evaluación
En la siguiente sección, describimos la validación y evaluación de los sistemas IGS de RM en los artículos seleccionados. Comenzamos brindando una descripción general del número de casos quirúrgicos por especialidad médica y luego, para los estudios clínicos más completos, describimos los criterios cualitativos y cuantitativos que se utilizaron para evaluar los sistemas descritos.
4.1 Casos quirúrgicos
Tabla 4proporciona un resumen del número de estudios y el número de casos quirúrgicos, es decir, pacientes, investigados para cada tipo de cirugía. Como se puede ver en la tabla, la cirugía ortopédica surgió como el dominio con la investigación de RM más extensa, con un total de 18 estudios clínicos. Estos estudios abarcaron colectivamente 440 casos quirúrgicos, lo que constituye el 27,6% del total de casos analizados en nuestra revisión.
Tabla 4. Número de casos estudiados en varios tipos de cirugías (otras incluye plástica, hepatectomía, gastrointestinal, ginecológica, colorrectal, tumorectomía).
Descargar CSVMesa de exhibición
La neurocirugía fue el foco principal de 16 estudios de investigación que, en conjunto, examinaron 369 casos quirúrgicos, lo que representa el 23,2 % del total de casos incluidos en el análisis. La importante cantidad de estudios refleja la importancia de los procedimientos guiados por imágenes en el contexto de la neurocirugía.
Las cirugías endoscópicas y laparoscópicas fueron el foco de seis estudios de investigación, que involucraron un total acumulado de 340 casos quirúrgicos, lo que representó el 21,4% del total de casos quirúrgicos analizados. Estos estudios fueron diseñados para explorar las posibles aplicaciones de la RM en procedimientos mínimamente invasivos.
La toracoscopia, una técnica quirúrgica para examinar y tratar la cavidad torácica, fue el foco de tres estudios de investigación. Estas investigaciones examinaron colectivamente 145 casos quirúrgicos, lo que representa el 9,1% del total de casos en el análisis. Las cirugías maxilofaciales, que abarcan procedimientos craneofaciales y dentales, representaron 15 estudios de investigación distintos con 77 casos quirúrgicos, lo que representa el 4,8% del total de casos considerados en nuestro análisis. Por último, la aplicación de RM en IGS en dominios quirúrgicos adicionales, como cirugía vascular, cirugía hepática, tiroidectomía, urología y prostatectomía, se exploró en un número limitado de estudios. Estos dominios representaron una proporción menor de casos, que oscilaron entre el 1,1 y el 3,6% del total.
4.2 Estudios clínicos a gran escala
En esta sección, nos centramos en los artículos que probaron un sistema de RM en 15 o más casos quirúrgicos.Tabla 5, hacemos referencia a cada uno de los trabajos, su contexto clínico, el número de casos quirúrgicos que se realizaron y los criterios de evaluación que se utilizaron.
Tabla 5. Estudios incluidos: componentes evaluados o validados (≥15 pacientes).
Descargar CSVMesa de exhibición
4.2.1. Cirugía ortopédica
Butler y otros. [Citación23 ] realizaron un estudio prospectivo que incluía 164 casos de cirugía de columna mínimamente invasiva que incluían la colocación de 606 tornillos pediculares. Evaluaron el tiempo de colocación percutánea de tornillos en procedimientos quirúrgicos y encontraron un tiempo promedio de 3 min y 54 s por tornillo y que la curva de aprendizaje no afectó significativamente los tiempos quirúrgicos. El estudio también encontró una baja tasa de reemplazos de tornillos intraoperatorios (0,49%) y la ausencia de complicaciones posoperatorias, como radiculopatía o déficit neurológico.
Aoyama y otros. [Citación76 ] realizó un estudio en el que participaron 49 pacientes para evaluar el uso de RA en cirugía de columna. Su investigación se centró en la precisión de la identificación del nivel de la apófisis espinosa durante la cirugía, tanto con el uso de un HMD de RA como sin él. Los resultados del estudio mostraron que sin un HMD, la tasa de identificación errónea del nivel fue significativamente mayor (26,5 %) que cuando se utilizó RA para superponer información de guía holográfica sobre el paciente (14,3 %). El estudio también mostró que en los casos en los que se produjo una identificación errónea sin un HMD, la adición de una evaluación de HMD ayudó a reconfirmar con precisión el nivel en casi la mitad de los casos (46,2 %). Además, la tasa de identificación errónea tendió a ser mayor en la columna toracolumbar, pero el uso de un HMD redujo significativamente el rango de identificación errónea a un cuerpo vertebral.
Edström y otros [Citación33 ] realizó un estudio comparativo que incluyó un total de 44 casos, donde 15 casos de deformidad se trataron utilizando navegación quirúrgica AR (ARSN), mientras que 29 casos se trataron utilizando un enfoque convencional de manos libres (FH). Todas las cirugías fueron realizadas por el mismo cirujano ortopédico de columna. El estudio evaluó varios resultados clave, con un enfoque principal en la densidad del implante, incluido el tornillo pedicular, el gancho y la densidad combinada del implante. El estudio también consideró varios resultados secundarios, incluido el tiempo del procedimiento, la efectividad de la corrección de la deformidad, la duración de la estadía hospitalaria y la pérdida de sangre. Los autores encontraron que tanto los grupos ARSN como FH tenían una construcción general de alta densidad (>80% de densidad total de implantes) pero que el grupo ARSN tenía una densidad de tornillos pediculares significativamente mayor (86,3 frente a 74,7%, p < 0,05). El tiempo del procedimiento y la corrección de la deformidad no fueron significativamente diferentes entre los grupos.
En otro estudio del sistema ARSN [Citación32 ], los investigadores utilizaron un quirófano híbrido para facilitar los ajustes en tiempo real comparando la colocación real de los tornillos con las trayectorias planificadas previamente mediante superposiciones de realidad aumentada. Los autores descubrieron que el sistema ARSN minimizaba la exposición a la radiación al reducir la necesidad de fluoroscopia continua. Aunque los tiempos quirúrgicos iniciales aumentaron debido a la obtención de imágenes y la planificación adicionales (que representan aproximadamente el 8 % del tiempo total de la cirugía), estos pasos mejoraron significativamente la eficiencia quirúrgica general, lo que redujo el riesgo de complicaciones y la necesidad de cirugías de revisión. Además, con las optimizaciones del flujo de trabajo, los investigadores pudieron reducir significativamente el tiempo total medio del quirófano de 84 a 46 minutos por nivel.
El estudio ARSN también fue evaluado en el trabajo de Elmi-Terander et al. [Citación34 ], donde se comparó con la técnica FH en pacientes con escoliosis, cifosis y otras afecciones. Cada grupo comprendía 20 pacientes, que estaban bien emparejados en función del diagnóstico clínico y la proporción de tornillos colocados en la columna torácica frente a la lumbosacra. El grupo ARSN demostró una proporción significativamente mayor de tornillos clínicamente precisos (93,9 frente a 89,6 %, p < 0,05) y el doble de tornillos colocados sin una ruptura cortical (63,4 frente a 30,6 %, p < 0,0001) en comparación con el grupo FH.
En otro estudio de colocación de tornillos pediculares realizado por Bhatt et al. [Citación24 ], se probó la eficacia de HMD AR en 32 pacientes con un total de 222 tornillos. Se emplearon imágenes 3D intraoperatorias para evaluar la precisión de los tornillos, utilizando la escala de clasificación de Gertzbein-Robbins (GR). Solo cuatro tornillos (1,8 %) se consideraron mal colocados y requirieron revisión, mientras que los 218 tornillos restantes (98,2 %) se colocaron con precisión. Más específicamente, de los 208 tornillos colocados con AR con confirmación de imágenes 3D, el 97,1 % se consideró clínicamente preciso, con el 91,8 % clasificado como Grado A y el 5,3 % como Grado B. Además, no hubo eventos adversos o complicaciones intraoperatorias, y la tecnología AR no se abandonó en ningún caso. Además, el estudio no informó complicaciones quirúrgicas posoperatorias tempranas ni necesidad de cirugías de revisión durante el período de seguimiento de 2 semanas.
En un estudio de Guo et al. [Citación55 ], que revisó retrospectivamente a 21 pacientes con fracturas de escápula, los autores compararon dos grupos: el Grupo I (nueve pacientes) que se sometieron a fijación convencional y el Grupo II (12 pacientes) que tuvieron simulación virtual preoperatoria y fijación asistida por navegación intraoperatoria utilizando un sistema AR-escapular. En el Grupo II, la simulación virtual preoperatoria tomó un promedio de 44,42 min, con 16,08 min necesarios para el contorno de la placa. El Grupo II mostró tiempos de operación significativamente más cortos y pérdida de sangre reducida (28,75 min y 81,94 ml menos, respectivamente; p < 0,05) en comparación con el Grupo I. El número de placas utilizadas fue ligeramente menor en el Grupo II, pero no estadísticamente significativo y los resultados funcionales en el seguimiento no fueron estadísticamente significativos entre los dos grupos. No se observaron complicaciones para ningún paciente. Estos hallazgos sugieren que AR en la cirugía de fractura de escápula puede conducir a tiempos de cirugía más cortos, pérdida de sangre reducida y resultados funcionales similares en comparación con las técnicas convencionales.
En un estudio de Burström et al. [Citación31 ] que involucró cuatro cadáveres y 20 pacientes que se sometieron a cirugía de columna con colocación de tornillos pediculares, se utilizó tecnología AR para identificar el punto de entrada al hueso. El estudio incluyó un total de 366 dispositivos pediculares. La precisión técnica media general para la colocación de tornillos pediculares fue de 1,65 ± 1,24 mm en el punto de entrada al hueso. En particular, la precisión técnica para el estudio cadavérico ( n = 113) fue de 0,94 ± 0,59 mm, mientras que el estudio clínico ( n = 253) informó una precisión ligeramente menor de 1,97 ± 1,33 mm. Un análisis de 253 tornillos pediculares en 35 CBCT no encontró diferencias estadísticamente significativas entre la posición relativa de CBCT y la precisión técnica. Además, un subanálisis de todos los CBCT que involucraban específicamente la unión toracolumbar, donde la respiración podría afectar teóricamente la precisión, no reveló diferencias en la precisión entre los niveles lumbar o torácico ( p = 0,22).
Por último, en un estudio prospectivo de casos y controles realizado por Hu et al. [Citación79 ], se investigaron un total de 18 pacientes, con nueve pacientes en el grupo de cirugía de columna asistida por computadora AR (ARCASS) que tenían 11 niveles de lesiones, y el grupo de control que consistía en nueve pacientes con 10 niveles de lesiones. El grupo ARCASS había reducido significativamente el uso de fluoroscopia (6 frente a 18, p < 0,001) y tiempos operatorios más cortos (78 frente a 205 s, p < 0,001) durante el proceso de identificación del punto de entrada y anestesia local. Además, el grupo ARCASS logró una precisión superior, con una proporción significativamente mayor de puntos de entrada «buenos» en comparación con el grupo de control tanto en las vistas lateral (81,8 frente a 30,0 %, p = 0,028) como anteroposterior (72,7 frente a 20,0 %, p = 0,020).
Estos estudios combinados muestran que la tecnología de RA ofrece beneficios significativos en comparación con las técnicas a mano alzada en el contexto de la colocación de tornillos pediculares. La RA mejora la eficiencia de la colocación de tornillos pediculares en cirugías de columna mínimamente invasivas, reduciendo el tiempo promedio por tornillo y dando como resultado tasas de complicaciones más bajas. Tiene una alta precisión, independientemente del nivel de la columna, y se ha demostrado que supera la cirugía tradicional a mano alzada en términos de densidad de implantes. Además, se encontró que los procedimientos guiados por RA eran seguros, con una colocación incorrecta mínima de los tornillos y sin complicaciones. Los resultados de la cirugía de fractura de escápula mostraron que las técnicas asistidas por RA tienen el potencial de conducir a tiempos de operación más cortos y una pérdida de sangre reducida, manteniendo resultados funcionales similares en comparación con los métodos convencionales. Estos hallazgos sugieren que la RA tiene el potencial de mejorar la precisión y la eficiencia en una variedad de procedimientos quirúrgicos ortopédicos.
4.2.2. Neurocirugía
Liu y otros. [Citación9 ] realizaron un estudio con planificación preoperatoria utilizando Slicer y guía de RA usando un teléfono inteligente en 77 casos de glioma cerebral. Evaluaron varios indicadores quirúrgicos entre el grupo experimental y el grupo de control, incluidas las tasas de resección total, la estadía hospitalaria después de la cirugía, el tiempo de cirugía y la calidad de vida del paciente (QOL) utilizando la escala de desempeño de Karnofsky (KPS). Los resultados de su estudio mostraron que el número de casos con resección total, la estadía hospitalaria después de la cirugía y el tiempo de cirugía fueron significativamente mejores en el grupo del teléfono inteligente en comparación con el grupo de control. También encontraron que después del tratamiento, la puntuación KPS fue significativamente mayor en el grupo experimental (75,66 ± 4,01 frente a 65,3 ± 5,23). Los resultados sugieren que la planificación preoperatoria en 3D Slicer combinada con la guía intraoperatoria del teléfono inteligente puede mejorar la precisión de la cirugía del glioma cerebral, facilitando la resección total al tiempo que salvaguarda la función neuronal de los pacientes.
En otro estudio sobre tumores cerebrales realizado por Kim et al. [Citación19 ], se investigaron los posibles beneficios de utilizar un sistema de RA en 34 casos. El estudio fue un estudio de un solo brazo sin un grupo de control y no incluyó análisis estadístico ni medidas de resultados específicas. Sin embargo, los resultados sugirieron que la integración de un sistema de RA es beneficiosa para los neurocirujanos, en particular aquellos que pueden tener menos experiencia, y que la visualización de RA puede mejorar los flujos de trabajo al proporcionar información de guía intuitiva.
El trabajo de Incekara et al. presenta un estudio tumoral que incluyó a 25 pacientes. En este trabajo, los autores compararon la localización del tumor utilizando HoloLens con el sistema de neuronavegación estándar. Encontraron que en el 40% de los casos, los tumores se localizaron como con el sistema de neuronavegación y que, en promedio, la desviación en la localización de HoloLens con respecto a la ubicación real del tumor fue de 0,4 cm. Se encontró que el tiempo promedio para la planificación preoperatoria utilizando Hololens (5 min 20 s) fue significativamente más largo que utilizando el sistema de neuronavegación estándar (4 min 25 s); sin embargo, los autores informaron una mejor ergonomía y concentración al utilizar HoloLens.
Goto y otros. [Citación44 ] estudiaron la eficacia de un sistema de navegación de RA en una cohorte de 15 pacientes consecutivos con tumores selares y paraselares. El sistema de navegación de RA demostró una utilidad significativa para mejorar la comprensión tridimensional inmediata de las lesiones y las estructuras circundantes. Utilizando una escala original de cinco puntos, dos neurocirujanos y tres residentes superiores que participaron en las cirugías endoscópicas de la base del cráneo evaluaron el sistema de navegación de RA como altamente efectivo en 5 de los 15 casos y con una puntuación de 4 o más en 13 casos. La puntuación media en todos los casos fue de 4,7 (intervalo de confianza del 95 %: 4,58-4,82), lo que significa que el sistema de navegación de RA fue tan útil o incluso más beneficioso que la navegación convencional, y solo dos casos presentaron ligeros desafíos en la percepción de la profundidad.
Bopp y otros. [Citación26 ] informan sobre una serie de 165 cirugías transesfenoidales realizadas por un solo cirujano, en las que 81 pacientes se sometieron a cirugía sin AR y 84 pacientes con AR. Se utilizó un registro basado en iCT y se descubrió que mejoraba significativamente la precisión del AR (medido por el error de registro del objetivo, TRE) a 0,76 ± 0,33 mm, en comparación con el abordaje basado en puntos de referencia con un TRE de 1,85 ± 1,02 mm. En términos de duración quirúrgica, el tiempo no fue significativamente diferente entre los dos grupos; sin embargo, el tiempo requerido para el registro del paciente aumentó en ∼12 min (32,33 ± 13,35 frente a 44,13 ± 13,67 min). Esto se consideró razonable, dado que se consideró que el AR mejoraba la orientación quirúrgica, aumentaba la comodidad del cirujano y mejoraba la seguridad del paciente. Estos beneficios se observaron no solo en pacientes con cirugía transesfenoidal previa, sino también en casos que involucraban variaciones anatómicas.
Carl y otros. [Citación16 ] realizaron un estudio que incluía 42 procedimientos neuroespinales, incluidos 12 tumores intradurales y ocho extradurales, otras siete lesiones intradurales, 11 casos degenerativos, dos infecciones y dos deformidades. En estos procedimientos, se utilizó el sistema Zeiss Brain Lab HUD AR. Los autores analizaron el error de registro, el flujo de trabajo quirúrgico, la visualización de RA y la radiación. Los resultados de sus estudios mostraron que la RA se podía integrar fácilmente en un procedimiento de flujo de trabajo quirúrgico normal y que la visualización de estructuras anatómicas superpuestas en el campo quirúrgico permitía una guía intuitiva. También informaron un error de registro medio bajo (≈1 mm) y una dosis de radiación reducida para los procedimientos de iCT de aproximadamente el 70%.
En otro estudio de Carl et al. [Citación14 ], que involucra a 20 pacientes y 22 aneurismas, los autores utilizaron un ICG-AR (Angiografía AR con Verde de Indocianina) con el microscopio quirúrgico Kinevo900. El ICG-AR mejoró la manipulación quirúrgica y la interpretación del flujo sanguíneo durante la angiografía con ICG. Los cirujanos podían ver la información del ICG-AR directamente a través de los oculares del microscopio con luz blanca, eliminando la necesidad de pantallas separadas. La visualización AR mejoró la comprensión de la anatomía vascular 3D para el clipado del aneurisma. Además de informar TRE (0,71 ± 0,21 mm) y la dosis efectiva intraoperatoria de TC de baja dosis (42,7 µSv ), los autores informaron la cantidad de veces que se realizaron ajustes para compensar el desplazamiento del cerebro y crear una vista AR más precisa. Se realizaron ajustes lineales y rotacionales (en 2D) en 18 de 20 pacientes y se aplicaron 28 veces (traslación, n = 28; rango = 1–8,5 mm; ajuste rotacional, n = 3; rango = 2,9–14,4°). Aunque esto generó una AR más precisa, no pudo compensar las deformaciones 3D en profundidad. Por último, los autores también informaron que ocurrieron complicaciones quirúrgicas en dos casos (10 %), lo que es una tasa similar en comparación con la videoangiografía con ICG tradicional. En un caso, la ICG-AR reveló una oclusión incompleta del aneurisma, lo que llevó a la colocación de un clip adicional. En otro caso, la ICG-AR identificó un flujo insuficiente en una rama del vaso, lo que resultó en el reposicionamiento del clip.
Rychen y otros. [Citación20 ] también estudiaron la guía de RA para procedimientos neurovasculares en un estudio de 18 procedimientos de revascularización consecutivos en una cohorte de 15 pacientes. Los procedimientos abarcaron varias patologías, incluida la enfermedad/síndrome de Moyamoya, oclusión vascular intracraneal, oclusión carótida interna extracraneal y aneurisma de la arteria cerebral media (ACM). La tecnología de RA demostró ser una herramienta valiosa durante toda la cirugía, mejorando significativamente la seguridad y la eficacia durante pasos quirúrgicos específicos, incluida la disección microquirúrgica del vaso donante (STA), la adaptación de la craneotomía por encima del vaso receptor (rama M4 de la ACM), los ajustes de la craneotomía para preservar la arteria meníngea media (AMM) y las modificaciones para preservar la arteria precentral (CPM).
Como se puede observar en los estudios descritos, las tecnologías de RM han demostrado ser prometedoras en la mejora de la precisión quirúrgica, la reducción de errores de registro y la mejora de los resultados de los pacientes en una variedad de procedimientos neuroquirúrgicos. Los estudios destacan además el potencial de la RM para aumentar los flujos de trabajo quirúrgicos, mejorar la visualización y contribuir a obtener mejores resultados quirúrgicos.
4.2.3. Endoscópica/laparoscópica
Zeiger y otros. [Citación22 ] realizaron un estudio que incluía 134 casos con diversas afecciones patológicas, incluidos tumores de la base del cráneo anterior, enfermedad inflamatoria de los senos nasales y fugas de líquido cefalorraquídeo. Los datos de imágenes preoperatorias se utilizaron para generar modelos 3D de la anatomía del paciente que se utilizaron en la planificación quirúrgica y permitieron a los cirujanos anticipar estructuras críticas durante los procedimientos endoscópicos utilizando el sistema de Brainlab. Los autores informaron que los cirujanos encontraron que la tecnología era útil para guiar la disección ósea e identificar puntos de referencia anatómicos importantes, como las arterias carótidas internas y los nervios ópticos.
Linxweiler y otros [Citación69 ] realizaron un estudio exhaustivo en el que participaron 100 pacientes con enfermedad sinusal crónica, comparando el software de navegación convencional con la navegación con RA. Sus resultados no demostraron ninguna diferencia significativa en el tiempo de operación entre los dos sistemas, lo que indica la viabilidad de la integración con RA sin comprometer la eficiencia. El estudio también destacó la importancia de la experiencia del cirujano, ya que las operaciones realizadas por médicos experimentados fueron notablemente más cortas. Sin embargo, todos los cirujanos informaron altos niveles de precisión con la guía basada en RA.
Carl y otros. [Citación36 ] llevaron a cabo una serie consecutiva de un solo cirujano que incluía 288 procedimientos transesfenoidales. En esta extensa serie, 47 pacientes (16,3%) se sometieron a RA basada en microscopio para visualizar las estructuras objetivo y de riesgo durante las intervenciones quirúrgicas. La precisión de la RA dependía de la precisión de la navegación y la calibración del microscopio. Los pacientes con registro basado en fiduciales tenían un error de registro objetivo de 2,33 ± 1,30 mm. El registro automático basado en iCT, que es independiente del usuario, mejoró significativamente la precisión de la RA (TRE = 0,83 ± 0,44 mm, p < 0,001). Además, el uso de protocolos de iCT de baja dosis redujo la dosis efectiva del escaneo de registro de iCT, y no se observaron lesiones vasculares ni empeoramiento de los déficits neurológicos en la serie. La RA mejoró en gran medida la orientación durante las reoperaciones y en pacientes con variaciones anatómicas, contribuyó a aumentar la comodidad del cirujano y a mejorar los flujos de trabajo quirúrgicos. Los autores mencionaron además que las visualizaciones de AR mejoraron la percepción 3D en comparación con la visualización estándar de líneas discontinuas a través del HUD del microscopio quirúrgico.
En un estudio dirigido por Schneider et al. [Citación59 ], se utilizó un sistema AR IGS, SmartLiver, en la resección hepática laparoscópica (LLR). En este estudio que involucró a 18 pacientes, siete se sometieron a LLR y 11 a una laparoscopia de estadificación convencional. El objetivo principal del estudio fue lograr un registro exitoso según lo determinado por el cirujano operador, y los objetivos secundarios incluyeron evaluar la usabilidad del sistema a través de un cuestionario para el cirujano y comparar la precisión del registro manual frente al semiautomático. En 16 de los 18 pacientes, el punto final primario se cumplió con éxito después de superar un problema inicial relacionado con la distinción de la superficie del hígado de las estructuras circundantes, gracias a la implementación de un algoritmo de aprendizaje profundo. La precisión media del registro fue de 10,9 ± 4,2 mm para el registro manual y de 13,9 ± 4,4 mm para el registro semiautomático, con comentarios positivos de los cirujanos con respecto al manejo del sistema y la orientación intraoperatoria mejorada. Sin embargo, hubo sugerencias para simplificar el proceso de configuración y mejorar la integración con la ecografía laparoscópica. El estudio no evaluó el impacto de SmartLiver en los resultados perioperatorios ya que aún está en desarrollo.
Los resultados de estos estudios demostraron la viabilidad de integrar la RM en la cirugía laparoscópica y endoscópica para diversos procedimientos. Los resultados iniciales no muestran un impacto significativo en el tiempo de operación y subrayan la importancia de la experiencia del cirujano y la posible mejora en la precisión que se puede lograr con los sistemas de RM.
4.2.4. Colecistectomía
Diana y otros. [Citación75 ] realizó un estudio con 58 pacientes sometidos a colecistectomía por litiasis de vesícula biliar. En su estudio, la planificación se realizó en modelos de VR y se utilizó AR. Además, se inyectó verde de indocianina por vía intravenosa antes y después de la disección del triángulo de Calot. Los autores encontraron que el uso de la planificación de VR 3D identificó con éxito 12 variantes anatómicas en ocho pacientes, y solo siete de estas variantes fueron informadas con precisión por los radiólogos, lo que indica una diferencia estadísticamente significativa ( p = 0,037). Además, la VR permitió la detección de una variante peligrosa, lo que motivó el uso de un enfoque de «fondo primero». La visualización de la unión cístico-conducto biliar común se logró antes de la disección del triángulo de Calot en el 100% de los casos con VR, en el 98,15% con NIR-C y en el 96,15% con IO. Además, la duración para obtener imágenes relevantes se redujo significativamente con NIR-C en comparación con VR ( p = 0,008) y IOC ( p < 10 −7 ). Por último, la calidad de las imágenes se evaluó utilizando una escala Likert de 5 puntos, revelando que NIR-C puntuó comparativamente más bajo en comparación con AR ( p = 0,018) y IOC ( p < 0,0001). Estos hallazgos demuestran el uso de imágenes multimodales con RM para una colecistectomía precisa, destacando el potencial de estas técnicas de visualización para complementarse entre sí y mitigar el riesgo de lesiones biliares.
4.2.5 Cirugía torácica
Li y otros. [Citación41 ] investigaron la aplicación de RA en la segmentectomía o subsegmentectomía toracoscópica para cánceres de pulmón tempranos, en un estudio que incluyó a 142 pacientes. El estudio comparó el uso de modelos pulmonares 3D mostrados en pantalla ( n = 87) o impresos y mostrados usando RA ( n = 55) durante la cirugía en el quirófano. Los datos de resultados quirúrgicos, tanto antes como después del emparejamiento por puntaje de propensión, demostraron que el uso de impresión 3D con RA resultó en una duración reducida de la cirugía ( p = 0,001 y 0,001, respectivamente), disminución de la pérdida de sangre intraoperatoria (= 0,024 y 0,006, respectivamente) y una estadía hospitalaria más corta ( p = 0,001 y 0,001, respectivamente) en comparación con el grupo en pantalla. Sin embargo, no hubo diferencias significativas en las complicaciones y la tasa de éxito del procedimiento ( p = 0,846 y >0,999, respectivamente) y ( p = 0,567 y >0,999, respectivamente). Además, los cirujanos asignaron puntuaciones más altas al grupo tangible en comparación con el grupo en pantalla ( p = 0,001 frente a 0,001, respectivamente). Esta investigación destaca la viabilidad y los beneficios potenciales de la RA con impresión 3D para mejorar la visualización y la precisión quirúrgicas.
4.2.6 Urología
Borgmann y otros. [Citación25 ] realizaron un estudio en el que participaron siete cirujanos urológicos, entre ellos tres urólogos certificados y cuatro residentes de urología. En el estudio, se utilizó tecnología de RA en 10 tipos diferentes de cirugías y un total de 31 procedimientos urológicos. La viabilidad de la cirugía asistida por RA se evaluó utilizando metadatos técnicos, que incluían la cantidad de fotografías tomadas, la cantidad de videos grabados y el tiempo total de video grabado durante los procedimientos. Además, se realizaron entrevistas estructuradas con los urólogos participantes para recopilar información sobre su uso de la guía quirúrgica. También se registraron y calificaron las complicaciones según la clasificación de Clavien-Dindo. No se observaron complicaciones específicas durante los procedimientos quirúrgicos. Sin embargo, durante el curso posoperatorio, se produjeron un total de 6 complicaciones entre la serie de 31 cirugías urológicas de diversa complejidad, que iban desde procedimientos simples, como la vasectomía, hasta procedimientos complejos como la cistectomía. Las complicaciones de grado I incluyeron dos infecciones del tracto urinario (después de la RTUB y la adenomectomía de próstata) y una infección superficial de la herida (después de la adenomectomía de próstata). Las complicaciones de grado II comprendieron dos casos de íleo (después de una cistectomía abierta) y un caso de fuga anastomótica (después de una prostatectomía radical laparoscópica). Es importante destacar que todos los cirujanos informaron que no experimentaron distracciones relevantes mientras usaban la guía quirúrgica AR durante la cirugía. Esta investigación subraya la viabilidad de implementar AR en cirugía urológica en una variedad de procedimientos.
4.2.7. Prostatectomía
En un estudio de Porpiglia et al. [Citación74 ], 40 pacientes se sometieron a procedimientos de cáncer de próstata. Veinte pacientes se sometieron a prostatectomía radical asistida por robot con AR elástica 3D (3D AR-RARP), mientras que el grupo de control tuvo el procedimiento cognitivo 2D tradicional (2D Cognitive RARP). En ambos enfoques, AR 3D y Cognitivo 2D, la afectación capsular (CI) se identificó con precisión en las imágenes preoperatorias, y la evaluación microscópica confirmó la presencia de cáncer en áreas sospechosas identificadas por ambos métodos. El grupo AR 3D mostró una identificación de CI más precisa (100%) que el grupo Cognitivo 2D (47,0%). Además, hubo una ventaja estadísticamente significativa para el grupo AR 3D en la detección de lesiones cancerosas durante la fase de conservación de nervios (NS). A pesar de la necesidad de segmentación y alineación manual de imágenes, que los autores mencionaron como una deficiencia del sistema, los autores concluyeron que la introducción de modelos virtuales 3D elásticos simula eficazmente la deformación de la próstata durante la cirugía, lo que conduce a una localización precisa de la lesión, reduciendo potencialmente la tasa de margen quirúrgico positivo y optimizando simultáneamente los resultados funcionales.
4.2.8. Craneomaxilofacial
El estudio de Zhu et al. [Citación78 ] introdujeron un sistema de RA para visualizar los nervios alveolares inferiores (IAN) en 20 pacientes sometidos a cirugía craneomaxilofacial. La investigación se centró en evaluar la precisión del sistema y la precisión del registro en los 20 casos y se descubrió que era de 0,96 ± 0,51 mm. Los autores concluyeron además que la cirugía maxilofacial con RA ofrece los beneficios de una operación fácil de usar y precisión, lo que en última instancia mejora el rendimiento quirúrgico general.
5. Desafíos y limitaciones
La aplicación de los sistemas MR IGS ha demostrado un gran potencial, sin embargo, siguen existiendo algunos desafíos y limitaciones que fueron mencionados en los artículos encuestados.
En primer lugar, la integración de los sistemas IGS de RM introduce una curva de aprendizaje para los cirujanos, que, si bien no afecta necesariamente a los tiempos quirúrgicos, enfatiza la importancia de la capacitación y la familiaridad. Múltiples estudios han demostrado que los casos iniciales y los realizados por cirujanos experimentados tienen tiempos quirúrgicos comparables, lo que indica un impacto mínimo en la eficiencia quirúrgica [Citación23 ]. En neurocirugía craneal, los equipos experimentados no informaron ninguna curva de aprendizaje debido a la experiencia previa con el apoyo de RA basado en microscopio [Citación15 ]. Sin embargo, aún queda por determinar la importancia de la curva de aprendizaje en la cirugía de columna, en particular para la educación de los residentes [Citación16 ]. Cabe destacar que la baja adopción de la navegación manual o robótica por computadora en las cirugías de columna se atribuye a menudo a curvas de aprendizaje de adopción pronunciadas [Citación80 ].
En términos de visualización, si bien los HMD son una herramienta prometedora para la cirugía asistida por RM, HoloLens y dispositivos similares tienen limitaciones notables. La baja resolución de estos dispositivos a veces es perjudicial para la calidad y fidelidad de las imágenes 3D que reproducen, lo que puede impedir la precisión requerida en entornos quirúrgicos. Además, el campo de visión horizontal restringido de 30° puede dificultar la experiencia general del usuario al limitar su percepción espacial [Citación11 ]. Además del campo de visión limitado, el rendimiento de la cámara, las limitaciones en el aumento y los problemas con la fuente de luz también pueden afectar negativamente la capacidad de capturar campos quirúrgicos profundos con precisión [Citación47 ,Citación61 ]. Además, es importante señalar que la batería recargable, que normalmente admite de 2 a 3 horas de uso activo, plantea una limitación adicional, especialmente durante procedimientos quirúrgicos más prolongados [Citación61 ]. Por último, el uso prolongado de gafas puede provocar incomodidad e incluso mareos, lo que plantea dudas sobre su practicidad durante procedimientos quirúrgicos prolongados [Citación24 ,Citación40 ]. Finalmente, como lo demostraron Condino et al. [Citación81 ] En un estudio de laboratorio, los HMD ópticos transparentes actuales sufren limitaciones tecnológicas que reducen su idoneidad para aplicaciones quirúrgicas. En concreto, sus señales de enfoque incorrectas a corta distancia pueden afectar negativamente a la precisión de localización, que es fundamental en aplicaciones quirúrgicas.
En el trabajo de Cecceraglia et al. [Citación58 ] los autores mencionaron varios desafíos específicos basados en sus experiencias con el uso de HoloLens. Estos incluían que cuando el cirujano está operando con un asistente, la imagen virtual o el holograma pueden aparecer en una posición espacial diferente en cada una de sus vistas (incluso después del registro manual por parte del cirujano), además, las luces del quirófano pueden afectar la calidad de los hologramas y la superposición del holograma en el campo quirúrgico puede obstruir la vista del sitio quirúrgico y las estructuras anatómicas. Este último punto también fue mencionado en el trabajo de Bopp et al. [Citación26 ] quienes escribieron que la gran cantidad de información de RA visualizada dentro de la vista microscópica del sistema que probaron puede ocultar la visión clara del campo quirúrgico. Tang et al. [Citación52 ] que utilizaron un iPad para la realidad aumentada también mencionaron que la vista de realidad aumentada puede cubrir partes del campo quirúrgico que pueden no ser deseadas. Además, la línea de visión de la cámara intraoperatoria en sus estudios a veces estaba obstruida por las manos del cirujano o los instrumentos quirúrgicos, lo que en consecuencia reducía la precisión de las imágenes 3D superpuestas.
Aunque no son específicos de los sistemas de RM, se mencionaron los desafíos relacionados con la deformación de los tejidos blandos, el movimiento de los órganos y la ausencia de puntos de referencia óseos fijos como factores que complican la precisión de los sistemas IGS de RM [Citación56 ,Citación59 ]. Además, numerosos artículos mencionaron problemas en términos de flujo de trabajo, ya sea preoperatoriamente, incluido el tiempo para crear modelos virtuales y configurar sistemas (por ejemplo, [Citación44 ,Citación56 ,Citación71 ]) así como introspectivamente el tiempo necesario para el registro. Por ejemplo, Sasaki et al. [Citación82 ] mencionan que el tiempo necesario para registrar la imagen virtual 3D en el campo quirúrgico (lo cual hacen de forma manual) es complicado y provoca una interrupción en el proceso quirúrgico cada vez que se debe realizar. En algunos casos, también surge la necesidad de registro postoperatorio y registro retrospectivo debido a dificultades intraoperatorias [Citación59 ]. De hecho, numerosos grupos mencionaron la precisión del registro como una limitación de sus sistemas (por ejemplo, [Citación11 ,Citación28 ]).
A pesar del aumento en el número de estudios clínicos, el diseño de estudios para acceder a sistemas IGS de RM para procedimientos quirúrgicos ha tenido algunas limitaciones, incluido el uso de estudios retrospectivos y no prospectivos, tamaños de muestra pequeños y la ausencia de grupos de control [Citación17 ,Citación33 ,Citación34 ,Citación55 ,Citación56 ]. Medir los beneficios específicos de la resonancia magnética y abordar el sesgo potencial en las evaluaciones subjetivas durante los ensayos aleatorizados también son aspectos desafiantes. Estas limitaciones resaltan la necesidad de diseños de estudios clínicos más sólidos y estandarizados para evaluar el impacto de los sistemas de IGS de resonancia magnética en los resultados quirúrgicos.
En términos de costo, la inversión inicial necesaria para adquirir y mantener sistemas de RM también puede limitar su accesibilidad, especialmente para instituciones de salud con restricciones presupuestarias [Citación46 ,Citación61 ,Citación72 ,Citación83 ,Citación84 ]. Además, la participación de un miembro del equipo de tecnología para operar y mantener estos sistemas puede aumentar los costos operativos y puede generar dificultades para encontrar personal calificado para administrar la tecnología de manera efectiva. A pesar de algunos esfuerzos para lograr sistemas de bajo costo, estos también pueden tener limitaciones. Por ejemplo, Yodrabum et al. [Citación51 ] mencionaron algunas desventajas de sus enfoques de AR de bajo costo, entre ellas la distorsión de la imagen y la necesidad de un asistente que sostenga el dispositivo móvil quieto y fijo a una distancia y un ángulo adecuados para capturar el campo quirúrgico. Esto provocó que el movimiento del cirujano fuera limitado y tuviera que moverse entre el paciente y el dispositivo para aprovechar la vista aumentada.
6. Discusión
En esta sección, presentamos los aspectos más destacados y las observaciones extraídas de la literatura revisada sobre las aplicaciones de la RM en procedimientos guiados por imágenes.
6.1. Datos
En términos de datos de imágenes en bruto, como se esperaba, la mayoría de los sistemas se basan en datos de imágenes de TC o RM. Sorprendentemente, a pesar del aumento del uso de ultrasonidos en el ámbito clínico, no encontramos sistemas que integraran el ultrasonido con la RM. Sin embargo, con el reciente aumento de la investigación que combina tecnologías de RM con ultrasonidos, como ayuda en la adquisición de ultrasonidos (p. ej., [Citación85 ]), facilitando el aprendizaje y la interpretación de la ecografía [Citación86 ] y volver a registrar imágenes intraoperatorias para tener en cuenta factores como el desplazamiento cerebral [Citación87 ]), anticipamos que el ultrasonido se utilizará cada vez más con RM en sistemas IGS.
En lo que respecta a los datos visualizados, casi todos los sistemas aprovechan las representaciones visuales en 3D de la anatomía del paciente para ayudar a los cirujanos. Sorprendentemente, pocos artículos abordaron la visualización de datos de conocimiento previo, como atlas, y hubo usos o representaciones novedosas limitadas en términos de datos. A pesar del uso limitado de conocimiento previo y datos derivados en los artículos de la encuesta, postulamos que en el futuro se integrarán más sensores en los quirófanos y se utilizarán más modelos de IA, lo que dará como resultado nuevos tipos de mediciones preoperatorias e intraoperatorias. Por lo tanto, anticipamos la visualización de incertidumbres inherentes a los modelos de IA o la información de guía, así como la cuantificación de distancias intraoperatorias y volúmenes tumorales residuales en vistas de RA.
6.2 Procesamiento de la visualización
Nuestra revisión destaca que la mayoría de los artículos de investigación todavía tienden a favorecer las técnicas de visualización convencionales, que se basan principalmente en la representación de superficies. Este enfoque a menudo se complementa con codificación por colores y transparencia para facilitar la distinción de objetos anatómicos. Sin embargo, también hemos notado una creciente conciencia entre los investigadores con respecto a la importancia de una visualización de datos bien pensada para mejorar la eficacia de la guía quirúrgica. Cabe destacar los casos en los que la RA se integra perfectamente con el procesamiento de la visualización, como se ve en los casos que involucran a Microscope Navigation de BrainLab y Leica ARveo. Estos casos brindan una visión prometedora del futuro de la investigación en este dominio. Aunque la representación de volumen sigue subutilizándose, sus posibles beneficios, como la localización de tumores y la planificación quirúrgica, son evidentes en un estudio realizado por Wierzbicki et al. [Citación38 ]. La exploración y el desarrollo continuos en el procesamiento de la visualización son importantes para maximizar el potencial de la RM en la cirugía.
6.3. Vista
En cuanto a las pantallas, la creciente popularidad de los HMD en los últimos años se puede atribuir en gran medida a los avances en ergonomía y facilidad de interacción. Estos dispositivos ofrecen ventajas significativas, ya que se pueden ajustar cómodamente delante de ambos ojos, lo que proporciona una experiencia inmersiva. Además, los modelos de HMD modernos son más ligeros que sus predecesores, lo que aborda las preocupaciones relacionadas con la fatiga física entre los usuarios.
Las tabletas y los teléfonos inteligentes no se utilizaron con frecuencia en los artículos encuestados, sin embargo, creemos en los resultados prometedores de los que se probaron en el quirófano [Citación48–50 ,Citación52 ,Citación56 ,Citación57 ] animará a más grupos a considerar estas soluciones de bajo costo. Léger et al. [Citación42 ], por ejemplo, proporcionan un sistema de neuronavegación interactiva de RA móvil de código abierto (MARIN) que realiza RA en tiempo real en un dispositivo móvil en el contexto de neurocirugía guiada por imágenes y puede allanar el camino para que otros traigan sistemas similares para realizar pruebas en el quirófano.
A pesar de la creciente popularidad de los HMD, es importante señalar que el panorama de las pantallas en el ámbito quirúrgico sigue siendo diverso. Se adaptan diversos dispositivos de visualización para satisfacer los requisitos únicos de diferentes dominios quirúrgicos. Al elegir dispositivos específicos para un procedimiento quirúrgico específico, resulta evidente que no existe una solución única para IGS. Para tomar la decisión adecuada para la pantalla, es esencial considerar cuidadosamente factores como el campo quirúrgico, las tareas específicas, los flujos de trabajo del cirujano y el entorno del quirófano.
En términos de dispositivos de interacción, el panorama se está alejando lentamente de las herramientas de interacción tradicionales, como teclados y ratones, y se están adoptando cada vez más métodos más avanzados y diversos, incluidas pantallas táctiles, gestos con las manos y comandos de voz que se usan más comúnmente con hardware, como tabletas y HMD.
6.4. Dominio quirúrgico
Descubrimos que, si bien muchas tendencias eran similares entre el estado del arte de 2013 y nuestro análisis, hubo algunos hallazgos nuevos. Por ejemplo, si bien la frecuencia de los sistemas utilizados para cirugías específicas fue similar en 2013 en términos de los dominios quirúrgicos más populares, surgieron varios dominios nuevos en los que se probó la RM (por ejemplo, cirugía torácica, urología, etc.), lo que subraya la creciente utilización de la RM en un espectro de dominios quirúrgicos. Además, el aumento de los artículos y, específicamente, los estudios clínicos que prueban la RM indican una creciente adopción de tecnologías de RM en la práctica clínica. Los estudios a gran escala en neurocirugía y cirugía de columna se pueden atribuir parcialmente a dos sistemas comerciales aprobados por la FDA para tecnología de RM, el Microscope Navigation de BrainLab con Leica ARveo o Zeiss Pentero y el sistema xvision de Augmedics.
6.5. General
Un aspecto importante que ha ganado atención a lo largo de los años es el costo de implementar sistemas de RM en entornos clínicos. Los investigadores y los profesionales están explorando cada vez más soluciones de bajo costo para hacer que estas tecnologías sean más accesibles y asequibles. Este cambio de enfoque hacia soluciones rentables demuestra la creciente conciencia e interés en democratizar el uso de estas tecnologías para una gama más amplia de aplicaciones y entornos quirúrgicos. Es probable que la asequibilidad del hardware, junto con las soluciones basadas en la nube y el software de procesamiento de imágenes inteligente, impulse la expansión de las aplicaciones de RM en un amplio espectro de dominios quirúrgicos [Citación54 ].
En términos de democratizar la atención clínica de alta calidad, un aspecto que fue mencionado por Balci et al. [Citación68 ], fue que las tecnologías de RM emergentes permitirán a los equipos quirúrgicos menos experimentados reducir la disparidad con sus contrapartes más experimentadas, mejorando la precisión de la planificación y la seguridad del procedimiento, reduciendo en última instancia la probabilidad de complicaciones derivadas de variaciones anatómicas desafiantes y permitiendo que el equipo opere dentro de márgenes de error específicos.
A pesar de los avances logrados, persisten varios desafíos en el campo de la resonancia magnética para procedimientos guiados por imágenes. Estos desafíos incluyen la necesidad de mejorar la precisión del registro, la visualización de datos en tiempo real, el seguimiento sólido y la integración perfecta de estas tecnologías en los flujos de trabajo quirúrgicos. Abordar estos desafíos será un paso importante para garantizar la utilización segura y eficaz de estas tecnologías en la práctica clínica diaria.
7. Conclusión
En la última década se han producido avances significativos en la aplicación de la RM para procedimientos guiados por imágenes. El aumento del uso de estas tecnologías en la fase preoperatoria, la creciente adopción en el quirófano, el desarrollo de dispositivos de visualización facial más ergonómicos y el enfoque en soluciones rentables demuestran la madurez de este campo. Sin embargo, siguen existiendo desafíos y se necesita más investigación para abordarlos y aprovechar al máximo el potencial de la RM para mejorar las intervenciones quirúrgicas. El futuro ofrece posibilidades apasionantes para la integración continua de estas tecnologías en la práctica clínica, lo que en última instancia conducirá a mejores resultados quirúrgicos y al avance de las técnicas quirúrgicas.