Xingyue Zhu ab ,Yang Chen c
China ha implementado negociaciones voluntarias de precios para medicamentos patentados en su regulación de reembolso farmacéutico. Estas negociaciones buscan atraer medicamentos con alto valor clínico para mejorar la eficiencia del fondo del seguro de salud y promover la salud social.
Se han incluido medicamentos oncológicos con mejores beneficios, como mayor tasa de respuesta tumoral o menor riesgo de progresión de la enfermedad, en la lista de reembolsos. Sin embargo, estos medicamentos no mostraron ventajas en la supervivencia general frente a los no reembolsados.
Priorizar regulatoriamente los medicamentos que mejoren significativamente los resultados clínicos incentivaría la participación de medicamentos de alto valor en las negociaciones de precios y facilitaría el acceso a ellos.
Objetivo
China comenzó a negociar los precios de los medicamentos en 2017 para incluir medicamentos patentados en la lista de reembolsos del Seguro Médico Básico (BMI). Desde 2020, la negociación anual de precios acepta solicitudes no solicitadas de las compañías farmacéuticas. No obstante, no está claro si estas negociaciones atraerán nuevos medicamentos con beneficios clínicos significativos para mejorar la eficiencia de asignación del BMI.
Método
Recopilamos las nuevas indicaciones oncológicas aprobadas en China entre enero de 2015 y junio de 2023, y verificamos su estado de reembolso en las negociaciones de 2020 a 2023. Definimos los beneficios clínicos como los efectos del tratamiento en el resultado primario del ensayo fundamental que respalda la aprobación. Los resultados se clasificaron en tasa de respuesta, tiempo hasta el evento y supervivencia general. Utilizamos una estrategia de variables instrumentales para explorar la asociación entre el estado de reembolso y la magnitud de los beneficios clínicos según el tipo de resultado.
Resultados
Se recogieron un total de 222 indicaciones oncológicas, de las cuales el 60,4 % obtuvo la elegibilidad para el reembolso a través de las negociaciones de precios. Las regresiones IV encontraron que las indicaciones reembolsadas tuvieron una tasa de respuesta 20 % mayor y una razón de riesgo 0,26 menor de incurrir en un evento específico que las no reembolsadas; pero los beneficios de supervivencia no difirieron entre los dos grupos.
Conclusión
Las negociaciones de precios en China han permitido que nuevos medicamentos con mayores beneficios indirectos ingresen al mercado de medicamentos de BMI, pero no han logrado atraer a aquellos con mayores beneficios para la supervivencia. Se necesitan innovaciones regulatorias para priorizar los medicamentos que validan el valor terapéutico en el proceso de toma de decisiones sobre reembolsos para refinar el acceso a los medicamentos.
Desarrollo:
Un sistema de atención sanitaria social desempeña un papel imperativo para garantizar el acceso equitativo a una atención sanitaria de calidad con protección contra riesgos financieros. China establece el Seguro Médico Básico (BMI) nacional para lograr una cobertura sanitaria universal, y ha mantenido asegurada a más del 95 % de la población china desde 2013 [ 1 ]. Sin embargo, el BMI solía ser criticado por la escasa inclusión de nuevos medicamentos en su lista de reembolso de medicamentos [ 2 , 3 ]. De 2007 a 2017, la lista nacional de reembolso de medicamentos se mantuvo sin cambios, lo que generó una enorme carga financiera de nuevos medicamentos para los pacientes [ 4 , 5 ]. Como tal, el gobierno chino hizo el primer intento de negociación de precios de medicamentos en 2015, y lo ha implementado formalmente desde 2017 para incluir nuevos medicamentos de marca de alto precio en la lista de reembolso [ 6 ]. Las negociaciones están impulsadas principalmente por la evaluación de tecnología sanitaria (HTA) para mejorar la eficiencia del fondo BMI [ 7 ]. Los medicamentos candidatos para las primeras tres negociaciones en 2017, 2018 y 2019 fueron seleccionados por los grupos de expertos, y las compañías farmacéuticas involucradas fueron invitadas a participar. Posteriormente (a partir de 2020), la negociación anual permite solicitudes no solicitadas de las compañías farmacéuticas. Se observó que la política de reembolso para nuevos medicamentos bajo el BMI no es obligatoria para todos los medicamentos lanzados en China. De hecho, hay un 40% de nuevos medicamentos que eligen no estar cubiertos por el BMI [ 8 ]. Esto es diferente de los países de altos ingresos donde las negociaciones de precios basadas en HTA también se aplican para respaldar la toma de decisiones de reembolso de medicamentos [ 9 ]. En la mayoría de estos países, las negociaciones se llevan a cabo sobre todos los nuevos medicamentos poco después del lanzamiento [ 10 ]. En China, sin embargo, las compañías farmacéuticas tienen la libertad de decidir si buscan o no la cobertura del BMI, lo que plantea una pregunta importante: ¿las negociaciones de precios traen medicamentos de alto valor al BMI? Investigaciones anteriores han demostrado la eficacia de las negociaciones de precios en la contención de los costos de los medicamentos [ [11] , [12] , [13] , [14] ]. Sin embargo, no está claro si la negociación de precios es en sí misma rentable, es decir, si el recurso finito del IMC se utiliza para apoyar medicamentos que presentan un mayor valor para distribuir los resultados de salud entre la comunidad de manera eficiente. Desde una perspectiva social, es de suma importancia que el asegurador de salud universal logre una eficiencia de asignación favorable para maximizar la salud de la sociedad [ 15]. Además, la negociación de precios china puede servir como referencia para los países de ingresos bajos y medios del Sur Global, en particular otros mercados emergentes BRICS (Brasil, Rusia, India, China y Sudáfrica) donde las necesidades de atención médica han ido en aumento, pero persisten importantes limitaciones de recursos públicos [ [16] , [17] , [18] , [19] ]. Además, dado que las compañías farmacéuticas tienen la discreción de participar o rechazar la negociación, es importante entender cómo responden a la regulación de precios. Este estudio busca ahondar en las asociaciones entre la negociación de precios y los beneficios clínicos de los nuevos medicamentos oncológicos, con el fin de proporcionar más evidencia de la eficacia de la actual política de reembolso de medicamentos en China.
Contextos institucionales
La negociación de precios la lleva a cabo anualmente el sector de seguros de salud chino, la Administración Nacional de Seguridad Sanitaria (NHSA). Los medicamentos patentados pueden presentar una solicitud para participar. Después de la revisión de escritorio, la NHSA invitará a dos grupos de expertos a evaluar de forma independiente los precios básicos de cada medicamento candidato. El primer grupo realizará un análisis de costo-efectividad y evaluará un precio de acuerdo con un umbral de costo-efectividad preestablecido (generalmente 0,5-1,5 PIB per cápita y 4 PIB per cápita para enfermedades raras). Los profesionales de instituciones académicas, centros de evaluación de tecnologías sanitarias y hospitales que sean competentes en evaluación de tecnologías sanitarias pueden participar en un examen sobre la metodología de análisis de costo-efectividad que organiza la NHSA. Aquellos que aprueben este examen pueden registrarse como expertos para el primer grupo. El segundo grupo realizará un análisis de impacto presupuestario y evaluará el otro precio de acuerdo con la capacidad de pago del IMC. Los expertos de este grupo están compuestos por funcionarios capacitados de las oficinas locales de seguros de salud, que por lo tanto están bien posicionados para evaluar el impacto presupuestario con mayor precisión utilizando los datos del IMC. En base a los dos precios proporcionados, la NHSA determinará el «precio global», que permanecerá confidencial para la empresa durante toda la negociación. La metodología para formar el precio global no se revela. Durante la negociación, una empresa tiene dos oportunidades para hacer una oferta, y si el precio ofrecido es ≤115 % del precio global, la NHSA negociará con la empresa para reducir aún más el precio a un nivel inferior al del precio global. Los medicamentos que acepten el precio negociado se prescribirán a expensas del BMI y de los individuos, y por lo tanto la tasa de reembolso también se determina en la negociación. Si el precio ofrecido es demasiado alto, la negociación terminará en fracaso y los medicamentos deberán ser pagados completamente por los individuos. Después de la negociación, las empresas pueden solicitar que el precio final y su tasa de reembolso se mantengan confidenciales.
En el caso de los medicamentos a los que se les ha concedido la posibilidad de reembolso, el precio debe ajustarse cada dos años. En el ajuste de precios, si el gasto real en medicamentos supera significativamente su presupuesto (es decir, > 110 % del presupuesto), el precio del medicamento debe reducirse aún más.
Fundamento teórico
Algunos de los principales factores que afectan la decisión de una compañía farmacéutica de solicitar un reembolso pueden ilustrarse mediante la elasticidad precio de la demanda de un medicamento específico. En teoría general, si un producto es inelástico, por ejemplo, un producto monopólico, aumentar su precio puede mejorar los ingresos ( Fig. 1 A); por el contrario, para productos elásticos, como un producto genérico, reducir el precio es una estrategia más rentable ( Fig. 1 B). Sin embargo, para un producto farmacéutico patentado que enfrenta poca competencia en el mercado, la curva de demanda puede ser más compleja ( Fig. 1 C): cuando el precio es alto ( P > P *), la demanda carece de elasticidad ya que solo hay unos pocos pacientes que pueden pagar este medicamento; mientras que, cuando el precio cae a un nivel bajo, por ejemplo, inferior a la disposición a pagar de la mayoría ( P < P *), el número de pacientes que pueden pagar el medicamento aumentará considerablemente y el medicamento puede volverse elástico. Además, la sustituibilidad de un medicamento en su enfermedad objetivo puede afectar la elasticidad precio. Por lo tanto, la toma de decisiones de las compañías farmacéuticas está influenciada por el tamaño del grupo de pacientes, la capacidad de pago de la mayoría de los pacientes y el panorama del tratamiento de una enfermedad específica. Para un medicamento de alto valor que trata una enfermedad común con una superioridad clínica significativa, una reducción de precio puede ser aceptable, ya que el tamaño del mercado potencial es lo suficientemente grande como para respaldar una estrategia de «venta a granel barata». Sin embargo, para un medicamento de alto valor que trata una enfermedad ultra rara, el mercado es bastante limitado y la compañía puede optar por renunciar a la negociación del precio y la cobertura del BMI. En esta situación, incluso si el precio del medicamento cae hasta el punto que la mayoría de los pacientes pueden soportar, la cantidad que los pacientes demandan sigue siendo menor que la escala que permite el aumento de los ingresos, lo que se muestra como que la curva de demanda está restringida dentro del rango inelástico (similar a la Figura 1 A). Sería difícil observar completamente estos factores relacionados con la elasticidad del precio. En consecuencia, se deben utilizar metodologías adecuadas para tener en cuenta el sesgo potencial resultante de la omisión de variables como el tamaño del grupo de pacientes, la capacidad de pago de la mayoría de los pacientes y la competencia de medicamentos dentro de la clase.
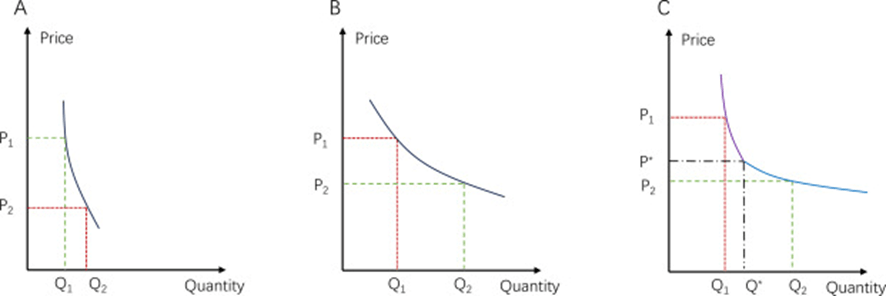
Fig. 1. Ejemplos de elasticidad precio de la demanda. P denota precio y Q denota cantidad. A, la curva de demanda de un fármaco inelástico. La línea discontinua verde denota el ingreso mayor ( P × Q ), mientras que la línea discontinua roja denota el ingreso menor. Bajar el precio reducirá el ingreso de los productos inelásticos. B, la curva de demanda de un fármaco elástico. Bajar el precio aumentará el ingreso de los productos elásticos. C, elasticidad mixta. Cuando el precio P es mayor que la disposición a pagar de la mayoría ( P *), el producto es inelástico (la línea violeta); mientras que el producto puede volverse elástico si P < P * (la línea azul). Q * denota la cantidad de demanda por debajo de P *, en la que el aumento de la cantidad conducirá a la conversión de elasticidad.
| Variable | Reembolsado, media (DE) | No reembolsado, media (DE) | Valor p |
| Nivel de indicación | |||
| Acuerdo de confidencialidad (0/1) | 0,61(0,49) | 0,28(0,45) | <0,01 |
| Patrocinador nacional (0/1) | 0,55(0,50) | 0,26(0,44) | <0,01 |
| Suplemento post-aprobación (0/1) | 0,59(0,49) | 0,51(0,50) | 0,253 |
| Tumores sólidos (0/1) | 0,78(0,41) | 0,74(0,44) | 0,441 |
| Tiempo hasta el reembolso (mes) | 15.34(8.21) | \ | \ |
| Nivel de prueba | |||
| Pequeño ensayo fundamental (0/1) | 0,39(0,49) | 0,40(0,49) | 0,755 |
| Fase III (0/1) | 0,65(0,48) | 0,67(0,47) | 0,746 |
| Aleatorización (0/1) | 0,69(0,47) | 0,67(0,47) | 0.802 |
| Control: un solo brazo (0/1) | 0,34(0,47) | 0,33(0,47) | 0,923 |
| Control: placebo (0/1) | 0,40(0,49) | 0,40(0,49) | 0,974 |
| Control: comparador activo (0/1) | 0,27(0,44) | 0,27(0,45) | 0,947 |
| Prueba pequeña (0/1) | 0,39(0,49) | 0,41(0,49) | 0,755 |
| Beneficio: tasa de respuesta | 0,57(0,21) | 0,53(0,23) | 0,420 |
| Beneficio: tiempo hasta el evento (HR) | 0,46(0,15) | 0,51(0,15) | 0,311 |
| Beneficio: SO (RRHH) | 0,71(0,11) | 0,69(0,11) | 0,412 |
La Tabla 2 mostró los resultados de las asociaciones de la elegibilidad de reembolso obtenida a través de la negociación de precios con los beneficios clínicos del medicamento. Entre las indicaciones con puntos finales basados en la respuesta y puntos finales de tiempo hasta el evento, la prueba de endogeneidad sugirió que el estado de reembolso no era exógeno, destacando las preocupaciones del sesgo de variable omitida. Las estadísticas F de la primera etapa fueron mayores de 10 para los dos tipos de puntos finales sustitutos, lo que indica que los instrumentos fueron lo suficientemente fuertes para predecir el estado de reembolso. Las estadísticas F de Kleibergen-Paap rk LM fueron significativas, lo que también indica que los instrumentos fueron relevantes. Las estadísticas de Sargan no fueron significativas, lo que mejora nuestra confianza en la exogeneidad de los instrumentos. Con base en los modelos IV, se encontró que las indicaciones reembolsadas tenían una tasa de respuesta 20 % más alta y un HR 0,26 más bajo de incurrir en un evento específico que las no reembolsadas. Para las indicaciones con una medición de SG, la prueba de endogeneidad no rechazó su hipótesis nula de la exogeneidad del estado de reembolso. En consecuencia, el estimador MCO fue mejor que el estimador IV. El modelo MCO mostró que el beneficio de supervivencia de los que recibieron el reembolso no fue estadísticamente diferente del de los que no recibieron el reembolso. La prueba de vínculo para el modelo MCO de supervivencia global indicó que la variable dependiente estaba correctamente especificada.
Tabla 2. Asociaciones entre el estado de reembolso y el beneficio clínico del medicamento.
| Variables | Tasa de respuesta | Tiempo hasta el evento (HR) | Sistema operativo (RR.HH.) | ||||||
| Celda vacía | (1) MCO | (2) Primera etapa | (3) 2SLS | (4) MCO | (5) Primera etapa | (6) 2SLS | (7) MCO | (8) Primera etapa | (9) 2SLS |
| Reembolso | 0,04 (0,06) | 0,20 (0,07) ⁎⁎⁎ | 0,05 (0,05) | −0,26 (0,07) ⁎⁎⁎ | 0,05 (0,03) | -0,01 (0,04) | |||
| Instrumentos | |||||||||
| Acuerdo de confidencialidad | 0,10(0,05) ⁎⁎ | 0,41 (0,09) ⁎⁎⁎ | −0,9(0,03) ⁎⁎⁎ | 0,14 (0,11) | −0,03(0,03) | 0,47 (0,12) ⁎⁎⁎ | |||
| Patrocinador nacional | 0,04(0,05) | 0,29 (0,09) ⁎⁎⁎ | −0,04(0,04) | 0,26 (0,10) ⁎⁎ | −0,04(0,04) | 0,40 (0,12) ⁎⁎⁎ | |||
| Pequeña prueba | 0,05(0,05) | -0,14 (0,12) | −0,12(0,04) ⁎⁎⁎ | 0,34 (0,09) ⁎⁎⁎ | -0,002(0,03) | −0,32 (0,13) ⁎⁎ | |||
| Controles | |||||||||
| Clase de aprobación | −0,07(0,05) | 0,18(0,10) * | −0,12(0,05) ⁎⁎ | 0,04(0,04) | -0,07(0,11) | 0,04(0,05) | −0,07(0,03) ⁎⁎ | 0,31(0,11) ⁎⁎⁎ | −0,06(0,03) * |
| Tipo de cáncer | −0,15(0,05) ⁎⁎⁎ | −0,08(0,10) | −0,15(0,05) ⁎⁎⁎ | 0,01(0,04) | −0,001(0,15) | 0,01(0,06) | 0,01(0,06) | −0,12(0,17) | 0,01(0,06) |
| Año de aprobación | 0,04(0,02) * | −0,13(0,04) ⁎⁎⁎ | 0,06(0,02) ⁎⁎⁎ | 0,01(0,02) | −0,18(0,04) ⁎⁎⁎ | −0,04(0,02) ⁎⁎ | 0,02(0,01) * | 0,001(0,04) | 0,01(0,01) |
| Tipo de control | \ | \ | \ | 0,01(0,04) | 0,11(0,09) | 0,05(0,04) | 0,04(0,03) | 0,06(0,10) | 0,04(0,03) |
| norte | 80 | 80 | 80 | 71 | 71 | 71 | 71 | 71 | 71 |
| Primera etapa F-stat | 14,90 ⁎⁎⁎ | 12.30 ⁎⁎⁎ | 6.18 ⁎⁎⁎ | ||||||
| Prueba de endogeneidad | 3,96 ⁎⁎ | 11.20 ⁎⁎⁎ | 1.51 | ||||||
| Kleibergen-Paap rk LM F-stat | 21,54 ⁎⁎⁎ | 21.44 ⁎⁎⁎ | 20.22 ⁎⁎⁎ | ||||||
| Estadísticas de Sargan | 2.49 | 2.289 | 0,53 | ||||||
| Valor p de la prueba de enlace | 0,062 | 0,844 | 0,816 | ||||||
Notas: Los errores estándar robustos se encuentran entre paréntesis. MCO, mínimos cuadrados ordinarios. MCO2, mínimos cuadrados en dos etapas. NDA, solicitud de nuevo fármaco. HR, razón de riesgo. SG, supervivencia general.
⁎p < 0,10.⁎⁎p < 0,05.⁎⁎⁎p < 0,001.
Robustez
Comparamos además los beneficios clínicos de los medicamentos entre las indicaciones que solicitaron proactivamente la negociación y aquellas sin intención de obtener el reembolso, lo que reflejó la respuesta de las empresas a la negociación de precios. De acuerdo con las listas emitidas de medicamentos candidatos que habían pasado la revisión de escritorio antes de que comenzaran las negociaciones formales, recopilamos el estado de la solicitud de cada indicación. Los resultados de las asociaciones del estado de la solicitud de negociación con los beneficios clínicos del medicamento se resumieron en la Tabla 3. Se observó que la estadística F de la primera etapa implicaba las preocupaciones de los instrumentos débiles y, por lo tanto, empleamos el método de máxima verosimilitud de información limitada (LIML) para producir estimaciones que fueran menos sensibles a los instrumentos débiles. En particular, para el modelo IV de tasa de respuesta, se excluyó el ensayo pequeño para mejorar la relevancia de los instrumentos. Los resultados revelaron que las empresas buscaron participar en las negociaciones para las indicaciones con mejores beneficios sustitutos, pero no para aquellas que brindaban beneficios de supervivencia superiores.
Tabla 3. Asociaciones entre el estado de la solicitud de negociación y el beneficio clínico del medicamento.
| Variables | Tasa de respuesta | Tiempo hasta el evento (HR) | Sistema operativo (RR.HH.) | ||||||||
| Celda vacía | (1) MCO | (2) Primera etapa | (3) 2SLS | (4) LÍMITE | (5) MCO | (6) Primera etapa | (7) 2SLS | (8) LÍMITE | (9) MCO | (10) Primera etapa | (11) 2SLS |
| Solicitud de negociación | 0,06 (0,07) | 0,44 (0,19) ⁎⁎ | 0,44 (0,20) ⁎⁎ | -0,02 (0,05) | −0,31 (0,10) ⁎⁎⁎ | −0,37 (0,13) ⁎⁎⁎ | 0,03 (0,03) | -0,04 (0,12) | |||
| Instrumentos | |||||||||||
| Acuerdo de confidencialidad | 0,10(0,05) ⁎⁎ | 0,26 (0,09) ⁎⁎⁎ | −0,08(0,03) ⁎⁎ | 0,09 (0,10) | -0,01(0,03) | 0,10 (0,12) | |||||
| Patrocinador nacional | 0,04(0,04) | 0,13 (0,09) | -0,02(0,04) | 0,19 (0,10) ⁎⁎ | -0,02(0,03) | 0,18 (0,11) | |||||
| Pequeña prueba | 0,05(0,05) | \ | \ | \ | −0,10(0,04) ⁎⁎ | 0,23 (0,07) ⁎⁎⁎ | -0,01(0,03) | -0,14 (0,16) | |||
| Controles | |||||||||||
| Clase de aprobación | -0,07(0,04) | 0,06(0,09) | −0,11(0,05) ⁎⁎ | −0,11(0,05) ⁎⁎ | 0,04(0,04) | −0,17(0,09) * | 0,01(0,05) | 0,01(0,05) | −0,06(0,03) ⁎⁎ | 0,09(0,13) | −0,06(0,03) ⁎⁎ |
| Tipo de cáncer | −0,15(0,05) ⁎⁎⁎ | 0,02(0,09) | −0,18(0,06) ⁎⁎⁎ | −0,18(0,06) ⁎⁎⁎ | 0,01(0,05) | -0,15(0,16) | −0,04(0,06) | −0,04(0,07) | 0,01(0,06) | -0,17(0,19) | 0,01(0,06) |
| Año de aprobación | 0,03(0,02) | -0,06(0,04) | 0,06(0,03) ⁎⁎ | 0,06(0,03) ⁎⁎ | −0,004(0,02) | −0,13(0,04) ⁎⁎⁎ | −0,04(0,02) ⁎⁎ | −0,04(0,02) ⁎⁎ | 0,02(0,01) * | −0,08(0,03) ⁎⁎ | 0,01(0,01) |
| Tipo de control | \ | \ | \ | \ | 0,02(0,04) | 0,02(0,08) | 0,03(0,04) | 0,04(0,04) | 0,04(0,03) | 0,08(0,10) | 0,04(0,03) |
| norte | 80 | 80 | 80 | 80 | 71 | 71 | 71 | 71 | 71 | 71 | 71 |
| Primera etapa F-stat | 4,72 ⁎⁎ | 6,91 ⁎⁎⁎ | 1.08 | ||||||||
| Prueba de endogeneidad | 4,65 ⁎⁎ | 5.48 ⁎⁎ | 0,40 | ||||||||
| Kleibergen-Paap rk LM F-stat | 8.07 ⁎⁎ | 14.37 ⁎⁎⁎ | 4.12 | ||||||||
| Estadísticas de Sargan | 0,01 | 2.80 | 0,44 | ||||||||
| Valor p de la prueba de enlace | 0,139 | 0,937 | 0,541 | ||||||||
Notas: Los errores estándar robustos se encuentran entre paréntesis. MCO, mínimos cuadrados ordinarios. MCO2, mínimos cuadrados en dos etapas. MIL, máxima verosimilitud con información limitada. NDA, solicitud de nuevo fármaco. HR, razón de riesgo. SG, supervivencia general.
⁎p < 0,10.⁎⁎p < 0,05.⁎⁎⁎p < 0,001.
Además, la negociación de 2024 publicó la lista de candidatos en septiembre de 2024. Por lo tanto, recopilamos todas las nuevas indicaciones oncológicas aprobadas antes del 30 de junio de 2024 para ampliar el análisis del estado de las solicitudes. Los resultados se mantuvieron sólidos (Tabla A1).
Discusión
Este estudio comparó los beneficios clínicos entre las indicaciones oncológicas reembolsadas y las no reembolsadas en las negociaciones de precios en China, teniendo en cuenta las preocupaciones de endogeneidad. Aportamos la primera evidencia de que las negociaciones de precios atrajeron la participación proactiva de las compañías farmacéuticas, lo que trajo consigo nuevos medicamentos con mayores beneficios indirectos al BMI. Los hallazgos sugieren que el mecanismo actual de negociación de precios ha dado algún juego a su papel de mejorar la eficiencia asignativa del BMI, lo que puede mejorar la salud de la sociedad. Sin embargo, también se observan los problemas subyacentes. En el marco general de la fijación de precios basada en el valor, un medicamento con un alto valor puede cobrar un buen precio al comprador, que es el principal mecanismo de incentivo subyacente a la negociación de precios y puede explicar en parte la ventaja clínica de los medicamentos reembolsados sobre los no reembolsados. Sin embargo, no puede explicar que las ventajas clínicas se observaran solo para los puntos finales indirectos, mientras que la ganancia en la supervivencia general no difirió entre los reembolsados y los no reembolsados. Las razones pueden estar relacionadas con la elasticidad del precio, y los medicamentos que aún no han demostrado beneficios en la supervivencia pueden ser más elásticos. La supervivencia es de suma importancia para los pacientes, pero se ha descubierto que la relevancia de muchos sustitutos con la supervivencia es débil [ 32 , 33 ]. La incertidumbre en los efectos del tratamiento predichos en la supervivencia por un sustituto plantea dificultades en las determinaciones de valor basadas en los beneficios del sustituto: si la mejora en un sustituto no conduce necesariamente a una extensión de la supervivencia, ¿cómo evaluamos el valor para los pacientes de una respuesta tumoral mejorada o un tiempo más largo hasta la progresión de la enfermedad? El método de manejo actual de la incorporación de puntos finales sustitutos en HTA es realizar la validación de un sustituto, es decir, el proceso que prueba si se puede confiar en un sustituto para predecir los beneficios del resultado final y cuantificar los beneficios del resultado final esperados relacionados con la validación [ 34 ]. Sin embargo, la falta de métodos adecuados para la validación de sustitutos y para manejar la incertidumbre en la cuantificación de los beneficios del resultado final sigue siendo barreras importantes. Además, en la práctica internacional de informes de evaluación de tecnologías sanitarias, la validación de los sustitutos no se relacionó significativamente con las decisiones de cobertura [ 35]. En la actualidad, las evaluaciones de valor basadas en evidencia de resultados indirectos siguen siendo un desafío. Este desafío, sin embargo, afectará la sustituibilidad de un fármaco. En el caso de un fármaco con evidencia de resultados indirectos, sus beneficios reales en el resultado final del paciente son indefinidos, lo que significa que su «valor» para una agencia de evaluación de tecnologías sanitarias o en entornos de pago no está claro. Si hay varios de estos fármacos que tratan la misma enfermedad, estos fármacos pueden ser sustitutos mutuos terapéuticamente hasta cierto punto, ya que se desconoce cuál demostrará la mayor ventaja clínica real en el resultado final. Por lo tanto, la elasticidad del precio de estos fármacos aumenta. En esta situación, una reducción de precio puede facilitar la expansión de la demanda y el aumento de los ingresos, y las compañías farmacéuticas estarán dispuestas a participar en la negociación de precios para intentar ocupar el mercado lo antes posible. No obstante, un fármaco que ha demostrado su ventaja significativa en el resultado final sería menos elástico, ya que apenas puede sustituirse, en particular para enfermedades poco frecuentes con grupos pequeños de pacientes. En este caso, la pérdida de ingresos por una reducción de precios difícilmente puede compensarse con un aumento del consumo, y por lo tanto la negociación de precios es menos atractiva. En consecuencia, los medicamentos con una mayor ganancia en SO tienden a no aplicar para la negociación de precios. Los hallazgos subrayan la importancia de evaluar las consecuencias a largo plazo de la participación discrecional de las empresas en las negociaciones de precios. En particular, la investigación futura debería centrarse en los insumos y productos de desarrollo a largo plazo de los desarrolladores de medicamentos involucrados y sus estrategias de marketing. Como las estrictas regulaciones de precios pueden socavar la innovación futura de medicamentos y obstaculizar el acceso a los medicamentos [ [36] , [37] , [38] , [39] ], es crucial determinar si las negociaciones de precios en China, que podrían verse como una forma de regulación estricta, conducirían a un debilitamiento de las capacidades de innovación de las empresas farmacéuticas y a una participación retrasada o cancelada en las negociaciones de precios.
En teoría, la política actual no ofrece incentivos suficientes para los medicamentos que mejoran sustancialmente los resultados finales relevantes para el paciente. Priorizar dichos medicamentos en la política de reembolso puede resultar una estrategia eficaz para atraer el interés de las empresas en la negociación de precios.
En primer lugar, se puede considerar un período de ajuste de precios más amplio para los medicamentos que muestran beneficios destacados en la supervivencia. En un marco temporal más amplio, se prevé que se crearán más innovaciones médicas futuras que muestren avances terapéuticos y sustituyan a las mejores terapias actuales. Por lo tanto, a largo plazo, un medicamento tiende a ser más elástico, lo que puede permitir la estrategia de bajo costo a granel.
En segundo lugar, se recomienda establecer una política diferenciada para las tasas de reembolso según la solidez de la evidencia de eficacia. Los medicamentos que demuestran una mejora en los resultados finales pueden tener derecho a una tasa de reembolso mayor, lo que aumenta la cantidad de demanda y facilita la conversión de elasticidad.
Para superar el desafío actual entre los beneficios de los criterios de valoración indirectos y la efectividad real en la salud de los pacientes, se recomienda a la NHSA que lleve a cabo una renegociación de precios para los medicamentos aprobados sobre la base de evidencia de criterios de valoración indirectos después de que los estudios posteriores a la aprobación revelen los verdaderos perfiles de efectividad de un medicamento. Además, en el caso de los medicamentos con demoras indebidas en la verificación de los beneficios de los resultados finales en los estudios posteriores a la aprobación, se puede considerar una reducción mayor de precio o una tasa de reembolso más baja en el proceso regular de ajuste de precios cada dos años, con el fin de incentivar a las compañías farmacéuticas a completar los estudios posteriores a la aprobación de manera oportuna.
Este estudio está sujeto a ciertas limitaciones. En primer lugar, los datos utilizados para evaluar los beneficios clínicos se derivaron de los informes de aprobación de medicamentos, debido a que los materiales de apoyo utilizados en las negociaciones de precios no se revelan al público. Nuestras evaluaciones pueden no poder reflejar completamente las implicaciones de las negociaciones de precios. Sin embargo, el tiempo observado hasta el reembolso no fue muy largo (12,83 meses para el 50 % de las indicaciones y 20,27 meses para el 75 % de las indicaciones) en comparación con la duración promedio de los ensayos (37,9 meses para los ensayos de fase Ⅱ y 45,1 meses para los ensayos de fase Ⅲ) [ 40 ], y podría ser inadecuado para los medicamentos recientemente aprobados generar nueva evidencia antes de la negociación. Por lo tanto, era plausible asumir que muchas indicaciones dependían de la misma evidencia de eficacia para permitir la autorización de comercialización y la elegibilidad para el reembolso, lo que podría aliviar las preocupaciones sobre los datos no coincidentes. En segundo lugar, no validamos la teoría de la elasticidad de los precios con respecto a las conductas de las compañías farmacéuticas, debido a la escasez de datos sobre la incidencia de enfermedades y el precio y el volumen de ventas de los medicamentos. Las investigaciones futuras deberían arrojar más luz sobre la relación entre el compromiso de negociación y la elasticidad de los precios de los medicamentos. En tercer lugar, este estudio solo abarcó medicamentos oncológicos, lo que no podía reflejar la situación de las áreas no oncológicas.
Conclusión
Observamos que la negociación de precios en China ha permitido incorporar nuevos medicamentos oncológicos con mayores beneficios indirectos al plan nacional de medicamentos. Sin embargo, esta política no ha sido tan eficaz para atraer medicamentos con mejores beneficios en términos de supervivencia. Se necesitan más esfuerzos regulatorios, como tasas de reembolso diferenciadas y períodos de ajuste de precios que dependan de la solidez de la evidencia, para priorizar los medicamentos con beneficios terapéuticos adicionales sustanciales que los pacientes valoran en el proceso de toma de decisiones sobre el reembolso, a fin de lograr un acceso asequible a medicamentos clínicamente importantes y promover la salud de la población.
Resumen de interés público
China implementa la negociación de precios para controlar el precio de los medicamentos de marca recientemente aprobados e incorporarlos a la lista de reembolsos del seguro nacional universal de salud. Dado que las negociaciones aceptan solicitudes voluntarias de las compañías farmacéuticas, es importante saber si los medicamentos de alto valor se sienten atraídos a participar. Descubrimos que las negociaciones han incluido medicamentos oncológicos con mejores beneficios indirectos en la lista de reembolsos, como medicamentos que ofrecen una tasa de respuesta tumoral más alta o reducen el riesgo de progresión de la enfermedad. Sin embargo, los medicamentos reembolsados no presentaron una ventaja de supervivencia general en comparación con los no reembolsados. Esta diferencia podría atribuirse a incentivos insuficientes en la política de reembolso para los medicamentos que demuestran beneficios de supervivencia. Dar prioridad regulatoria a dichos medicamentos sería útil para mejorar la asequibilidad de los medicamentos y promover la salud de la población.
