Factores que impulsan el valor de la innovación: simulación para la evaluación de precios de nuevos medicamentos basada en modelos de dinámica de sistemas
Qian Xing Wendi Cheng Wei Wang&#x;Wei Wang JinChunlin Jin Haiyin Wang*
ORIGINAL RESEARCH article
Front. Pharmacol., 21 January 2025
Sec. Drugs Outcomes Research and Policies
Volume 16 – 2025 | https://doi.org/10.3389/fphar.2025.1474856
Este es un artículo que recomiendo que lean porque expresa una simulación para fijar precios en la innovación de medicamentos, utilizando bucles de simulación desde una visión de la complejidad, como corresponde analizar esta problemática que se vincula con la sustentabilidad de los sistemas de salud: que no pueden financiar innovaciones de alto costo, porque no tienen solvencia y por ora parte esta evolución requiere estudios serios que propongan valores que se puedan abonar y aseguren el acceso solo a quienes lo necesitan en el momento apropiado de evolución de las enfermedades. Solo con una agencia de evaluación de tecnología es insuficiente. espero que los economistas que hacen fármaco economía realicen un aporte. Aquí les dejo mi trabajo en el blog de este hallazgo basado en la fijación de precios en Japón utilizando sistemas dinámicos de simulación con pruebas. También compara lo que se realiza en Alemania y Francia. La verdad que es original e interesante para quienes nos ocupa este tema que son las innovaciones farmacológicas como drivers del aumento del costo en salud por encima del crecimiento de un país o sea su capacidad de pago, generando un costo de oportunidad. El desarrollo de medicamentos innovadores para enfermedades graves, como el cáncer y las enfermedades raras, está avanzando a nivel mundial, lo que mejora el conjunto potencial de tratamientos para los pacientes.
Objetivos: Pagar por el valor innovador de los medicamentos es un medio importante para mitigar la duplicación de esfuerzos en el sistema sanitario y mejorar la salud de los pacientes. Evaluar y aprovechar los factores que influyen en la prima de innovación para predecir tendencias y deficiencias en el ecosistema de innovación farmacéutica.
Métodos: Mediante dinámica de sistemas, esta investigación construye un sistema de evaluación de decisiones para la fijación de precios de nuevos medicamentos en Japón. Integra diversos factores de decisión en dimensiones como la prima de valor, la prima de comercialización, la prima pediátrica y la prima SAKIGAKE, empleando el software Vensim PLE para fines de simulación.
Resultados: En el marco de políticas actual, la innovación farmacéutica está en auge, con importantes efectos en las políticas observables después de 5 años. El mayor crecimiento en valor se produce en medicamentos para enfermedades raras y nichos de mercado, con efectos que varían a corto y mediano plazo y se estabilizan a largo plazo. El análisis de sensibilidad destaca que factores como las terapias combinadas, los mecanismos de acción más rápidos y los componentes terapéuticos novedosos influyen notablemente en la dimensión del valor. Otros factores significativos incluyen la obtención de certificaciones nacionales, la atención a indicaciones que carecen de tratamientos estándar y la demostración de una eficacia superior. El estudio también identifica oportunidades infraexplotadas relacionadas con el uso de la evidencia en las decisiones de precios.
Conclusión: Los resultados clínicos son fundamentales para determinar los precios de los medicamentos, influyendo tanto en las preferencias de los pacientes como de los profesionales sanitarios y, por consiguiente, afectando la aceptación del mercado y la dinámica competitiva. Es fundamental contar con marcos regulatorios que prioricen las necesidades médicas no satisfechas o la mayor eficacia de los medicamentos. Las futuras mejoras del modelo deberían incorporar más evidencia práctica y ampliar las consideraciones regulatorias para reflejar mejor la naturaleza dinámica del sector sanitario y promover una fijación de precios de medicamentos equitativa y basada en resultados.
En las últimas décadas, la carga mundial de enfermedades ha aumentado junto con los costos de la atención médica, impulsada por los cambios demográficos, las crecientes expectativas de los pacientes y la introducción de nuevos medicamentos costosos y tecnologías de atención médica destinadas a abordar necesidades médicas no satisfechas ( Dimasi et al., 2016 ). Sin embargo, el desarrollo de nuevos medicamentos es un factor clave en el avance de la salud pública ( Vokinger et al., 2022 ). En 2023, los gastos farmacéuticos mundiales fueron de aproximadamente $ 1.5 billones, y el gasto mundial en medicamentos utilizando precios de lista creció un 35% entre 2018 y 2023, y se prevé que aumente un 38% hasta 2028 ( Iqvia, 2024 ). Dados estos pronósticos, la sostenibilidad financiera de los sistemas de salud es una preocupación cada vez mayor, ya que la mayoría de los países financian principalmente estos sistemas a través de fuentes públicas. Para afrontar estos desafíos, los gobiernos de todo el mundo han implementado políticas destinadas a mejorar la accesibilidad y asequibilidad de los medicamentos, centrándose en modelos de pago basados en el valor para las innovaciones ( Jommi et al., 2020a ; Chalkidou et al., 2020 ; Jommi et al., 2020b ).
El precio de los medicamentos innovadores es un asunto extremadamente complejo, que requiere tanto asegurar que las empresas reciban un retorno razonable de sus inversiones en I+D como garantizar un acceso justo a los medicamentos ( Incze et al., 2022 ). Este proceso no solo debe seguir los principios impulsados por el mercado, sino también estar guiado por políticas apropiadas para regular el comportamiento del mercado ( Smith, 2022 ).
Los gobiernos, las agencias de evaluación de tecnologías sanitarias (ETS) y los tomadores de decisiones en el ámbito sanitario utilizan incentivos de precios a lo largo de todo el ciclo de vida de un medicamento para fomentar el desarrollo de medicamentos verdaderamente nuevos ( Daalen et al., 2021 ; Hwang et al., 2022 ). Los criterios utilizados para la fijación de precios y el reembolso incluyen aspectos humanísticos, clínicos y económicos ( Kaltenboeck y Bach, 2018 ; Levaggi, 2014 ). Para reconocer innovaciones significativas en productos farmacéuticos, los organismos de toma de decisiones deben definir explícita o implícitamente qué características constituyen una innovación «recompensable» ( Levaggi y Levaggi, 2024a ). Idealmente, si los países pudieran consensuar esta definición, se generarían incentivos consistentes para que los fabricantes investigaran nuevos métodos de tratamiento de enfermedades y se simplificara el desarrollo de fármacos, reduciendo así costos y precios ( Annemans, 2023 ). Las decisiones de fijación de precios razonables basadas en el valor tienen un efecto indirecto en el futuro ecosistema de innovación ( Levaggi y Levaggi, 2024b ).
Muchos académicos han realizado revisiones sistemáticas sobre las definiciones de innovación en medicamentos, dimensiones de innovación y medidas de incentivos en diferentes países ( de Solà-Morales et al., 2018 ; Wakutsu et al., 2023 ). Estas revisiones incluyen certificaciones para enfermedades raras, poblaciones pediátricas y otros valores exclusivos, así como validaciones de la efectividad de traducir nuevos mecanismos de acción en beneficios clínicos reales. Los países también han incorporado elementos de innovación en las decisiones de precios de nuevos medicamentos ( Prieto-Pinto et al., 2020 ; Gonçalves, 2022 ). Alemania clasifica los beneficios clínicos de los nuevos medicamentos en cinco niveles, y las patentes con altos beneficios adicionales tienen un precio más alto que los medicamentos de referencia ( Theidel y von der Schulenburg, 2016 ). Francia utiliza la clasificación SMR (Service Médical Rendu) para determinar diferentes tasas de reembolso según el nivel de beneficio clínico, y posteriormente utiliza la clasificación ASMR (Amélioration du Service Médical Rendu) para decidir los métodos de negociación de precios según el grado de mejora de los beneficios clínicos ( Kergall et al., 2021 ). Sin embargo, no se ha establecido un marco uniforme para la fijación de precios basada en la innovación ( Zozaya et al., 2024 ).
Japón es reconocido como un mercado que recompensa la innovación con potenciales de precios predecibles. Los precios de los medicamentos se ven influenciados por la competencia del mercado, los puntos de referencia internacionales y las regulaciones gubernamentales ( Mamiya e Igarashi, 2021 ). El actual sistema de precios de medicamentos del Seguro Nacional de Salud (NHI) de Japón es una ruta rápida para acceder al mercado y, en consecuencia, los pacientes acceden a él alrededor de 3 meses después de la aprobación, lo que resulta en una de las vías de acceso al mercado más rápidas del mundo ( Takayama y Narukawa, 2017 ). Desde 2014, el nuevo sistema de precios de medicamentos de Japón implica seleccionar un medicamento existente comparable y calcular el precio de reembolso de un nuevo medicamento según las reglas gubernamentales establecidas, con primas otorgadas por cumplir criterios específicos ( Mamiya e Igarashi, 2021 ). Aunque estos procesos de fijación de precios no reflejan de manera integral los valores más amplios que los medicamentos pueden proporcionar a los pacientes y a la sociedad, hasta cierto punto, cubren varios elementos de la determinación del valor de nuevos medicamentos ( Takami et al., 2023 ).
Reconocer el valor de los nuevos fármacos es fundamental para el desarrollo del ecosistema de innovación farmacéutica ( Lamattina, 2022 ). La dinámica de sistemas (DS) es una metodología de simulación consolidada que se utiliza para explorar el comportamiento de los sistemas sociales a lo largo del tiempo ( Lyons y Duggan, 2015 ). Este artículo utiliza el modelado de DS para analizar el proceso de toma de decisiones sobre la fijación de precios de nuevos fármacos, utilizando los criterios de calificación de Japón como caso práctico. El objetivo es examinar cuantitativamente cómo los cambios en los mecanismos de acción, las certificaciones nacionales y otros factores clave influyen en el reconocimiento del valor de la innovación e informan las decisiones políticas en el ecosistema de innovación farmacéutica.
2.1 Análisis de aplicabilidad del modelo SD
Los sistemas de evaluación de políticas sanitarias son inherentemente complejos, compuestos por múltiples niveles de subsistemas y procesos interdependientes que se adaptan a los cambios del entorno y se comportan de forma no lineal. Los métodos tradicionales de evaluación y modelado de tecnologías sanitarias suelen ignorar los impactos más amplios en el sistema de salud, que pueden ser cruciales para alcanzar los objetivos deseados, y suelen ser de utilidad limitada cuando se aplican a sistemas de salud complejos ( Marshall et al., 2015 ).
El SD es una ciencia que combina la gestión de sistemas con la simulación por computadora y cuenta con una estructura de retroalimentación y reflexión dinámica ( Randers, 1997 ). Permite simplificar las condiciones operativas reales del objeto de investigación y proporcionar información operativa concisa a los responsables de la toma de decisiones. Generalmente, la aplicación del SD requiere que el sistema posea ciertas características y condiciones, como límites claros, leyes dinámicas y previsibilidad. Numerosos estudios han explorado supuestos, hipótesis y políticas a nivel conceptual/teórico y pueden caracterizarse como herramientas de modelado principalmente exploratorias ( Uriona y Grobbelaar, 2019 ).
Los elementos centrales de la DS son la retroalimentación, las acumulaciones (existencias), las tasas (flujos) y los retrasos temporales. Las existencias son acumulaciones o agregaciones de algo (p. ej., personas, camas y oxígeno). Los flujos son tasas; estas alimentan y descargan las existencias y tienen las mismas unidades de existencias por unidad de tiempo (p. ej., personas por hora, camas por año y oxígeno por minuto). Un concepto importante en la DS es la no linealidad. Este concepto está vinculado a la existencia de procesos de retroalimentación. Significa que un efecto rara vez es proporcional a la causa ( Martínez Moyano y Richardson, 2013 ).
El principio de Dinámica de Sistemas (SD) enfatiza la corrección de la estructura del modelo en lugar de la precisión de los parámetros de entrada. La polaridad de los bucles de retroalimentación SD es insensible a discrepancias menores en las entradas, y la estructura del modelo es relativamente estable. Mientras los datos se encuentren dentro de un cierto rango, el sistema exhibirá los mismos patrones de comportamiento, mostrando un alto grado de tolerancia ( Bala et al., 2017 ). Al establecer un modelo de sistema, el enfoque principal es asegurar que la estructura del sistema descrita se alinee con la situación real, sin concentrarse excesivamente en la selección y precisión de los parámetros. Las entradas de parámetros en este estudio no son valores fijos, lo que hace que el modelo sea adecuado para explorar las tendencias de desarrollo de las variables dependientes bajo diferentes escenarios ( Ghaffarzadegan et al., 2011 ).
2.2 Factores que influyen en las primas de precios de los nuevos medicamentos
Japón implementa un sistema universal de seguro médico, y en términos de gestión de precios de medicamentos, adopta un método que combina los precios gubernamentales con el sistema de seguro médico, con precios fijados uniformemente por el Ministerio de Salud, Trabajo y Bienestar. Este sistema incluye gestión categorizada, control de precios y un mecanismo de reevaluación posterior a la comercialización. Se aplican diferentes métodos de fijación de precios a medicamentos innovadores y medicamentos genéricos. Los medicamentos innovadores aquí son medicamentos con Nueva Entidad Molecular (NME) ( Takayama y Narukawa, 2017 ). Para los medicamentos innovadores, los precios se determinan principalmente ya sea por comparación con medicamentos similares o con base en la contabilidad de costos. Cuando hay un medicamento comparable con la misma indicación en la lista, el precio diario de un nuevo medicamento se determina para que sea igual al costo diario del medicamento comparable. Las primas a continuación se aplican cuando se demuestra que el nuevo medicamento es altamente útil.
La Figura 1 muestra todas las primas: una prima mínima del 5% y una prima máxima del 120% (margen de beneficio innovador), además de la posible prima de comercialización (5%-20%), la posible prima de revisión SAKIGAKE (10%-20%) y la posible prima pediátrica (5%-20%). El Sistema de Designación SAKIGAKE se utiliza para promover la I+D en Japón con el objetivo de lograr la aplicación práctica temprana de productos farmacéuticos, dispositivos médicos y fármacos regenerativos innovadores.
En la dimensión principal de la Prima de VALOR, las decisiones fundamentales sobre precios se basan en cuatro aspectos: (1) Nuevo mecanismo de acción clínicamente útil. (2) Alta eficacia y seguridad en comparación con fármacos comparables. (3) Mejora del método de tratamiento de la enfermedad. (4) Alta utilidad médica lograda mediante un procedimiento preparatorio. La seguridad social japonesa tiene sus propios criterios de reconocimiento; la Tabla 1 refleja los límites y las variables de los cuatro aspectos.
Tabla 1

Tabla 1. Principales Problemas y sus variables.
El objetivo principal del análisis de la relación causal es delinear los niveles y estructuras del sistema e identificar los principales mecanismos de retroalimentación entre el sistema general y sus componentes. Las reglas aditivas para las decisiones de fijación de precios de nuevos fármacos se dividen en cinco subsistemas y se organizan los factores que influyen en cada uno. La puntuación de cada variable contribuye a una decisión de fijación de precios más alta. El diagrama de relación causal construido se muestra en la Figura 2. La evaluación de la decisión de fijación de precios de nuevos fármacos agrega los impactos de la prima de valor, las primas de comercialización I y II, la prima pediátrica y la prima SAKIGAKE. Los factores que rodean a los cinco subsistemas son cada elemento de puntuación. Un factor tiene un impacto en los demás. Las variables son generalmente factores independientes en la toma de decisiones, pero existen interacciones y relaciones entre ellas. Por ejemplo, una certificación temprana de un «Nuevo mecanismo» afecta directamente a la «Nueva parte de acción» y al «Nuevo objetivo» durante el proceso de fijación de precios, creando así un ciclo de retroalimentación positivo. Esta interacción ejemplifica cómo las variables no solo actúan de forma independiente, sino que también se influyen mutuamente, afectando dinámicamente el mecanismo de fijación de precios y, en última instancia, la valoración de las cualidades innovadoras del fármaco. El diagrama general de la relación refleja una relación positiva, ya que primas más altas indican mayor valor, innovación y comercialización, lo que justifica un precio más alto.
Figura 2
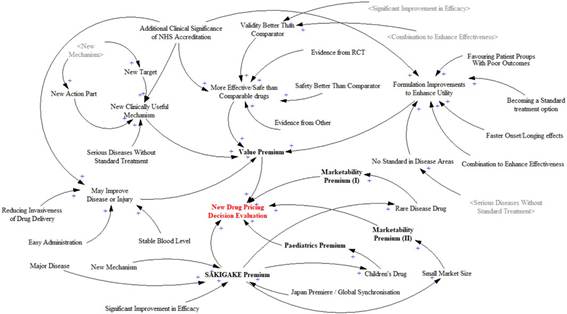
Figura 2. Diagrama de causalidad del nuevo sistema de evaluación de decisiones de precios de medicamentos.
2.3 Construir un flujo SD y asignar puntuaciones
Con base en el diagrama de causalidad y la retroalimentación entre varios factores, este documento introduce 1 variable de stock, 33 variables auxiliares y 17 variables constantes para construir el diagrama de flujo dinámico de la evaluación de la decisión de fijación de precios de nuevos medicamentos, como se muestra en la Figura 3 .
Figura 3

Figura 3. Diagrama de flujo dinámico del nuevo sistema de evaluación de decisiones de precios de medicamentos.
Para el diseño de ecuaciones de DE y la asignación de variables, se adoptan reglas de puntuación, estimación integral y ajuste experimental. Dado que no hay una unidad fija para la puntuación, este documento lo hace adimensional ( Shi et al., 2022 ). El tamaño del paso de simulación para el modelo se establece en 1 año, con una duración total de simulación de 50 años. Considerando las características específicas de las nuevas decisiones de precios de medicamentos, se aplican configuraciones razonables para funciones no lineales a las variables relevantes dentro del sistema. Algunas variables presentan ciertos desfases temporales, que se configuran adecuadamente utilizando funciones de retardo de información. El diseño de ecuaciones en este estudio se basa en una revisión de la literatura sobre la implementación de políticas de salud ( Lyons y Duggan, 2015 ). Las ecuaciones del modelo se muestran en la Tabla 2 .
Tabla 2
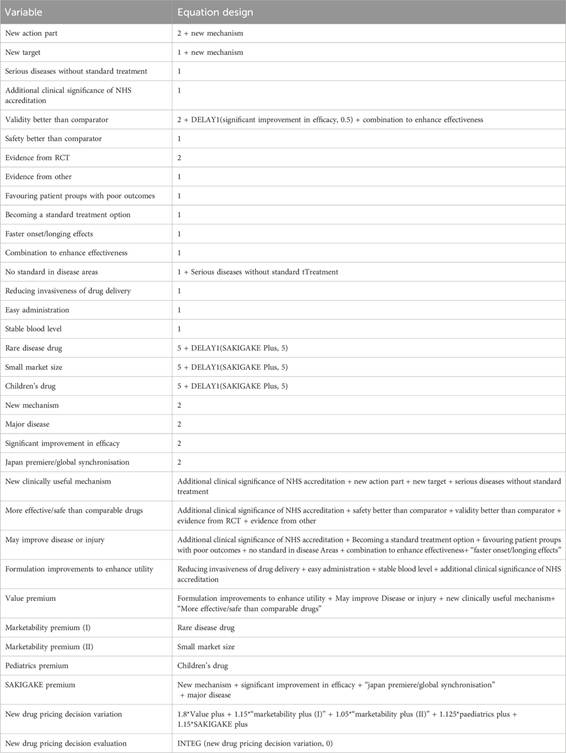
Tabla 2. Diseño de la ecuación SD.
3.1 Prueba de validez del modelo
La validez del modelo significa que este puede representar con precisión el sistema real, y todos los modelos de simulación deben someterse a pruebas de validez. Existen muchas maneras de probar el modelo de desviación estándar (SD), pero debido a la complejidad del problema de investigación, no es posible vincularlo con los datos reales. Por lo tanto, la verificación del modelo se centra en si es consistente con la tendencia real; en otras palabras, si puede producir resultados razonables.
3.1.1 Inspección de los límites del sistema
Una de las claves para la viabilidad del modelo de SD reside en que este tenga una delimitación sistémica clara. Las variables y el lapso de tiempo del modelo afectarán dicha delimitación. Por lo tanto, es necesario comprobar la delimitación sistémica de las variables conceptuales importantes del modelo. El objetivo de este trabajo es un sistema para evaluar las decisiones sobre precios de nuevos medicamentos. Las variables utilizadas en el modelo provienen de influencias públicamente disponibles, discutidas y validadas repetidamente. Todas las variables son fundamentales. Por lo tanto, el modelo de SD establecido en este trabajo es eficaz.
3.1.2 Comprobación de estabilidad
Tomando el sistema de decisión de precios bajo las condiciones técnicas existentes, la asequibilidad de los recursos y el entorno de políticas, la prueba de estabilidad del modelo puede ser realizada por la prueba de error integral. Al establecer diferentes intervalos de tiempo de simulación, se prueba si los resultados de la operación del modelo son sensibles a la elección del tamaño del paso de diferencia. Adoptando la forma de reducir a la mitad el intervalo de tiempo de simulación uno por uno, es decir, estableciendo DTa = 1 (actual), DTb = 0.5, DTc = 0.125 tres pasos de simulación para simular el modelo respectivamente, los resultados se muestran en la Figura 4. Se puede ver que el sistema de decisión de precios casi no ha cambiado, lo que indica que el error de integración del modelo en este documento es pequeño e insignificante. Después de cambiar el paso de simulación de la simulación del modelo, la curva de simulación no tiene cambios, lo que representa que la estabilidad del modelo es buena.
Figura 4

Figura 4. Resultado de la prueba de estabilidad del modelo.
3.2 Evaluación de decisiones bajo el escenario base
En el escenario base que se muestra en la Figura 5A , sin cambios en las condiciones externas, todas las primas demuestran un crecimiento lineal en valor a lo largo de 50 años, lo que indica un crecimiento consistente esperado bajo el sistema de pago por valor.
Figura 5
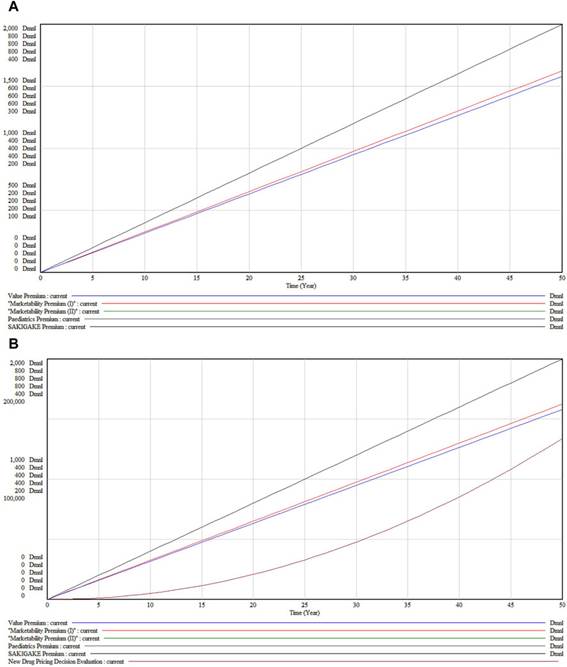
Figura 5. ( A) Evaluación de la decisión de fijación de precios de nuevos medicamentos en el escenario base (B) Estado de acumulación en el escenario base.
Considerando los diferentes subsistemas, la Prima de Valor (Línea Negra) presenta el mayor crecimiento, lo que refleja una apreciación significativa a largo plazo de la efectividad y la utilidad del fármaco. Las Primas de Comercialización (I y II) (Líneas Rojas), si bien muestran un crecimiento sustancial, aumentan a un ritmo más lento que la Prima de Valor. La Prima Pediátrica (Línea Verde) presenta la curva de crecimiento menos pronunciada, lo que sugiere un aumento más moderado del valor para las aplicaciones pediátricas. La Prima SAKIGAKE (Línea Azul) muestra un crecimiento moderado, lo que indica su influencia media en los precios, probablemente debido a los beneficios de la aceleración regulatoria o las aprobaciones aceleradas.
La Figura 5B , que representa los valores acumulados, contrasta con la Figura 5A, que ilustra los resultados inmediatos y la dinámica de los componentes del sistema. El gráfico acumulado demuestra que todas las primas acumulan valor de forma constante, influenciadas por factores como la inflación, la demanda del mercado, los cambios regulatorios o los avances médicos. La proximidad de las trayectorias de las Primas de Comerciabilidad (I y II) implica rendimientos comparables a largo plazo, a pesar de las ligeras variaciones en las trayectorias a corto y mediano plazo. Cabe destacar que la Prima Pediátrica, inicialmente inferior a la Prima SAKIGAKE, tiende a converger y podría superarla en años posteriores, lo que refleja una dinámica de mercado potencialmente cambiante y un mayor énfasis en los incentivos para la salud pediátrica y el desarrollo de fármacos.
3.3 Análisis de sensibilidad de un solo factor
Utilizando el modelo establecido, se evaluó la sensibilidad de diversos parámetros ajustando los valores de variables específicas en un 80% para observar las respuestas del sistema. Este análisis de sensibilidad unifactorial tuvo como objetivo identificar las variables clave que influyen en el sistema, modificando cada simulación solo un parámetro a la vez. Los resultados indican que aumentar el valor de cada parámetro constante generalmente produce una tendencia ascendente en la salida del sistema, lo que demuestra cierto grado de sensibilidad a estos cambios. Sin embargo, a lo largo de un período de 50 años, la mayoría de las líneas de salida se mantuvieron estrechamente alineadas, lo que sugiere que el modelo de decisión es relativamente estable o insensible a cambios en una amplia gama de factores. Esta estabilidad es crucial para garantizar la robustez del modelo frente a las variaciones de entrada.
Cabe destacar que, después de unos 30 años, aparecen ligeras divergencias entre algunas de las líneas de producción, lo que indica que ciertos factores pueden ejercer un impacto más significativo en el largo plazo, o que aspectos de la dinámica del mercado de los medicamentos o sus impactos en la salud evolucionan con el tiempo.
La sensibilidad del modelo a las constantes se examinó en tres segmentos, donde el subsistema de prima de valor implicó ajustes a 16 constantes. La Figura 6A muestra el impacto general de estas variables e incluye un gráfico de acercamiento detallado. En la Figura 6B , variables como «Combinación para mejorar la eficacia» (marcada con el 2), «Inicio más rápido» (marcada con el 5) y «Nuevo componente de acción» (marcada con el 8) muestran sensibilidades superpuestas y una trayectoria ascendente más pronunciada, lo que sugiere que los fármacos con efectos combinados mejorados, acción más rápida o nuevos mecanismos se distinguen notablemente en el mercado. Clínicamente, estos tratamientos son preferidos por su alivio rápido y sus enfoques innovadores.
Figura 6

Figura 6. ( A) Análisis de sensibilidad de los insumos de la prima de valor (B) Análisis de sensibilidad de los insumos parciales (C) Análisis de sensibilidad de los insumos residuales.
La Figura 6C revela que la «Acreditación del NHS» (Marcado con 2) presenta la mayor sensibilidad, seguida de «Enfermedades graves sin tratamiento estándar» (Marcado con 6) y «Validez superior a la del comparador» (Marcado con 8). Estos factores son cruciales para acceder al mercado y obtener condiciones de reembolso favorables. Los medicamentos que abordan necesidades médicas no cubiertas o demuestran una eficacia superior no solo ofrecen importantes beneficios clínicos, sino que también logran ventajas económicas gracias a la exclusividad en el mercado y la reducción de la competencia.
En el análisis de las dimensiones premium como se ilustra en las Figuras 7A, B , los medicamentos dirigidos a enfermedades raras (marcados con 3) exhiben un impacto ligeramente mayor en la comercialización en comparación con los medicamentos para niños (marcados con 1). Esta diferencia podría deberse a los desafíos únicos en las enfermedades raras, como la ausencia de tratamientos alternativos y la mejora sustancial en la calidad de vida del paciente que estos medicamentos proporcionan. Además, el nivel de impacto cercano de los medicamentos para niños refleja el énfasis social y ético en la atención médica pediátrica. Ambas categorías muestran tendencias paralelas con fluctuaciones menores, pero mantienen la proximidad en sus valores de impacto. Después de estos, están los medicamentos con un «tamaño de mercado pequeño» (marcados con 2), que pueden abordar afecciones de menor gravedad o urgencia, o atraer menos atención pública y médica en comparación con las enfermedades raras o los medicamentos para niños.
Figura 7
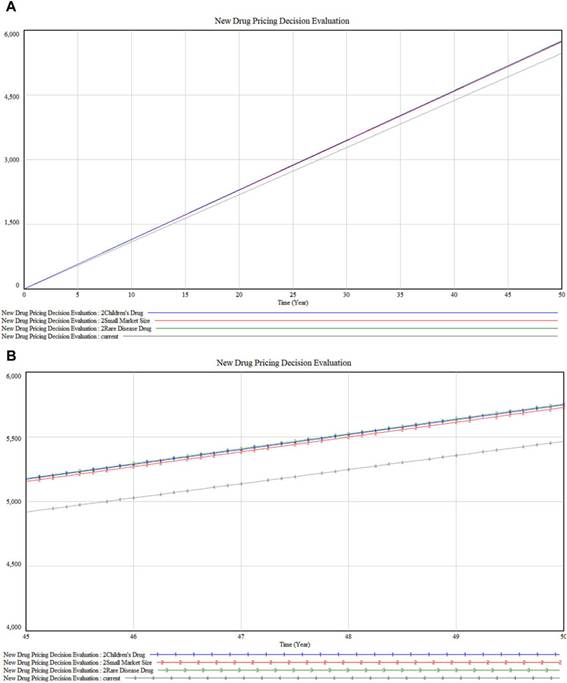
Figura 7. ( A) Análisis de sensibilidad de la prima de dimensión especial (B) Versión detallada del análisis de sensibilidad de la prima de dimensión especial.
Un análisis más profundo de la certificación SAKIGAKE Premium revela la dinámica entre cuatro constantes en las Figuras 8A y B. «Nuevo mecanismo» (marcado con un 4) lidera en impacto, lo que indica su papel como pionero en nuevas vías de tratamiento. Le sigue de cerca «Mejora significativa de la eficacia» (marcado con un 2). Las constantes «Estreno en Japón» (marcado con un 1) y «Enfermedad grave» (marcado con un 3) muestran impactos casi idénticos, lo que subraya el valor que se otorga a los fármacos pioneros en el mercado y a los fármacos dirigidos a enfermedades graves en Japón. Estos hallazgos resaltan el reconocimiento de la certificación premium a las innovaciones que mejoran significativamente los resultados de los pacientes, lo que se correlaciona con una mayor valoración en el mercado.
Figura 8
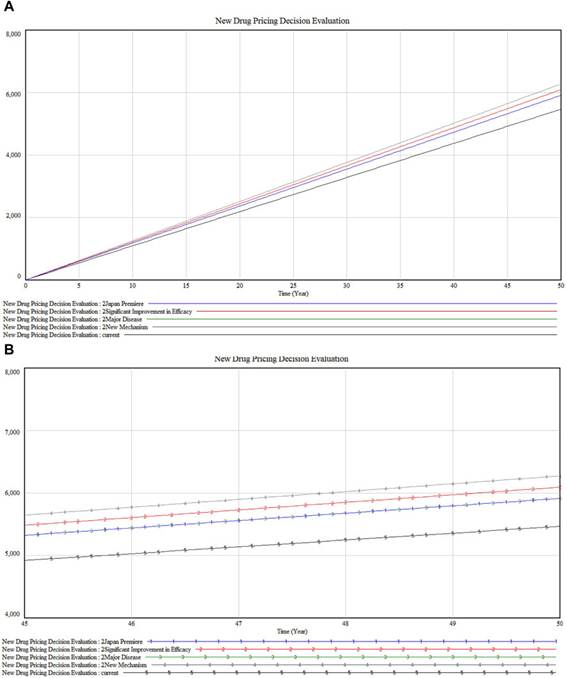
Figura 8. ( A) Análisis de sensibilidad de SAKIGAKE Premium (B) Versión detallada del análisis de sensibilidad de SAKIGAKE Premium.
Este artículo construye el modelo SD para evaluar las decisiones sobre precios de nuevos medicamentos, integrando cinco subsistemas: prima de valor, primas de comercialización I y II, prima pediátrica y prima SAKIGAKE. Las pruebas de validez del modelo confirman su capacidad para reflejar con precisión el impacto de factores clave, proporcionando una base sólida para los resultados de simulación. En un escenario base, todas las primas aumentan linealmente a lo largo de 50 años, lo que sugiere un aumento continuo del valor de los medicamentos dentro de un sistema de pago por valor. Esto refleja la suposición del modelo de que las innovaciones farmacológicas conservarán su valor, lo que fomenta la inversión sostenida en innovación farmacéutica.
Las distintas trayectorias de crecimiento de las primas, en particular el pronunciado aumento de la Prima de Valor, resaltan el papel crucial de la eficacia y la utilidad de los medicamentos en la fijación de precios. Esto se alinea con la transición hacia modelos de precios basados en el valor en la atención médica, que priorizan los resultados clínicos. El análisis de sensibilidad revela que las innovaciones que mejoran la sinergia de los medicamentos, la rapidez de acción y la introducción de mecanismos novedosos son muy valoradas, lo que impulsa a las compañías farmacéuticas a centrar su I+D en estas áreas.
Además, la alta sensibilidad asociada con la «Acreditación del NHS», «Enfermedades Sensibles Sin Tratamiento Estándar» y «Validez Mejor que el Comparador» refuerza la importancia del respaldo regulatorio y de abordar las necesidades médicas no cubiertas. Esto respalda la idea de que los medicamentos que cumplen estos criterios pueden alcanzar precios premium y sugiere que las estrategias regulatorias y el desarrollo de medicamentos dirigidos a estas áreas pueden ser particularmente efectivos. El análisis de la comercialización y las primas especiales, como las de las enfermedades raras y las aplicaciones pediátricas, proporciona información matizada sobre la dinámica del mercado. El mayor impacto de los «medicamentos para enfermedades raras» sobre los «medicamentos pediátricos» podría reflejar la necesidad urgente y la falta de alternativas en las enfermedades raras, lo que a menudo permite precios premium bajo el estatus de medicamento huérfano ( Zelei et al., 2021 ).
Desde una perspectiva regulatoria y de economía de la salud, estos factores sensibles a menudo resuenan bien con las agencias regulatorias y las evaluaciones de economía de la salud. Los medicamentos que muestran una efectividad superior, un inicio rápido o acciones novedosas podrían recibir colocaciones favorables en formularios y decisiones de cobertura, lo que puede influir positivamente en los precios. Desde una perspectiva clínica, los tratamientos que ofrecen un alivio rápido, mejoran los efectos de las terapias existentes o brindan nuevas vías de tratamiento probablemente sean los preferidos tanto por los pacientes como por los proveedores. Esta preferencia puede traducirse en una mayor disposición a pagar, que puede aprovecharse en las estrategias de precios ( Olsder et al., 2023 ). Estos factores de las decisiones de precios guían la I+D de la industria farmacéutica. Las compañías farmacéuticas podrían estar fijando el precio de estos medicamentos no solo con base en la demanda del mercado, sino también considerando la necesidad y el potencial de un beneficio significativo para el paciente. Esto podría ser parte de una estrategia más amplia para alinearse con los incentivos regulatorios y las expectativas sociales, particularmente en áreas como las enfermedades raras donde la defensa del paciente y el interés público son fuertes.
En este modelo de evaluación de decisiones de precios, también podemos encontrar que las fuentes de evidencia que han recibido más atención en los últimos años no han sido lo suficientemente influyentes, una debido a sus propias puntuaciones pequeñas y la otra debido a su baja correlación con otros factores. Los pagos de Medicare para medicamentos posteriores a la comercialización se pueden habilitar mediante la generación de evidencia del mundo real (RWE) utilizando datos robustos del mundo real (RWD) para permitir los pagos de medicamentos basados en el valor real recibido por el paciente en lugar del valor esperado por el sistema de atención médica ( Bn et al., 2015 ; Eichler et al., 2022 ). Si se debe fortalecer su enfoque en el momento de la fijación de precios, se podría explorar para delinear el nivel de evidencia para los RCT, destacando los vínculos con la eficacia y si el RCT produce el resultado deseado, etc. ( Chan et al., 2020 ). De hecho, la nueva metodología HTA, publicada recientemente en el Reino Unido por NICE ( Dawoud et al., 2022 ), introduce un factor de ponderación para enfermedades graves de modo que el valor absoluto de la diferencia entre los AVAC de los dos grupos o la diferencia porcentual entre los AVAC se puede utilizar para cuantificar la gravedad de la enfermedad al comparar ensayos clínicos y se aplica el principio de neutralidad del coste de oportunidad para redistribuir diferentes pesos a diferentes enfermedades. El principio de «neutralidad del coste de oportunidad» se utiliza para reasignar diferentes pesos a diferentes enfermedades ( Angelis et al., 2023 ). También se incluyen la incertidumbre sobre la probabilidad de tratamiento, la escasez, la equidad, la edad y la información que permite la evidencia clínica de tecnologías innovadoras, que podrían considerarse para su integración en el precio de los nuevos medicamentos para crear un vínculo.
Además, los análisis actuales de los factores de prima de precio para el lanzamiento de nuevos fármacos aún no han considerado la cuestión de los ajustes de precios debido a los cambios en el entorno competitivo tras el lanzamiento, y los estudios futuros de los mecanismos de precios que abarcan todo el ciclo de vida de los fármacos se enfrentarán a más ajustes ( Fu et al., 2018 ). En cuanto a la investigación institucional relacionada, las externalidades políticas, como los efectos indirectos de la política de precios y otras responsabilidades que la propia política de precios debe asumir, harán que el análisis sea más complejo.
En 2018, el Grupo de Trabajo Especial de la Sociedad Internacional de Farmacoeconomía y Resultados (ISPOR) analizó los elementos de valor en la atención médica e identificó una serie de ellos, la denominada flor de valor de ISPOR. Si bien esta flor promueve la inclusión de una gama más amplia de elementos de valor, su uso universal presenta desafíos, ya que varios de sus elementos, como el valor del seguro, la gravedad de la enfermedad, el valor de la esperanza y el valor de la opción real, no están claramente definidos. Si bien todos estos elementos se consideran importantes, aún no se ha establecido un método para cuantificarlos en términos monetarios ( Lakdawalla et al., 2018 ).
La dinámica de sistemas pertenece a la disciplina clásica e intercomprensiva, que, por un lado, permite analizar sistemáticamente las interacciones entre diversos factores de prima y presentar claramente el grado de correlación elemental, y, por otro, simular y evaluar la tendencia de los factores desde una perspectiva dinámica, lo que facilita la interpretación de los resultados. Actualmente, el modelo de dinámica de sistemas (SD) tiene una aplicación limitada en el ámbito de la salud ( Atkinson et al., 2015 ), por lo que se puede considerar ampliar su aplicación en la toma de decisiones políticas, como una herramienta eficaz para aclarar la relación entre diversos tipos de variables y determinar el grado de criticidad.
Este estudio proporciona información práctica para los responsables políticos y las agencias reguladoras al presentar una evaluación exhaustiva de los factores que influyen en la fijación de precios de los nuevos medicamentos. Aclara las tendencias y las deficiencias del marco actual de fijación de precios de medicamentos en Japón en comparación con el objetivo de una atención médica basada en el valor, proporcionando una referencia para Japón y otros países. Sin embargo, este estudio, al ser exploratorio, presenta limitaciones. Si bien el modelo demuestra estabilidad y sensibilidad a variables críticas, la falta de valores de puntuación reconocidos internacionalmente limita la precisión de las simulaciones. Investigaciones futuras podrían aspirar a integrar datos de puntuación sintetizados a medida que estén disponibles, posiblemente ajustando el modelo para reflejar con mayor precisión las complejidades del mundo real. Además, explorar escenarios adicionales donde factores externos, como recesiones económicas o cambios en las políticas sanitarias, alteren significativamente la dinámica de los precios de los medicamentos, podría proporcionar una comprensión más profunda de la resiliencia y la adaptabilidad de las estrategias de fijación de precios en diferentes condiciones de mercado. Finalmente, el modelo SD presenta limitaciones inherentes, ya que no requiere un alto grado de precisión de los parámetros y la interpretación de los resultados es subjetiva y requiere un análisis más profundo en el contexto de situaciones reales.
5 Conclusión
Este estudio desarrolla un modelo de dinámica de sistemas (DS) para evaluar las decisiones sobre precios de nuevos medicamentos mediante la integración de factores clave de las primas, como el valor, la comercialización, la atención pediátrica y las primas SAKIGAKE. En Japón, la inclusión de un sistema de precios estructurado proporciona una vía relativamente eficiente, transparente y predecible para nuevos medicamentos. Sin embargo, existen áreas donde los cambios podrían mejorar el acceso, la eficiencia y el valor, como la ponderación de la especificidad de la enfermedad, el nivel de evidencia y otros factores de precios más amplios a largo plazo. Estas modificaciones ayudarán a los sistemas de salud a equilibrar los incentivos innovadores y la sostenibilidad del sistema para promover un uso más eficaz y equitativo de los recursos sanitarios.
Carlos buenos dias queria saber si podia por este medio hacerte un comentario , que al margen del tema de tu publicacion quizas pueda interesarte.- espero tu respuesta , gracias
Me gustaMe gusta
si decime ningún problema o mi mail carlosdiazssc@gmail.com
Me gustaMe gusta