
El síndrome de fragilidad (SF) es una afección compleja y multifacética que se observa comúnmente en adultos mayores con enfermedades crónicas, a menudo acompañada de deterioro cognitivo. Esta revisión explora la integración de intervenciones para la fragilidad en los modelos de atención existentes para mejorar los resultados de los pacientes, centrándose en cuatro áreas clave. En primer lugar, enfatiza la importancia de las herramientas de evaluación integral para identificar la fragilidad y el deterioro cognitivo de forma temprana, facilitando así la planificación de la atención específica. En segundo lugar, destaca el valor de las intervenciones personalizadas, como las modificaciones dietéticas, los programas de ejercicio y el entrenamiento cognitivo, adaptadas a las necesidades y preferencias individuales de cada paciente. En tercer lugar, la revisión subraya el papel fundamental de los equipos de atención multidisciplinarios para brindar una atención integral y coordinada, aprovechando la experiencia de diversos profesionales de la salud. Finalmente, examina el potencial de las innovaciones tecnológicas y los sistemas de apoyo a los cuidadores para mejorar el manejo de la fragilidad y abordar los desafíos que plantean los deterioros cognitivos. Al integrar estos enfoques, esta revisión presenta un marco centrado en el paciente destinado a mitigar el impacto de la fragilidad y mejorar los resultados a largo plazo. Los hallazgos enfatizan la necesidad de una estrategia unificada que combine atención personalizada, colaboración interdisciplinaria y avances tecnológicos para abordar los desafíos multifacéticos de la fragilidad en el manejo de enfermedades crónicas.
1 Introducción
A medida que los sistemas de atención médica enfrentan la creciente carga de enfermedades crónicas, particularmente en poblaciones que envejecen, la necesidad de enfoques innovadores para mejorar los resultados de los pacientes se vuelve cada vez más urgente ( 1 ).
El síndrome de fragilidad (SF) es una condición clínica caracterizada por una disminución de la fuerza, la resistencia y la función fisiológica, lo que resulta en una mayor vulnerabilidad a resultados adversos para la salud, particularmente en adultos mayores ( 2 ).
Es un concepto multidimensional que abarca los dominios físico, cognitivo, social, psicológico y nutricional, cada uno de los cuales contribuye a la complejidad de la fragilidad ( 3 ). La fragilidad física, comúnmente vinculada a la sarcopenia, se manifiesta como una reducción de la fuerza muscular y la movilidad ( 4 ). La fragilidad cognitiva combina el deterioro físico con deficiencias como déficits de memoria o disminución de la función ejecutiva ( 5 ). La fragilidad social proviene de redes y sistemas de apoyo limitados, lo que exacerba el aislamiento y sus riesgos de salud asociados ( 6 ). La fragilidad psicológica incluye afecciones como la depresión o la ansiedad, que agravan aún más los desafíos físicos y cognitivos, mientras que la fragilidad nutricional se caracteriza por la desnutrición o las deficiencias de vitaminas, lo que socava la resiliencia y la recuperación general ( 7 ).
La FS está estrechamente relacionada con enfermedades crónicas, como enfermedades cardiovasculares, diabetes, enfermedad pulmonar obstructiva crónica (EPOC) y osteoporosis ( 8 , 9 ). La evidencia indica que la fragilidad exacerba la progresión y los resultados de estas afecciones. Por ejemplo, los pacientes con insuficiencia cardíaca y fragilidad experimentan tasas más altas de hospitalización y mortalidad, mientras que las personas con diabetes y fragilidad a menudo enfrentan complicaciones relacionadas con un control glucémico deficiente y comorbilidades ( 7 , 10 , 11 ). Los estudios epidemiológicos muestran que la fragilidad afecta aproximadamente a un rango entre el 4,0 y el 59,1% de los adultos mayores que viven en la comunidad ( 12 ), con una prevalencia que aumenta a alrededor del 50% en aquellos con enfermedades crónicas ( 8 , 13 ). Además, la carga de la fragilidad es particularmente pronunciada en regiones con acceso limitado a la atención médica y tasas más altas de multimorbilidad ( 14 ). Debido al envejecimiento de la población mundial, se proyecta que la prevalencia de la fragilidad aumentará significativamente en las próximas décadas, lo que planteará desafíos sustanciales para los sistemas de atención de la salud en todo el mundo.
La fragilidad no sólo disminuye la calidad de vida de los pacientes, sino que también contribuye a un mayor uso y los costos de la atención médica debido a las hospitalizaciones frecuentes, los períodos de recuperación prolongados y las mayores tasas de morbilidad ( 15 ).
La integración de intervenciones para la fragilidad en los modelos de atención existentes ofrece una vía prometedora para abordar estos desafíos. Las intervenciones para la fragilidad, que incluyen evaluaciones específicas, rehabilitación física, apoyo nutricional y estrategias de atención coordinada, tienen el potencial de mejorar la resiliencia del paciente, reducir la progresión de las enfermedades crónicas y mejorar los resultados generales de salud. Al integrar estas intervenciones en el tejido de los sistemas actuales de prestación de atención médica, es posible crear un enfoque más holístico y centrado en el paciente que gestione de forma proactiva tanto las enfermedades crónicas como sus riesgos asociados ( 16 ). Este documento tiene como objetivo explorar la integración integral de las intervenciones para la fragilidad en los modelos de atención establecidos, examinando la evidencia que respalda su eficacia, los desafíos de la implementación y los beneficios potenciales para los pacientes con enfermedades crónicas. Al hacerlo, destaca la importancia de un enfoque multidisciplinario, donde los médicos, los cuidadores y los sistemas de atención médica trabajan en conjunto para brindar atención personalizada y preventiva que mejore la calidad de vida del paciente y reduzca la presión sobre los recursos de atención médica.
2 métodos
La base de datos de búsqueda fue PubMed. El periodo de recuperación abarcó desde enero de 2014 hasta diciembre de 2024. La estrategia de recuperación se optimizó mediante operadores lógicos booleanos. Los términos de búsqueda incluyeron una combinación de términos MeSH y palabras clave, como: «old adult frailty», «fragilty in aged adult», «frail old adult Populations», «fragilty and heart Failure», «fragilty and multimorbidity», «multimorbidity and heart Failure», «fragilty and cardiovascular Diseases», «fragilty and diabetes» y «fragilty and knowledgecayden». Esta exhaustiva estrategia de búsqueda garantizó que la revisión abarcara tanto estudios históricos como recientes, ofreciendo un espectro completo de evidencia sobre la fragilidad y sus pacientes con enfermedades crónicas.
Todas las citas recuperadas se importaron a Zotero para la gestión de referencias y la deduplicación. Los criterios de inclusión se definieron de la siguiente manera: (1) los artículos abarcaban una población adulta; (2) el tema principal del artículo era la fragilidad en el contexto de enfermedades crónicas (p. ej., multimorbilidad, insuficiencia cardíaca, diabetes o deterioro cognitivo); (3) el texto completo era accesible; y (4) el artículo se había publicado en inglés.
2.1 Desafíos en las intervenciones para pacientes con deterioro cognitivo
2.1.1 Comprensión y comunicación
Las intervenciones diseñadas para mitigar los efectos del FS incluyen opciones quirúrgicas (p. ej., dispositivos de asistencia ventricular, trasplante de corazón) y opciones no quirúrgicas (p. ej., intervenciones nutricionales y de ejercicio) ( 17 ). Sin embargo, las intervenciones no quirúrgicas pueden ser complejas. Como las personas con IC y FS a menudo tienen deterioro cognitivo coexistente, las intervenciones no quirúrgicas pueden ser desafiantes ( 18 , 19 ). Por ejemplo, las intervenciones de ejercicio incluyen una multitud de actividades diseñadas para mejorar el equilibrio, la fuerza y la movilidad ( 1 , 4 ). Los clientes con IC y FS pueden tener dificultad para recordar los ejercicios y la frecuencia con la que deben realizarse debido a déficits de memoria ( 18 , 20 ). Las restricciones dietéticas se centran en el aumento de la ingesta de macronutrientes como proteínas y micronutrientes como vitamina D y hierro ( 17 , 21 ). Los clientes con deterioro cognitivo pueden no recordar las recomendaciones nutricionales o no comprender la asociación entre las recomendaciones nutricionales y un mejor manejo de la IC y el FS ( 18 , 20 ). Además, dado que la comorbilidad es frecuente en la IC, es posible que las personas deban equilibrar varias recomendaciones nutricionales simultáneamente (p. ej., dieta baja en sal y dieta para diabéticos) ( 17 , 18 , 20 ). Las personas con deterioro cognitivo pueden tener dificultades para coordinar múltiples recomendaciones nutricionales. Los profesionales sanitarios deben estar atentos a los pacientes frágiles con IC que presentan deterioro cognitivo para garantizar el máximo beneficio de las intervenciones no quirúrgicas.
2.1.2 Desafíos de la autogestión y el seguimiento
Los deterioros cognitivos varían desde el deterioro cognitivo leve hasta la demencia grave, y pueden clasificarse en deterioro cognitivo subjetivo (DCS), deterioro cognitivo leve (DCL) y demencia ( 22 ). El DCS implica problemas de memoria percibidos sin déficits mensurables, mientras que el DCL presenta un deterioro cognitivo detectable pero permite cierto nivel de independencia. En la demencia, las capacidades de autocuidado suelen perderse por completo y los pacientes se vuelven dependientes del apoyo externo para las actividades diarias básicas. Los deterioros cognitivos están relacionados con diversos resultados negativos para la salud, incluyendo un manejo deficiente de la enfermedad, mayores tasas de hospitalización, un mayor riesgo de eventos adversos y una calidad de vida reducida ( 23 ).
El deterioro cognitivo a menudo acompaña a las enfermedades crónicas y actúa como una «discapacidad oculta» que complica el tratamiento y la atención al paciente ( 24 ). Ciertas enfermedades crónicas, como los trastornos cerebrovasculares, las neoplasias malignas y las enfermedades metabólicas como la diabetes, están relacionadas con un mayor riesgo de deterioro cognitivo ( 25 ). Las personas mayores tienen un mayor riesgo de sufrir deterioro cognitivo, que frecuentemente coexiste con enfermedades crónicas, lo que complica aún más el manejo de sus enfermedades ( 26 ). Por ejemplo, en pacientes con insuficiencia cardíaca, el deterioro cognitivo aumenta el riesgo de hospitalización y eventos adversos, mientras que en casos de dolor crónico, la adherencia a los regímenes de manejo del dolor se vuelve más desafiante ( 27 , 28 ).
El autocuidado juega un papel fundamental en el manejo de condiciones crónicas y el mantenimiento de la salud general. Se refiere a las acciones que las personas realizan para mantener la salud, monitorear enfermedades y manejar condiciones médicas en curso. El autocuidado efectivo conduce a mejores resultados, menos hospitalizaciones y una mejor calidad de vida ( 29 ). Sin embargo, los deterioros cognitivos reducen significativamente la capacidad de autocuidado, particularmente en la demencia, donde las lagunas mentales, el reconocimiento erróneo de síntomas y la dificultad para seguir regímenes de salud conducen a peores resultados ( 30 , 31 ). El autocuidado requiere funciones cognitivas intactas, como la capacidad de aprender, percibir e interpretar síntomas, habilidades que a menudo se ven comprometidas en pacientes con deterioro cognitivo. Sin estas habilidades, los pacientes tienen dificultades para reconocer los síntomas, seguir los planes de tratamiento o tomar decisiones de salud oportunas ( 32 ).
Los pacientes con deterioro cognitivo enfrentan distintos desafíos en el autocuidado según la gravedad de su condición. Por ejemplo, en personas con diabetes tipo 2, el deterioro cognitivo aumenta el riesgo de incumplimiento de las terapias prescritas, lo que lleva a un control deficiente de la enfermedad y complicaciones prevenibles ( 33 ). Aunque los pacientes luchan externamente con el manejo de sus enfermedades crónicas, el deterioro cognitivo subyacente a menudo pasa desapercibido ( 34 ). Este aspecto oculto complica el tratamiento, ya que los pacientes pueden no cumplir con los horarios de medicación, manejar las restricciones dietéticas o asistir a las citas de seguimiento, no por falta de esfuerzo, sino por limitaciones cognitivas no reconocidas ( 35 ). Incluso en la demencia en etapa temprana, los desafíos del autocuidado, como la adherencia a la medicación y el manejo de la higiene, siguen siendo significativos ( 36 ). Además, los deterioros cognitivos socavan aspectos críticos del autocuidado, incluida la capacidad de aprender nueva información e interpretar los síntomas, lo que complica el manejo de afecciones crónicas complejas ( 37 ).
Abordar los desafíos del autocuidado en pacientes con deterioro cognitivo es complejo debido a la superposición de factores. Las herramientas de evaluación tradicionales, como las neuroimagen y las pruebas cognitivas, miden el deterioro cognitivo, pero no captan eficazmente la capacidad de autocuidado. Las herramientas de autoinforme suelen ser poco fiables debido a los déficits de memoria. Las herramientas digitales, incluidos los programas de entrenamiento cognitivo en línea, ofrecen un valioso complemento a los métodos tradicionales, proporcionando evaluaciones en tiempo real más precisas de la función cognitiva y las habilidades de autocuidado ( 36 ).
Varias intervenciones han demostrado ser eficaces para mejorar el autocuidado en pacientes con deterioro cognitivo. Por ejemplo, se ha demostrado que los programas de entrenamiento cognitivo ayudan a los pacientes con deterioro cognitivo leve (DCL) a mantener sus capacidades de autocuidado. Los deterioros más graves, como la demencia, requieren atención con apoyo del cuidador para garantizar que las tareas diarias y las decisiones de salud se gestionen eficazmente ( 38 ). A pesar del progreso, todavía existe una brecha en la comprensión completa de las conductas de autocuidado en pacientes con deterioro cognitivo, lo que resalta la necesidad de más investigación. Las tecnologías, como las aplicaciones móviles y los wearables, ofrecen un apoyo potencial para los pacientes al ayudar con recordatorios de medicamentos y otras tareas de autogestión ( 38 ).
La autoeficacia, o la creencia en la propia capacidad para gestionar la salud, desempeña un papel fundamental como mediadora de las conductas de autocuidado. Los pacientes con mayor autoeficacia tienen más probabilidades de participar en prácticas eficaces de autocuidado ( 39 , 40 ). Se ha demostrado que los programas centrados en ejercicios de memoria y atención mejoran las conductas de autocuidado en pacientes con deterioro cognitivo leve ( 41 ). En este sentido, las intervenciones con apoyo de los cuidadores son especialmente valiosas, ya que estos pueden proporcionar la estructura necesaria para mejorar la adherencia a los regímenes de tratamiento ( 42 ). Además, los pacientes con fuertes redes de apoyo social tienden a experimentar mejores resultados en el autocuidado, mientras que los que viven solos tienen un mayor riesgo de sufrir un mal control de la enfermedad y un deterioro cognitivo más rápido ( 26 ).
A medida que progresa el deterioro cognitivo, los pacientes requieren niveles cada vez mayores de supervisión ( 43 ). Los cuidadores, ya sean familiares o profesionales de la salud, desempeñan un papel crucial para garantizar que estos pacientes reciban la atención adecuada, desde la administración de medicamentos hasta la asistencia con las tareas diarias ( 44 ). La supervisión constante mejora la seguridad y ayuda a prevenir situaciones peligrosas como caídas, errores de medicación o desnutrición. Sin embargo, la carga sobre los cuidadores puede ser significativa, lo que a menudo resulta en agotamiento del cuidador, lo que afecta la calidad de la atención y la salud general tanto del paciente como del cuidador ( 45 ). Un mayor apoyo de los proveedores de atención médica es crucial para ayudar a aliviar esta carga y garantizar la seguridad y el bienestar de ambas partes ( 46 ).
La negación del deterioro cognitivo plantea una barrera significativa para la intervención oportuna, particularmente en la demencia temprana ( 47 ). Esta negación retrasa el diagnóstico y reduce la eficacia de las intervenciones que podrían ralentizar la progresión de la enfermedad y deteriorar la calidad de vida ( 48 ). Además, el aislamiento social puede exacerbar tanto el deterioro cognitivo como los problemas de salud física. La ausencia de interacción social regular a menudo acelera la progresión de afecciones como la demencia, al mismo tiempo que aumenta la depresión y reduce los niveles de actividad física ( 49 , 50 ). Este ciclo de aislamiento social y deterioro de la salud resalta la importancia de las intervenciones integradas que abordan las necesidades sociales y cognitivas de los pacientes, así como la detección temprana y el apoyo continuo de los proveedores de atención médica. El deterioro cognitivo obstaculiza en gran medida el autocuidado efectivo en condiciones crónicas, lo que a menudo conduce a malos resultados de salud. La detección temprana, las intervenciones personalizadas y el apoyo constante de los cuidadores son esenciales para mejorar la atención al paciente y la calidad de vida.
Problema de memoria y ejecución de tareas. La prevalencia del deterioro cognitivo, en particular la demencia, aumenta exponencialmente con la edad. El deterioro cognitivo se produce en más del 40% de las personas mayores ( 51 ). El FS es muy común en personas con demencia (50,8 a 91,8%). Las personas con FS utilizan la polifarmacia con mucha más frecuencia ( 52 ). Las personas mayores a menudo tienen enfermedades crónicas que requieren un régimen terapéutico estricto (p. ej., hipertensión arterial). El nivel de adherencia al tratamiento antihipertensivo, en función de la edad, adopta la forma de una curva en U. Los más adherentes a la terapia son los pacientes en torno a los 65 años, mientras que el nivel más bajo de adherencia a las recomendaciones terapéuticas se observa en pacientes de 30 y > 80 años ( 53 ). El deterioro cognitivo afecta significativamente la adherencia a las recomendaciones terapéuticas. Un estudio de 436 personas mayores mostró que el 48,6% de ellas tenía un cumplimiento deficiente de la medicación. La presencia de deterioro cognitivo aumentó el riesgo de incumplimiento de la medicación en casi 3 veces (OR = 3,95; IC del 95 %: 2,63-5,92, p < 0,001) ( 54 ). Las altas preocupaciones por la medicación entre los pacientes mayores frágiles inhiben su cumplimiento de la medicación ( 52 ). En las personas mayores que utilizan polifarmacia, pueden ocurrir varias situaciones adversas relacionadas con el tratamiento: (1) descuidar el surtido de una receta para un medicamento recomendado; (2) omitir al menos una dosis; (3) tomar el medicamento equivocado; (4) tomar una cantidad excesiva de un medicamento recetado; (5) suspender un medicamento demasiado pronto; (6) uso incorrecto de equipo médico como inhaladores y jeringas, y (7) tomar medicamentos dañados, vencidos o almacenados incorrectamente. Todo esto hace que las personas mayores requieran instrucciones más detalladas para el uso de medicamentos e intervenciones educativas y conductuales que mejoren el cumplimiento del tratamiento ( 55 ). Las intervenciones de autogestión y las intervenciones de salud electrónica podrían ser eficaces para mejorar la adherencia a la medicación en personas mayores con multimorbilidad ( 56 ). Las técnicas de cambio de comportamiento basadas en la cognición son intervenciones eficaces que producen mejoras en la adherencia a la medicación que probablemente sean mayores que las intervenciones conductuales y educativas ampliamente utilizadas en la práctica actual ( 57 ). Siempre que sea posible, se debe recomendar el tratamiento combinado, por ejemplo, en pacientes con hipertensión y trastornos lipídicos (un comprimido con dos antihipertensivos y un comprimido con una estatina y ezetimiba; esto permite una reducción del 50 % en el número de comprimidos). El uso del tratamiento combinado mejora la adherencia y se asocia con un menor riesgo de efectos adversos ( 58) .). En personas con trastornos cognitivos y SF, el entrenamiento cognitivo es muy beneficioso. Se ha demostrado que el entrenamiento cognitivo beneficia significativamente la función cognitiva general, la memoria retrasada, la orientación, la atención y las habilidades del lenguaje en pacientes mayores con deterioro cognitivo ( 59 ). Esto puede traducirse significativamente en una mayor probabilidad de cumplimiento de las recomendaciones médicas con respecto al tratamiento de enfermedades crónicas. Aumentar el nivel de adherencia es muy importante porque se ha demostrado que una buena adherencia se asoció con una reducción del 21% en el riesgo de mortalidad a largo plazo en comparación con la no adherencia a la medicación (cociente de riesgos ajustado 0,79, IC del 95% 0,63, 0,98) ( 54 ). En pacientes adultos mayores con polifarmacia, se deben evaluar los medicamentos utilizados, así como al paciente. Se recomienda que en el contexto de los medicamentos utilizados: (1) evaluar las interacciones fármaco-fármaco, fármaco-enfermedad; (2) identificar la terapia no beneficiosa y simplificar; y (3) identificar la terapia de alto riesgo y reconsiderarla, mientras que en el contexto de la evaluación del paciente, se recomienda: (1) conciliación de la medicación (¿están todos los medicamentos indicados?); (2) evaluar la adherencia y cada barrera; (3) ajustar para la eliminación evitando la toxicidad (aclaramiento, metabolismo); (4) identificar el estado funcional, los déficits y redireccionar los recursos de medicación; y (5) identificar los objetivos de la atención y ajustar los medicamentos que sean consistentes ( 60 ).
2.2 Enfermedades crónicas seleccionadas y fragilidad
Hafızoğlu et al. presentaron recientemente los resultados de un estudio interesante en el que analizaron qué indicador relacionado con la medida de multimorbilidad es más apropiado en el contexto de la fragilidad. Se analizaron las relaciones entre cuatro índices de multimorbilidad (CIRS-G, ACCI, GIC, ICED) y tres escalas relacionadas con la gravedad de la fragilidad (FRAIL, CFS, TFI). Se encontró que CIRS-G era el indicador más apropiado ( 61 ). La escala CIRS-G incluye una evaluación de los siguientes sistemas u órganos para enfermedades crónicas: sistema cardiovascular, sistema circulatorio, sistema respiratorio, visión, audición, faringe y laringe, sistema digestivo, sistema excretor, sistema musculoesquelético, sistema nervioso y sistema endocrino ( 62 ). Por lo tanto, vale la pena prestar atención a la relación entre las enfermedades crónicas más comunes seleccionadas de las áreas mencionadas anteriormente y el síndrome de fragilidad.
Recientemente, se presentaron los resultados de un estudio que evaluó el impacto de una intervención de enfermería de 12 semanas basada en la teoría de la integración del cambio de comportamiento de salud en adultos mayores frágiles con diabetes mellitus tipo 2. Entre otras cosas, se observó una mejora significativa en el nivel de fragilidad ( p = 0,006) y la calidad de vida (todos p < 0,001) ( 63 ). De manera similar, según una revisión sistemática publicada recientemente, se demostró que los programas de ejercicio, dieta y educación reducen el riesgo de fragilidad o progresión a etapas más avanzadas en pacientes con diabetes tipo 2 y fragilidad ( 64 ).
La relación entre el síndrome de fragilidad y la hipertensión arterial es peor. Tanto la hipertensión como el síndrome de fragilidad tienen un impacto negativo en el control de la hipertensión ( 65 ). Sin embargo, sigue siendo cuestionable hasta qué punto el tratamiento antihipertensivo tiene un efecto beneficioso sobre el estado de fragilidad en esta población ( 66 ).
Según resultados publicados recientemente, no solo la enfermedad cardiovascular manifiesta, sino incluso los signos de disfunción o daño subclínico, como el aumento de los niveles de péptidos natriuréticos o troponina cardíaca, se traducen en un aumento significativo del riesgo de síndrome de fragilidad ( 67 ). Según un estudio de Zhong et al., diferentes intervenciones terapéuticas cardiovasculares pueden tener diferentes efectos dependiendo del estado de fragilidad ( 68 ). Ijaz et al. llamaron la atención sobre la multitud de intervenciones para mejorar el estado de fragilidad en pacientes con enfermedades cardiovasculares (clasificadas en intervenciones físicas, farmacológicas, cognitivas, nutricionales y psicosociales) y la necesidad de individualizar el manejo dependiendo de las necesidades de un paciente específico ( 69 ).
Se ha demostrado que la rehabilitación pulmonar tiene un efecto positivo en la fuerza de prensión manual en pacientes con EPOC. Curiosamente, un valor delta positivo en la fuerza de prensión manual se asoció con puntuaciones más altas en la calidad de vida inicial ( 70 ). Cabe destacar que la intervención con ejercicios también puede tener un impacto positivo en pacientes frágiles hospitalizados debido a una exacerbación de la EPOC como complemento al tratamiento estándar ( 71 ).
En un estudio de Yamashita et al., se descubrió que el cuidado proactivo de los pies puede ser fundamental para reducir el riesgo de fracturas en personas mayores frágiles ( 72 ). Esto es especialmente importante para pacientes con mayor riesgo de fracturas, como aquellos con osteoporosis.
2.3 Nutrición y actividad física
2.3.1 Evaluación del estado nutricional
El mal estado nutricional se considera uno de los marcadores clínicos modificables clave del FS. La evaluación nutricional integral desempeña un papel esencial en el enfoque holístico del manejo de las enfermedades crónicas, con el objetivo de mejorar los resultados y la calidad de vida del paciente ( 73 ). La desnutrición se asocia con el FS, y la detección e identificación temprana de la desnutrición pueden ayudar a prevenir la progresión de la discapacidad, en particular entre los adultos mayores ( 74 ). Las herramientas para evaluar la desnutrición incluyen el índice de masa corporal (IMC), las medidas antropométricas, los marcadores bioquímicos y las escalas de evaluación del riesgo nutricional ( 75 ). Si bien el IMC se usa ampliamente, puede no ser confiable debido a factores de confusión como el edema o la falta de especificidad con respecto a la composición corporal. Además, cuando se usa como un marcador único, el IMC puede no capturar la presentación fenotípica del FS, a menudo caracterizada por una pérdida de peso no intencional que excede los 4,5 kg o ≥ 5% ( 76 ).
Para la evaluación del riesgo de desnutrición, se encuentran disponibles herramientas como la Mini Evaluación Nutricional (MNA) y la Puntuación de Riesgo Nutricional 2002 (NRS-2002). La Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN) recomienda los criterios estandarizados de la Iniciativa de Liderazgo Global sobre Malnutrición (GLIM), que implica un procedimiento de dos pasos: detección inicial con cualquier herramienta validada, por ejemplo, NRS-2002, SGA o MNA, seguida de diagnósticos integrales que incluyen criterios fenotípicos y etiológicos junto con la evaluación de la gravedad de la desnutrición ( 77 ). En una evaluación integral, se deben considerar tanto los parámetros cuantitativos como los cualitativos. Muchos estudios describen una relación inversa entre la ingesta de proteínas y la prevalencia de FS, aunque la evidencia sigue siendo heterogénea. La sarcopenia, asociada con la pérdida de masa muscular y fuerza, se considera un componente crítico de la fragilidad y parece estar vinculada a la ingesta de proteínas ( 78 , 79 ). No solo la ingesta diaria de proteínas, sino también su distribución a lo largo del día, afecta la incidencia de FS ( 74 ).
En un metaanálisis de Coelho et al., la ingesta alta de proteínas en la dieta se correlacionó inversamente con el estado de fragilidad en adultos mayores ( 80 ). En un estudio posterior del mismo autor, aunque la ingesta de proteínas no se asoció significativamente con la fragilidad en adultos mayores, se observó que las fuentes de proteínas podrían desempeñar un papel clave en el desarrollo de la fragilidad, con una mayor ingesta asociada con un menor riesgo de FS ( 80 ). Por lo tanto, la evaluación de la calidad de la ingesta de proteínas por parte de un dietista calificado, junto con la identificación de posibles deficiencias, puede ayudar a identificar a los pacientes en riesgo. Un recordatorio dietético de 24 horas o una entrevista nutricional pueden ayudar a evaluar la ingesta.
Las personas con FS generalmente presentan una ingesta menor de energía, proteínas, fibra, vitamina D, vitamina C, folato y vitaminas B en comparación con las personas sin FS. Por lo tanto, la detección de posibles deficiencias es un componente clave. La deficiencia de vitamina D, por ejemplo, se asocia con una función física más deficiente y puede predecir la discapacidad física en los adultos mayores ( 81 ). La relación entre los niveles de vitamina D y la fragilidad se ha evaluado en numerosos estudios. Los datos observacionales de Hirani et al. indicaron que los niveles bajos de vitamina D se asocian de forma independiente con la fragilidad ( 82 ). Wang et al. confirmaron que los niveles más bajos de vitamina D (RR: −3,22; IC del 95 %: −3,86 a 2,59; p < 0,001) pueden estar asociados con la fragilidad. En particular, la vitamina D es esencial para mantener la homeostasis del calcio y la salud ósea, ya que los niveles bajos de calcio pueden contribuir a FS a través de mecanismos que afectan la fuerza muscular y la densidad ósea. Además, la osteoporosis y la sarcopenia prevalentes en adultos mayores aumentan la susceptibilidad a la fragilidad, la discapacidad, la hospitalización y la disminución de la calidad de vida ( 83 ). Deficiencias similares pueden incluir otras vitaminas, como la vitamina B6 y el folato, así como oligoelementos y minerales ( 84 , 85 ). Un estudio transversal entre mujeres de 70 a 80 años que participaron en los Estudios de salud y envejecimiento de la mujer I y II demostró una mayor probabilidad de niveles bajos de oligoelementos entre los pacientes con FS ( 86 ). Por lo tanto, realizar un análisis nutricional exhaustivo y manejar las deficiencias de nutrientes específicas de FS proporciona un enfoque multifacético y debe implementarse en este grupo de pacientes.
2.3.2 Intervenciones nutricionales
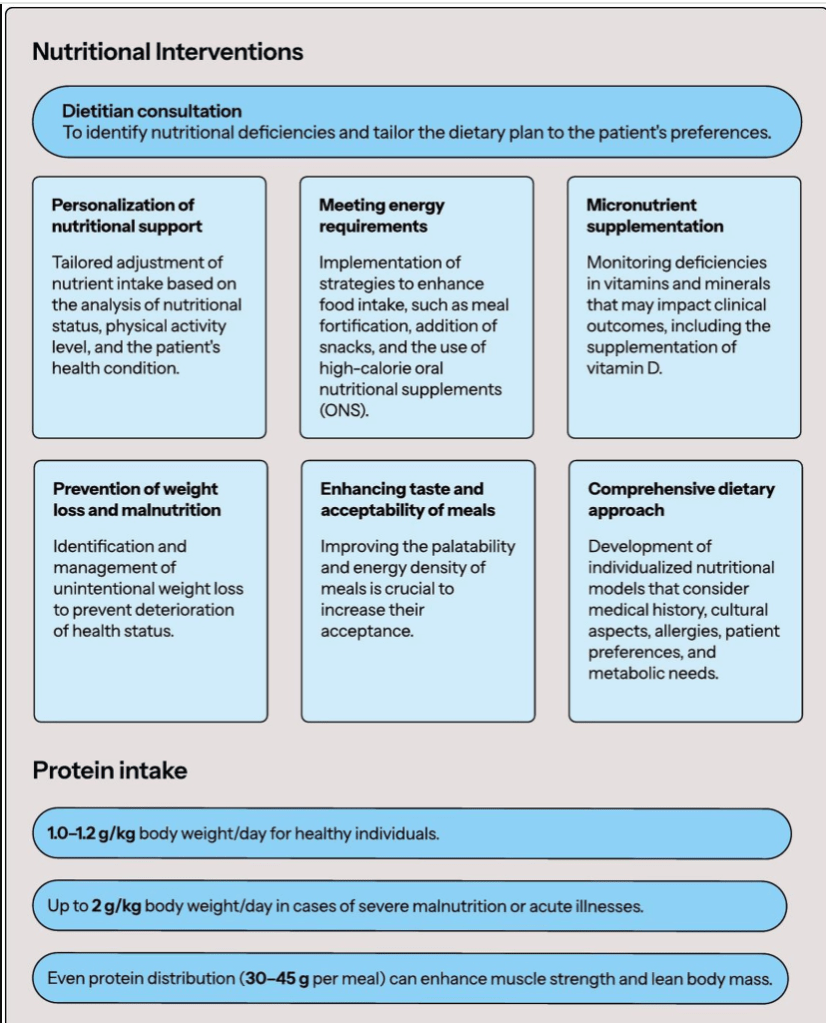
Las intervenciones multimodales, incluidas las estrategias nutricionales eficaces, deben tener como objetivo mitigar los efectos adversos para la salud y reducir la gravedad del síndrome de fatiga crónica (SF) ( 87 ). El apoyo nutricional debe ser personalizado, ajustando la ingesta de nutrientes en función de un análisis exhaustivo del estado nutricional, el nivel de actividad física y el estado del paciente.
Un componente clave de la intervención nutricional es satisfacer los requerimientos energéticos del paciente. La ingesta baja de energía afecta comúnmente a individuos mayores, particularmente entre la cuarta y séptima décadas de vida ( 84 , 88 ). Un estudio de Kim et al. demostró que la suplementación proteico-energética entre pacientes adultos mayores con bajo nivel socioeconómico desacelera el declive funcional ( 89 ). Por lo tanto, explorar intervenciones para estimular la ingesta de alimentos es crucial. Esto podría incluir estrategias como la fortificación de las comidas, refrigerios adicionales, fortificación dietética (particularmente con suplementos nutricionales orales, ONS), mejorar la palatabilidad, asegurar una alta densidad energética y proporcionar formas de comida adecuadas ( 88 ). ONS puede ser beneficioso para mejorar el estado nutricional, especialmente cuando se combina con intervenciones multifactoriales ( 89 , 90 ). Se recomienda la identificación y el tratamiento adecuados de la pérdida de peso no intencional y la desnutrición entre los pacientes con FS ( 91 ).
Entre los adultos mayores, la ingesta de proteínas puede ser insuficiente, lo que lleva a un rendimiento físico reducido y peores resultados clínicos. La evidencia respalda el efecto de la suplementación con proteínas en los resultados clínicos. Aunque la ingesta óptima de proteínas para adultos mayores sigue sin estar definida, un estudio de Vellas et al. encontró que las mujeres que consumían más de 1,2 g/kg de peso corporal/día de proteína experimentaron menos problemas de salud en comparación con las que consumían 0,8 g/kg/día ( 84 , 92 ). En la investigación de Bonnefoy et al., la suplementación proteico-energética no aumentó significativamente la masa corporal magra, pero mejoró la fuerza muscular en pacientes mayores con FS ( 93 ). La ingesta de proteínas para adultos mayores debe adaptarse al estado nutricional, el nivel de actividad física, el estado de salud y la tolerancia, y oscila entre 1,0 y 1,2 g/kg de peso corporal en individuos sanos hasta 2 g/kg en pacientes gravemente desnutridos o con enfermedades agudas ( 94 , 95 ). Otra posible intervención incluye la distribución uniforme de proteínas en las comidas. Loenneke et al. Se demostró que consumir comidas con 30–45 g de proteína por comida se asoció con mayor fuerza y masa magra en las piernas ( 96 ). Si bien se necesita más investigación, una distribución uniforme de proteínas a lo largo del día puede mejorar no solo los resultados del paciente, sino también la ingesta diaria total de proteínas. Se necesitan estudios adicionales sobre la cantidad, la calidad y los tipos de ingesta de proteínas, así como nuevas estrategias para abordar la síntesis de proteína muscular deteriorada relacionada con el estado inflamatorio en el síndrome de fatiga crónica (SF) ( 84 ).
Hay una brecha significativa en la literatura sobre los efectos de la suplementación con minerales y vitaminas en pacientes con FS, y los resultados de los estudios actuales siguen sin ser concluyentes ( 97 ). Alguna evidencia sugiere que la suplementación con micronutrientes puede mejorar el estado nutricional y la capacidad funcional, aunque su impacto en la fragilidad no está claro, como lo destaca una revisión sistemática reciente ( 98 ). Si bien la ingesta de vitamina D es fundamental, particularmente entre los adultos mayores debido a su asociación con la salud ósea, la fuerza muscular y la función, el impacto de la suplementación en el FS sigue siendo incierto ( 91 ). Un metaanálisis de Muir et al. encontró que la suplementación diaria con vitamina D (20–25 μg) se asoció con una mejor velocidad de la marcha y fuerza muscular en adultos mayores ( 99 ). Además, los adultos mayores que viven con FS pueden tener una menor exposición al sol, lo que indica una necesidad de suplementación con vitamina D ( 100 ).
Un elemento crucial en la personalización de la intervención dietética es reconocer que la dieta de un paciente podría no cubrir las necesidades nutricionales básicas, incluyendo minerales y vitaminas, y que las deficiencias podrían afectar indirectamente los resultados clínicos. Consultar a un dietista cualificado y realizar una evaluación nutricional detallada puede ayudar a identificar problemas y brindar el apoyo nutricional adecuado. La selección del modelo dietético y la intervención nutricional adecuados debe incluir una historia clínica y dietética completa, y debe adaptarse individualmente a la condición del paciente. El plan nutricional debe considerar las preferencias del paciente, los aspectos culturales, las posibles alergias y la necesidad de abordar cualquier deficiencia nutricional. La Figura 1 presenta un resumen de las intervenciones dietéticas utilizadas en la SF.
2.3.3 Programas de ejercicio físico
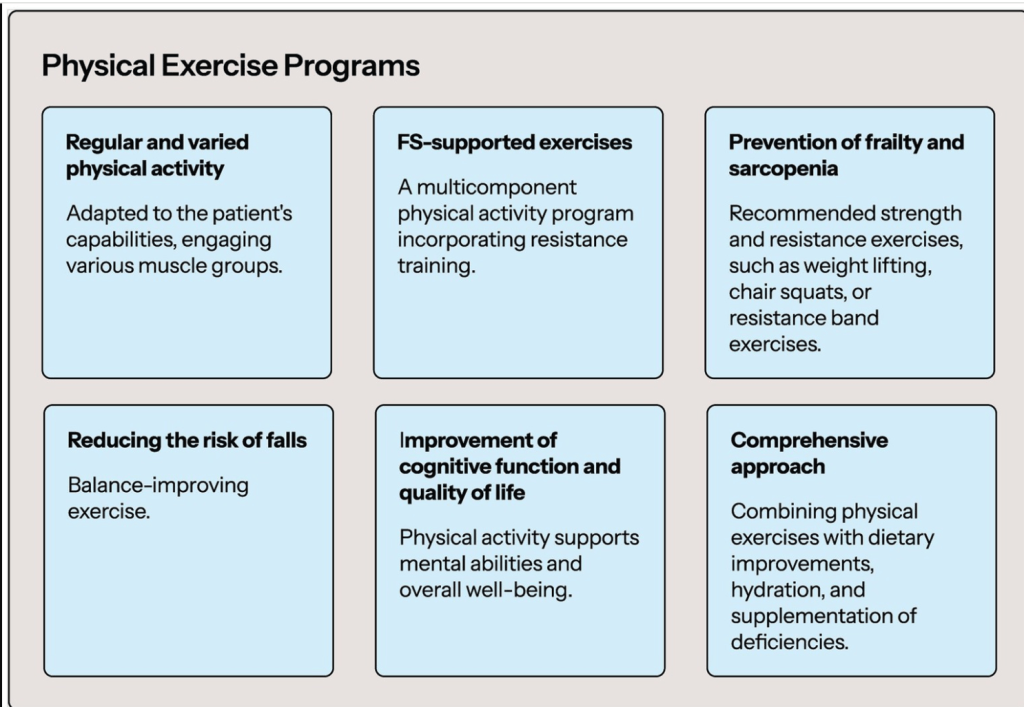
Los niveles bajos de actividad física son mucho más comunes en personas con FS ( 101 ). Vale la pena enfatizar que las personas con niveles más altos de actividad física se caracterizan por un riesgo 37% menor de desarrollar FS (ES 0,63, IC del 95%: 0,52-0,77) ( 102 ). La actividad física/ejercicio se considera una de las principales estrategias para contrarrestar el deterioro físico relacionado con la fragilidad en los adultos mayores ( 103 ). Hay varios programas de ejercicio físico disponibles para mejorar la condición de los pacientes con FS. Uno de ellos es el Programa de Ejercicio Físico Multicomponente VIVIFRAIL para Prevenir la Fragilidad y el Riesgo de Caídas, que incluye siete ejercicios diferentes: (1) caminar (cuando la fuerza muscular lo permita, de lo contrario se debe mejorar primero; el tiempo de caminata debe extenderse gradualmente dependiendo de las capacidades individuales); (2) apretar una pelota (12 repeticiones, 3 series); (3) levantar una botella (12 repeticiones, 3 series); (4) extender las piernas usando una tobillera con balasto (12 repeticiones, 3 series); (5) levantarse de una silla con la ayuda de un acompañante (12 repeticiones, 3 series); caminar con los pies sobre una línea (15 pasos, 3 series); y (6) brazos extraños (3 repeticiones, 3 series; mantener 10 s). Ejemplo de ruedas de ejercicios para cada nivel funcional que incluyen los ejercicios, series y repeticiones que se deben realizar cada semana ( 104 ). Se debe enfatizar que la disminución progresiva de la capacidad intrínseca y la reserva funcional (que finalmente conduce a la discapacidad) se puede ralentizar significativamente en las etapas de prefragilidad y fragilidad si se realiza una intervención terapéutica adecuada (se implementa un programa de ejercicios físicos adecuados). En la etapa de discapacidad, la reversibilidad de la capacidad intrínseca y la reserva funcional perdidas es mucho más difícil de lograr ( 103 ). La extraordinaria importancia de la actividad física en personas con SF se ve enfatizada por el hecho de que la actividad física podría compensar parcialmente el mayor riesgo de mortalidad asociado con la fragilidad en la vejez ( 105 ). En el contexto de la implementación de un programa de ejercicios físicos apropiados, se debe prestar especial atención a las personas que fueron menos activas físicamente en etapas anteriores de la vida. El riesgo de SF en estas personas es significativamente mayor, por lo tanto, requieren programas especiales de educación y actividad física para reducir este riesgo ( 105 ). Mantener un nivel apropiado de actividad física en personas con SF también se asocia con una mejora significativa en la cognición global y la flexibilidad mental ( 106 ). El SF es uno de los factores más importantes que aumentan el riesgo de caídas en los adultos mayores ( 107).). La actividad física, además de su efecto beneficioso sobre la longevidad y las funciones cognitivas, contribuye a reducir el riesgo de caídas en pacientes con fragilidad (riesgo relativo 0,66; IC del 95 %: 0,52-0,84) ( 108 ). Cabe destacar que la actividad física, para que sea lo más beneficiosa posible en personas con FS, debe ser regular, involucrar diferentes partes del cuerpo y debe adaptarse a las capacidades individuales del paciente. No se puede olvidar el problema de la sarcopenia en pacientes con FS. La sarcopenia y la fragilidad coexistieron en el 12,1 % de los pacientes. La coexistencia de FS y sarcopenia empeora el pronóstico de los pacientes ( 109 ). Se ha demostrado que la actividad física contribuye a reducir el riesgo tanto de FS como de sarcopenia en los adultos mayores ( 110 , 111 ). La actividad física reduce el riesgo de sarcopenia en los adultos mayores hasta en un 50% ( 110 ). La terapia de primera línea para el manejo de la fragilidad debe incluir un programa de actividad física multicomponente con un componente de entrenamiento basado en la resistencia (recomendación fuerte) ( 112 ). Por supuesto, es mejor si la intervención de salud en una persona con FS incluye no solo actividad física, sino también ejercicios cognitivos, mejora de los hábitos alimenticios (incluyendo hidratación adecuada y suplementación de posibles deficiencias) ( 113 ). La Figura 2 proporciona un Programa de Ejercicio Físico en FS.Figura 2
3 Rol de los cuidadores y del equipo multidisciplinario
3.1 Rol de los cuidadores: carga y apoyo a los cuidadores: desafíos asociados con el cuidado de los pacientes y la necesidad de educación y apoyo para los cuidadores
Los cuidadores informales desempeñan un papel fundamental en el apoyo a pacientes con enfermedades crónicas, garantizando que cumplan con los planes de tratamiento y previniendo complicaciones ( 114 ). Su contribución es especialmente importante cuando los pacientes deben seguir regímenes de tratamiento complejos y requieren asistencia con el cuidado diario ( 29 ). Involucrar a los cuidadores en las tareas diarias de autocuidado es fundamental para prevenir problemas de salud y mejorar el bienestar general del paciente. Se ha demostrado que la participación activa de los cuidadores reduce significativamente la carga de síntomas y mejora el manejo de las enfermedades crónicas ( 115 ).
El papel de los cuidadores cobra mayor importancia cuando el deterioro cognitivo, como la demencia, coexiste con la enfermedad crónica. En estos casos, los cuidadores deben afrontar no solo las exigencias físicas del cuidado, sino también las dificultades derivadas de las disfunciones cognitivas, como los lapsus de memoria y la confusión, que, entre otras, plantean importantes dificultades para la adherencia al plan de tratamiento ( 116 ). Existe evidencia de que los cuidadores de pacientes con demencia suelen estar más estresados que quienes atienden otras enfermedades y se enfrentan a un mayor distrés emocional y mental, lo que puede derivar en tasas más altas de depresión y ansiedad ( 117 ).
La preparación para el cuidado es otro factor clave para garantizar una atención eficaz. La preparación se refiere a la capacidad percibida del cuidador para manejar las responsabilidades emocionales y físicas del cuidado. Los estudios han demostrado que los cuidadores mejor preparados para sus funciones sufren menos ansiedad y depresión, lo que mejora su capacidad para brindar una atención constante y de alta calidad ( 118 ). Además, la confianza del cuidador, es decir, la creencia en su propia capacidad para brindar una atención eficaz, es fundamental. Los cuidadores seguros tienen más probabilidades de contribuir positivamente al autocuidado del paciente, mantener la estabilidad del paciente y responder adecuadamente al deterioro de la salud ( 118 ). Por lo tanto, promover la preparación y la confianza del cuidador es fundamental para mejorar los resultados tanto del paciente como del cuidador.
A pesar de los aspectos positivos que conlleva la experiencia de cuidar (p. ej., crecimiento personal y satisfacción con el rol) ( 119 ), los cuidadores enfrentan numerosos desafíos, particularmente cuando cuidan a pacientes con enfermedades crónicas y deterioro cognitivo ( 120 ). El esfuerzo físico es común, ya que tareas como ayudar con la movilidad y el cuidado personal pueden provocar dolor crónico y fatiga ( 121 ). Emocionalmente, los cuidadores experimentan un mayor estrés debido a los síntomas psicológicos y conductuales asociados con afecciones como la demencia ( 122 ). Con el tiempo, estos factores estresantes pueden llevar al agotamiento, que no solo afecta el bienestar del cuidador sino que también disminuye la calidad de la atención brindada al paciente ( 45 ).
Otros factores que dificultan el proceso de cuidado incluyen el aislamiento social, la soledad y la carga financiera. Debido a la naturaleza exigente de sus responsabilidades y tareas, los cuidadores a menudo se aíslan y carecen de apoyo social ( 123 ). Esta falta de conexión exacerba la fatiga emocional y contribuye al deterioro de la salud mental. Además, la carga financiera es común, ya que muchos cuidadores reducen su jornada laboral o renuncian por completo a su trabajo para brindar cuidados ( 124 ). Estos desafíos acumulativos resaltan la necesidad de sistemas de apoyo integrales para reducir la carga de los cuidadores.
Para mejorar los resultados de salud de ambos miembros de la díada, es esencial mejorar la contribución y la preparación de los cuidadores, en particular para los pacientes con deterioro cognitivo. Los programas educativos (es decir, cursos sobre administración de medicamentos, iniciativas de apoyo emocional y plataformas digitales como aplicaciones móviles y realidad virtual) han demostrado ser eficaces para mejorar los resultados de los cuidadores ( 125 ), especialmente aquellos que equipan a los cuidadores con las habilidades necesarias para gestionar las tareas y los síntomas médicos. El cuidado de relevo es otra estrategia que podría implementarse porque ofrece un alivio temporal de sus deberes y reduce el riesgo de agotamiento ( 126 ). El acceso a los servicios de salud mental y a los grupos de apoyo es igualmente importante, ya que proporciona validación emocional y ayuda a los cuidadores a lidiar con el estrés de su función ( 127 , 128 ). Para los cuidadores que están solos, las intervenciones personalizadas, como la meditación consciente, las aplicaciones informáticas y la musicoterapia, son esenciales para ayudar a reducir los sentimientos de aislamiento y soledad. Estas intervenciones no solo brindan alivio emocional, sino que también mejoran la capacidad de los cuidadores para lidiar con el estrés ( 128 ). Los cuidadores son esenciales para el manejo de enfermedades crónicas, especialmente cuando existe deterioro cognitivo. Mejorar la preparación de los cuidadores y brindar sistemas integrales de apoyo son esenciales para garantizar una atención de alta calidad a los pacientes, a la vez que se protege el bienestar del cuidador.
3.2 Equipo multidisciplinario
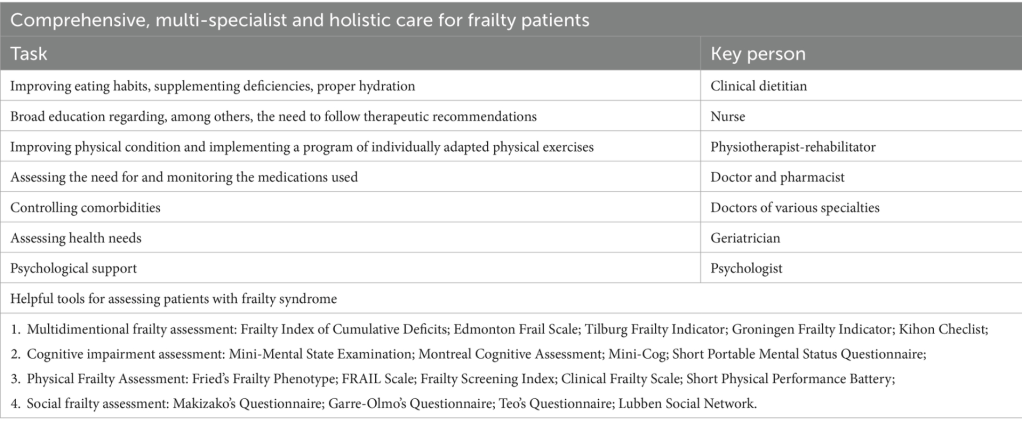
Una persona adulta mayor con FS se caracteriza por problemas muy complejos que empeoran significativamente su calidad de vida. Un metaanálisis que abarca más de 54 mil personas adultas mayores mostró que la fragilidad y la prefragilidad, según una definición multidimensional, son comunes en las personas mayores que afectan, respectivamente, a una persona de cada cuatro y a una de cada tres ( 129 ). La fragilidad, los síndromes geriátricos, la discapacidad y la multimorbilidad a menudo se superponen y aumentan el riesgo de mortalidad y una peor calidad de vida ( 130 ). Vale la pena enfatizar que la prevalencia de multimorbilidad en individuos frágiles fue del 72% ( 131 ). La FS cubre varios dominios del funcionamiento humano: (1) Condición física: sarcopenia, insuficiencia física, disfunción oral, desnutrición; (2) Condición mental: deterioro cognitivo, demencia, depresión; (3) Condición social: aislamiento social, vivir solo, falta de apoyo social, privación económica ( 132 ). Esto indica la necesidad de una atención integral, multiespecializada y holística para estos pacientes. La atención óptima para un paciente con FS debe ser multidireccional e incluir: (1) mejorar los hábitos alimentarios, suplementar las deficiencias, hidratación adecuada (un papel importante para un dietista clínico); (2) educación amplia con respecto a, entre otros, la necesidad de seguir las recomendaciones terapéuticas (un papel importante para una enfermera); (3) mejorar la condición física e implementar un programa de ejercicios físicos adaptados individualmente (un papel importante para un fisioterapeuta-rehabilitador); (4) evaluar la necesidad y monitorear los medicamentos utilizados (un papel importante para un médico y farmacéutico); (5) controlar las comorbilidades (un papel importante para los médicos de varias especialidades); (6) evaluar las necesidades de salud (un papel importante para un geriatra) y (7) apoyo psicológico (un papel importante para un psicólogo) ( 133 ). Las siguientes escalas son extremadamente útiles para evaluar la gravedad del FS y especificar las necesidades individuales: (1) Evaluación de fragilidad multidimensional: Índice de fragilidad de déficits acumulativos; Escala de fragilidad de Edmonton; Indicador de fragilidad de Tilburg; Indicador de fragilidad de Groningen; Kihon Checlist; (2) Evaluación del deterioro cognitivo: Mini-Examen del estado mental; Evaluación cognitiva de Montreal; Mini-Cog; Cuestionario portátil corto del estado mental; (3) Evaluación de fragilidad física: Fenotipo de fragilidad de Fried; Escala FRAIL; Índice de detección de fragilidad; Escala de fragilidad clínica; Batería corta de rendimiento físico; (4) Evaluación de fragilidad social: Cuestionario de Makizako; Cuestionario de Garre-Olmo; Cuestionario de Teo; Red social de Lubben ( 132 ). Un aspecto extremadamente importante es aumentar la conciencia del personal médico y las familias de las personas mayores con FS sobre sus necesidades de salud individuales. Tabla 1Presenta un resumen de la atención integral, multiespecializada y holística para pacientes frágiles.
4 Gestión y seguridad de los medicamentos
4.1 Gestión de medicamentos
La polifarmacia es uno de los temas críticos que se discuten en el contexto de la SF, especialmente en los adultos mayores. No existe una definición comúnmente aceptada de polifarmacia. Según el informe preparado por la Organización Mundial de la Salud, la polifarmacia puede definirse como «el uso concurrente de múltiples medicamentos» y «a menudo se define como el uso rutinario de cinco o más medicamentos» ( 134 ). Las definiciones disponibles en la literatura son diferenciadas. Algunas definiciones incluyen solo una cantidad de medicamentos, o en combinación con la duración de la terapia, o incluso en un entorno de atención médica ( 135 ). Aunque la polifarmacia puede considerarse parcialmente como una consecuencia de la multimorbilidad ( 136 ) y, por lo tanto, difícil de evitar para tratar simultáneamente múltiples enfermedades crónicas de acuerdo con el conocimiento médico actual, la literatura la discute como un problema significativo, principalmente en los adultos mayores, y un factor de riesgo que puede conducir a mayores disminuciones en el estado de salud ( 137 , 138 ). No cabe duda de que la lista de medicamentos que utiliza un paciente debe verificarse periódicamente para evitar la prescripción inapropiada ( 139 ). El riesgo de complicaciones iatrogénicas aumenta especialmente en pacientes con síndrome de fatiga crónica ( 140 ), quienes se caracterizan por una reducción de las reservas fisiológicas y de la resistencia a los factores de estrés ( 141 ).
Gutiérrez-Valencia presentó los resultados de una revisión sistemática que incluyó 25 estudios observacionales. La mayoría de las publicaciones incluidas en el análisis (16 de 18 estudios transversales y cinco de siete análisis longitudinales) indican una asociación significativa entre la polifarmacia y la fragilidad ( 142 ). Cabe destacar que las diferentes definiciones de polifarmacia pueden dar lugar a conclusiones diferentes en estudios individuales. Algunos estudios indican que el uso de seis o más medicamentos puede considerarse un buen predictor de un mayor riesgo de desarrollar SF ( 143 , 144 ).
Se ha demostrado que la polifarmacia aumenta el riesgo de fragilidad en diferentes poblaciones.
Se encontró una fuerte correlación positiva entre el estado de fragilidad (evaluado por la Escala de Fragilidad Clínica) y la polifarmacia (definida como tomar al menos cinco medicamentos) en 298 pacientes de atención primaria de al menos 65 años ( 145 ). De manera similar, se mostró una asociación significativa entre la polifarmacia y el riesgo de fragilidad en un grupo de 124 pacientes hospitalizados ( 146 ). Los pacientes de hemodiálisis que toman más de 11 medicamentos tienen un riesgo significativamente mayor de aparición de fragilidad al inicio que los pacientes que toman menos de ocho medicamentos (OR 1,54, IC del 95%: 1,05–2,26). Además, el riesgo de desarrollo de fragilidad en la observación de dos años es significativamente mayor en pacientes que toman más de 11 medicamentos que en pacientes que toman menos de ocho medicamentos (HR de subdistribución 2,15, IC del 95%: 1,32–3,48) ( 147 ). El impacto significativo del número de medicamentos en la ocurrencia de fragilidad también se demostró en otro estudio que incluyó a 388 pacientes japoneses de hemodiálisis (OR = 1.351, IC del 95%: 1.163-1.570) ( 148 ). En el grupo de pacientes con infección por VIH, cada medicamento crónico no antirretroviral adicional se asocia con un aumento del 4% en el riesgo de tener un dominio de fenotipo relacionado con la fragilidad adaptado (OR 1.04; IC del 95%: 1.03, 1.05) ( 149 ). Según otro estudio, en pacientes mayores con infección por VIH, el valor análogo del aumento del riesgo de diagnóstico de fragilidad se evaluó al nivel del 6% (OR ajustado 1.06, IC del 95%: 0.002-0.11, p = 0.04) ( 150 ). En un estudio retrospectivo que incluyó a pacientes mayores en cuidados críticos, se demostró que la mediana de la Escala de Fragilidad Clínica del paciente aumentaba en 1 con los incrementos en la clasificación de polifarmacia ( p < 0,001) ( 151 ). Se encontró que tomar al menos ocho medicamentos estaba significativamente asociado con la fragilidad en pacientes con neoplasias sanguíneas (OR ajustado 2,82, IC del 95% 1,92–4,17) ( 152 ). La prefragilidad y la fragilidad se asociaron con un mayor riesgo de polifarmacia también en pacientes con antecedentes de cáncer (OR 8,26, IC del 95% 1,74–39,2) ( 153 ). La polifarmacia se asocia no solo con la fragilidad sino también con la prefragilidad. En un estudio observacional transversal en el que participaron 201 pacientes, se demostró que los individuos con fragilidad y prefragilidad tenían un mayor riesgo de polifarmacia en comparación con los pacientes sin características de fragilidad (OR 2,36, IC 95% 1,05–5,37; p = 0,04) ( 154 ). En adultos mayores que viven en la comunidad en Europa, se encontró que la prevalencia de polifarmacia era tres veces más prevalente en pacientes frágiles y dos veces más en individuos prefrágiles, en comparación con pacientes sin características de FS ( 155 ).
Según un meta-análisis preparado por Wang et al., se demostró que la polifarmacia es un factor de riesgo significativo para el desarrollo de FS (RR 1.72, IC 95% 1.17–2.28, p < 0.001 en estudios que tomaron en consideración un número preciso de fármacos; RR 1.49, IC 95% 1.39–1.60, p < 0.001 en estudios que no tomaron en consideración un número preciso de fármacos). Curiosamente, en el mismo meta-análisis, factores como la edad, el accidente cerebrovascular y las enfermedades cardíacas no demostraron estar significativamente asociados con un mayor riesgo de fragilidad ( 156 ). En un meta-análisis de 13 estudios, se encontró que los pacientes con fragilidad e insuficiencia cardíaca se caracterizan por un mayor riesgo de polifarmacia (OR 1.87, IC 95% 1.72–2.04, p < 0.01) en comparación con los pacientes sin fragilidad ( 157 ). De manera similar, un metanálisis de 12 estudios demostró que la polifarmacia es un factor de riesgo de fragilidad en pacientes con enfermedad pulmonar obstructiva crónica ( 158 ).
También hay datos que muestran que la polifarmacia también puede estar asociada con peores resultados. Un gran análisis realizado utilizando los datos de seguimiento de reclamaciones del Seguro Nacional de Salud de Corea de 2002 a 2017 en un grupo de 55.228 personas encontró que la polifarmacia estaba asociada con un mayor riesgo de mortalidad por todas las causas, hospitalización y visitas a la sala de emergencias entre los sobrevivientes de cáncer colorrectal de mayor edad ( 159 ). De manera similar, la polifarmacia está asociada con un peor pronóstico en pacientes con estenosis aórtica grave ( 160 ). Curiosamente, de Breij et al. encontraron que la polifarmacia era un factor explicativo de la asociación entre la fragilidad y la mortalidad en los adultos mayores ( 161 ).
Teniendo en cuenta el impacto significativo de la polifarmacia en el desarrollo de la fragilidad, se puede esperar que la desprescripción pueda ser beneficiosa en pacientes predispuestos al FS. La desprescripción podría definirse como el proceso de retiro de medicamentos o reducción de dosis para corregir o prevenir complicaciones relacionadas con los medicamentos ( 162 ). Ibrahim et al. presentaron los resultados de una revisión sistemática de estudios destinados a evaluar el impacto de la desprescripción entre adultos mayores con fragilidad. Aunque los autores enfatizaron que hay una escasez de investigación en esta área, los estudios incluidos sugieren que la desprescripción puede conducir a beneficios importantes ( 163 ). Dinarvand et al. describieron el papel crítico de la cooperación de geriatras y farmacéuticos en la desprescripción en la población de edad avanzada frágil tratada debido a diabetes e hipertensión. Además, se ha enfatizado la necesidad de más ensayos ( 164 ).
5 Seguridad del paciente
En el caso de personas con síndrome de fatiga crónica, es particularmente importante garantizar la seguridad del paciente evitando factores que puedan predisponer a eventos adversos. En el contexto de la farmacoterapia, es crucial evitar los medicamentos que pueden contribuir a la reducción del tono muscular esquelético y la somnolencia excesiva, lo cual se asocia con un mayor riesgo de caídas. Se demostró que los medicamentos con propiedades anticolinérgicas se asociaban de forma independiente con un aumento de caídas en participantes frágiles (OR ajustado = 3,84, IC del 95 %: 1,48-9,93, p = 0,006) y prefrágiles (OR = 2,71, IC del 95 %: 1,25-5,89, p = 0,012), pero no en sujetos robustos ( 165 ). Según el análisis basado en datos de la Encuesta Nacional de Entrevistas y Exámenes de Salud para Adultos 2008-2011, el uso de fármacos psicotrópicos se asocia independientemente con un mayor riesgo de caídas (OR 1,64, IC 95% 1,14-2,37), especialmente para los inhibidores selectivos de la recaptación de serotonina (OR 6,22, IC 95% 2,28-17,0) ( 166 ).
En el caso de adultos mayores con fragilidad, puede ser necesario modificar el tratamiento farmacológico de las enfermedades crónicas, especialmente en el campo de los medicamentos que afectan la presión arterial y los medicamentos antidiabéticos. La proporción entre los beneficios esperados de un excelente control de las enfermedades crónicas y el riesgo asociado con la farmacoterapia debe considerarse en el contexto de la esperanza de vida. En muchos casos, es beneficioso adoptar objetivos terapéuticos menos restrictivos para el control de las enfermedades crónicas para evitar complicaciones de posible hipotensión e hipoglucemia que también pueden conducir a un mayor riesgo de caídas, así como al deterioro de la función cognitiva ( 167 ). Por lo tanto, en el caso de adultos mayores con FS grave (al menos 5 puntos en la Escala de Fragilidad Clínica), un nivel satisfactorio de control de la diabetes puede considerarse como HbA1c < 8,5%. Si es necesario reducir la cantidad de medicación utilizada, vale la pena considerar primero suspender la insulina y los derivados de sulfonilurea, es decir, medicamentos que pueden conducir a hipoglucemia ( 168 ). En un gran estudio de Nguyen et al. (11.400 participantes, incluyendo 25,7% frágiles), se confirmó que los tratamientos intensivos hipoglucemiantes y antihipertensivos pueden ser menos beneficiosos en pacientes con fragilidad ( 169 ). Sin embargo, debe enfatizarse que los resultados de la investigación con respecto a la relación entre el control de enfermedades crónicas y el balance riesgo-beneficio en pacientes frágiles no son completamente inequívocos. O’Donoghue et al. enfatizaron que diferentes clasificaciones de fragilidad pueden estar asociadas con diferentes implicaciones pronósticas para el propósito de la aplicación de las pautas de manejo de la hipertensión ( 170 ). Por otro lado, según Wang et al. los pacientes con fragilidad deben ser tratados de manera similar a otros pacientes, porque no hay una diferencia significativa en los beneficios del control intensivo de la presión arterial sin un mayor riesgo de eventos adversos graves ( 171 ).
6 Adaptación de las intervenciones a las necesidades individuales
6.1 Personalización de las intervenciones
La personalización de las intervenciones se reconoce ahora universalmente como un aspecto clave en el tratamiento de la fragilidad ( 172 ). Estas se logran principalmente a través de la planificación personalizada de la atención (PCP), que se considera en efecto una intervención con la que se asocian resultados positivos conocidos ( 173 ). De hecho, la PCP se asocia a un mayor control de la propia salud y a una mejora de la salud física y mental ( 173 ) y, en particular, a una mayor disposición a adherirse a comportamientos saludables ( 174 ). Como se describió anteriormente, la fragilidad tiene una naturaleza multidimensional. En esta perspectiva, una evaluación multidominio, liderada por un equipo multidisciplinario, es obligatoria y debe ser el primer paso para contrarrestar la fragilidad ( 175 ). Además del enfoque farmacológico, es bien conocido en la literatura que el ejercicio, las intervenciones nutricionales y el apoyo cognitivo representan enfoques efectivos en el tratamiento de la fragilidad, incluso pudiendo revertir su curso hacia un envejecimiento saludable y activo ( 176 ). Los siguientes capítulos profundizarán en este tipo de intervenciones.
6.2 Programas de ejercicios personalizados: adaptación de los programas de ejercicios a las capacidades individuales del paciente
Revisiones sistemáticas recientes con metaanálisis coinciden en que el ejercicio aporta beneficios para contrarrestar la fragilidad ( 102 , 177 ). Sigue sin estar claro qué tipo de ejercicio es óptimo para los adultos mayores frágiles, aunque la variación de las intervenciones parece aportar beneficios ( 177 ). Sin embargo, el primer paso debe ser una evaluación exhaustiva de las capacidades y habilidades de la persona. Esta evaluación debe incluir, entre otros: músculo esquelético, sistema respiratorio, sistema cardiovascular y sistema endocrino ( 103 ). Esta evaluación permitirá enmarcar a la persona para identificar los tipos de actividad física que se pueden realizar de forma segura. Es importante recordar cómo, además de estas consideraciones fundamentales que son una garantía de seguridad para la persona, la elección de la intervención también debe hacerse respetando las preferencias de la persona, para así tener una mayor participación en el curso del tratamiento y, en consecuencia, una mayor adherencia ( 173 ). Sin embargo, con pleno respeto por las capacidades y preferencias de la persona, la actividad física en grupo debe ser la primera opción. De hecho, existe evidencia de que la actividad física grupal produce beneficios no solo en el ámbito físico, sino también en el ámbito social, con una disminución de los niveles de soledad y aislamiento social ( 178 ). El ejercicio debe abarcar todas las facetas, con una parte dedicada al fortalecimiento muscular, un entrenamiento de resistencia y un componente aeróbico ( 177 ); sin embargo, también los programas basados en actividades de flexibilidad, como el yoga ( 179 ) y el taichí ( 102 ), aportan beneficios. La actividad física individual debe seguir los mismos principios, con la ventaja de una mayor posibilidad de personalizar la intervención y con la oportunidad de realizarse en el hogar.
6.3 Intervenciones nutricionales personalizadas: intervenciones nutricionales personalizadas que abordan las necesidades individuales
Para optimizar los resultados relacionados con el ejercicio, es esencial realizar una evaluación cuidadosa del estado nutricional ( 180 ). De hecho, está bien documentado que en los adultos mayores, tanto la ingesta de energía como la de proteínas son inferiores a las requeridas ( 181 ), lo que dificulta los beneficios del ejercicio. Desde esta perspectiva, este tipo de evaluación se debe realizar junto con la evaluación del ejercicio. Se recomienda que las personas sanas consuman proteínas a un nivel de 1,0 a 1,2 g/kg de peso corporal ( 182 ). En el caso de los adultos mayores desnutridos o diagnosticados con una enfermedad crónica que pueda aumentar el riesgo de desnutrición, la ingesta debe oscilar entre 1,2 y 1,5 g de proteína/kg de peso corporal. Los pacientes que padecen una enfermedad aguda o desnutrición grave pueden requerir una ingesta de proteínas de hasta 2 g/kg de peso corporal. La cantidad debe ajustarse individualmente en función del estado nutricional, los niveles de actividad física, la condición de la enfermedad y la tolerancia ( 94 , 95 ). La ingesta energética diaria recomendada para los adultos mayores es de 30 kcal por kilogramo de peso corporal; Sin embargo, este valor debe ajustarse individualmente en función del estado nutricional, el nivel de actividad física y el estado de salud ( 94 , 183 ).
6.4 Apoyo cognitivo y de salud mental: apoyo cognitivo y psicológico adaptado al paciente
La actividad física también muestra beneficios en el funcionamiento cognitivo ( 184 ). Además, complementar la actividad física con estímulos cognitivos, como ejercicios de doble tarea, mostró mejoras importantes en los resultados cognitivos ( 185 ). Sin embargo, se necesitan intervenciones más específicas y enfocadas. Se informa que la estimulación cognitiva, definida como una intervención diseñada para alentar la participación en tareas destinadas a mejorar el funcionamiento social y cognitivo, es efectiva ( 186 ). Estas intervenciones también se basan en las actividades de la vida diaria (AVD), con el fin de mejorar la aplicabilidad de las habilidades entrenadas en el contexto de la vida cotidiana ( 186 ). Con respecto al bienestar y la ansiedad, las actividades asistidas por animales (especialmente perros) son muy efectivas, con una mejora percibida en la calidad de vida, el estado emocional y las emociones positivas ( 186 ). Finalmente, la realidad virtual y aumentada son una intervención prometedora para contrarrestar la fragilidad ( 187 , 188 ).
6.5 Seguimiento y retroalimentación
Resulta que las intervenciones para contrarrestar la fragilidad son complejas. Especialmente en las primeras etapas, la adherencia al programa de intervención individualizado puede verse comprometida por las numerosas dificultades que encuentra la persona ( 189 ). Sin embargo, siguiendo la Teoría de las Etapas del Cambio ( 190 ), incluso después de pasar las etapas iniciales del nuevo comportamiento (en este caso, el programa de intervención individualizado), la llamada etapa de «mantenimiento» se ve amenazada por la ausencia de resultados tangibles e inmediatos, a diferencia de la etapa inicial, donde estos sí están presentes ( 191 ). En esta perspectiva, el monitoreo (incluido el automonitoreo) y la retroalimentación son fundamentales.
6.6 Monitoreo y ajustes en tiempo real
Durante el ejercicio, la monitorización en tiempo real es fundamental. Se trata, ante todo, de una cuestión de seguridad, especialmente en personas con fragilidad avanzada. Por ello, es importante que la actividad se realice en presencia de personal capacitado para intervenir en caso de problemas de salud repentinos. Sin embargo, esto no es posible cuando la persona realiza el ejercicio de forma independiente en su domicilio. Si bien es crucial educar a las personas y a sus cuidadores en el reconocimiento temprano de los signos y síntomas de los problemas de salud relacionados con el ejercicio ( 192 ), las tecnologías de la información y la comunicación (TIC) son muy útiles. En particular, la actividad física parece beneficiarse especialmente de un componente TIC en la intervención, tanto en la monitorización ( 180 ) como en su ejecución ( 193 ), lo que permite una capacidad de ajustes más inmediata cuando es necesario. La adopción de las TIC permite monitorizar el progreso con gran precisión, además de la posibilidad de recopilar datos útiles para adaptar la intervención a la persona. No obstante, estos datos también pueden representar una «biorretroalimentación» para la persona, permitiendo adaptar las actividades en tiempo real.
6.7 Educación y apoyo: educación y empoderamiento del paciente
La educación es fundamental en el abordaje de la fragilidad y debería incluirse en los programas de formación del personal sanitario implicado ( 194 ). Existe evidencia de que el estilo de vida está estrechamente relacionado con la FS ( 195 ), por lo que a menudo requiere su modificación. Los cambios de comportamiento requeridos suelen ser numerosos y complejos para la persona, y este aspecto debería considerarse en la planificación anticipada de la atención ( 196 ). Sin embargo, aunque la educación del paciente es una parte integral y fundamental de la planificación anticipada de la atención, existe evidencia de que todavía se subestima ( 197 ). En particular, el empoderamiento del paciente es muy eficaz, ya que puede mejorar la comprensión del paciente, abordar los presuntos obstáculos y desarrollar la confianza del paciente y sus habilidades de comunicación ( 198 ).
6.8 Educar a los pacientes para gestionar mejor la FS
Como podemos ver, la educación aún juega un papel fundamental en el manejo de la fragilidad. En este contexto, existe evidencia de que es fundamental para construir un cuerpo de conocimiento sobre el tema y contribuye a la adquisición de confianza, habilidades y capacidades que conducen a la adopción de un estilo de vida saludable ( 199 ). Una revisión sistemática reciente mostró que las áreas educativas de intervención se centran principalmente en el empoderamiento, el autocuidado y la promoción de la salud ( 199 ). Sin embargo, las conductas de autogestión, especialmente aquellas relacionadas con la actividad física, como el mantenimiento del peso corporal y el aumento del ejercicio físico frecuente, se asocian con una mejora de la condición de fragilidad ( 200 ).
6.9 Empoderamiento a través de la tecnología: uso de la tecnología para apoyar la autonomía del paciente
En primer lugar, sin duda existe un papel para las versiones en línea y basadas en computadora de las intervenciones de educación sobre la fragilidad, dados los avances actuales en la tecnología digital ( 199 ). Las TIC no solo brindan la capacidad de monitorear a la persona en el hogar, sino también de comunicarse con ella en tiempo real y de manera oportuna. En esta perspectiva, es posible programar y realizar visitas de telemedicina y teleenfermería; recopilar información relevante sobre el estado de fragilidad a través de la domótica y sensores (p. ej., pérdida de peso, velocidad de la marcha); y monitorear el ejercicio (incluido el suministro de retroalimentación en vivo) ( 201 ). La Figura 3 sintetiza los elementos clave de las estrategias dietéticas, de ejercicio y cognitivas, junto con sus procesos de evaluación, modificaciones y seguimiento, ofreciendo una guía práctica para la implementación en la práctica clínica.

7 Conclusión y tendencias futuras
Integrar intervenciones personalizadas en el manejo del síndrome de fatiga crónica (SF) en pacientes con enfermedades crónicas, especialmente en aquellos con deterioro cognitivo, es esencial para mejorar los resultados de los pacientes. Sin embargo, las estrategias actuales enfrentan limitaciones significativas. En primer lugar, persiste un subdiagnóstico frecuente del deterioro cognitivo, lo que resulta en una planificación inadecuada de la atención. No obstante, la falta de protocolos estandarizados, la insuficiencia de recursos, como personal especializado y herramientas tecnológicas, y el apoyo inadecuado para los cuidadores con sobrecarga de trabajo dificultan aún más la adopción generalizada de la atención individualizada. Además, surgen desafíos al abordar los diversos antecedentes culturales, sociales y socioeconómicos de los pacientes, la capacitación limitada de los profesionales de la salud para reconocer y manejar el SF y el deterioro cognitivo, las consideraciones éticas y legales relacionadas con la autonomía y el consentimiento del paciente, las limitaciones financieras y las barreras tecnológicas entre pacientes y cuidadores.
Para abordar estos desafíos, la investigación futura debe centrarse en varias áreas clave. Mejorar el diagnóstico del deterioro cognitivo mediante herramientas de cribado y evaluación más eficaces permitirá una planificación más precisa de la atención. El desarrollo de directrices estandarizadas para intervenciones más personalizadas es esencial para unificar las prácticas en diferentes entornos. Mejorar la accesibilidad a los recursos, incluyendo personal especializado y herramientas tecnológicas, y ofrecer programas integrales de apoyo a los cuidadores ayudará a aliviar su carga. Además, garantizar que las intervenciones sean culturalmente competentes y adaptables servirá mejor a pacientes de diversos orígenes. La validación de innovaciones tecnológicas, como los sistemas de monitorización basados en IA y los dispositivos portátiles, puede ofrecer nuevas oportunidades para la atención al paciente. Promover la colaboración interdisciplinaria entre los profesionales sanitarios fomentará enfoques holísticos en la gestión del paciente. Involucrar activamente a los pacientes en su propio cuidado mediante la educación y la toma de decisiones compartida mejora la adherencia a la medicación y los resultados clínicos relacionados, especialmente en pacientes tratados con polifarmacoterapia. Integrar los recursos comunitarios puede proporcionar apoyo adicional, mientras que promover reformas en las políticas sanitarias puede abordar problemas sistémicos como la financiación y la asignación de recursos. Empoderar a los pacientes mediante la educación y estrategias de autogestión puede mejorar significativamente su calidad de vida y promover la autonomía en esta población vulnerable. Por lo tanto, la investigación y la innovación continuas son fundamentales para desarrollar estrategias eficaces, escalables y adaptables que satisfagan las necesidades de las diversas poblaciones de pacientes.
