Masanori Aikawa1,2,3*†Abhijeet R. Sonawane1,2†Sarvesh Chelvanambi1†Takaharu Asano1Arda Halu3Joan T. Matamalas1Sasha A. Singh1Shizuka Uchida4Elena Aikawa1,2Alex Arenas5Jean-Luc Balligand6Chiara Giannarelli7Calum A. MacRae8
Abstract
A pesar del desarrollo de fármacos potentes para los factores de riesgo modificables y los avances en la investigación biomédica mecanicista, las enfermedades cardiovasculares (ECV) siguen siendo la principal causa de muerte a nivel mundial, lo que evidencia la necesidad de terapias nuevas y más eficaces. Un desafío fundamental reside en la heterogeneidad a múltiples niveles que caracteriza a las ECV: desde sus complejos mecanismos patobiológicos a nivel molecular y celular, hasta sus manifestaciones clínicas y respuestas terapéuticas a nivel individual y poblacional. Esta variabilidad surge de las características genómicas y exposómicas únicas de cada individuo, lo que subraya la necesidad de enfoques de precisión. Otros desafíos clave incluyen los largos tiempos de desarrollo, los altos costos y las bajas tasas de éxito en la búsqueda de fármacos, a menudo agravados por la escasa accesibilidad de nuevos objetivos terapéuticos. En este artículo, exploramos cómo estos desafíos han impulsado nuevas tecnologías que prometen mejorar los resultados de salud a nivel mundial mediante un enfoque integral de medicina de precisión. La clave de esta transformación reside en el uso de la biología de sistemas y la medicina de redes, mediante las cuales la aplicación de la inteligencia artificial al análisis de grandes volúmenes de datos, desde información clínica hasta datos multiómicos imparciales (como genómica, transcriptómica, proteómica y metabolómica), permite dilucidar los mecanismos de las enfermedades, obtener nuevos biomarcadores para su progresión e identificar posibles dianas terapéuticas. Paralelamente, nuevos enfoques computacionales están contribuyendo a traducir estos descubrimientos en nuevas terapias y a superar las barreras de acceso a los fármacos. La transición hacia un paradigma de investigación e innovación de precisión en medicina cardiovascular requerirá una mayor colaboración interdisciplinaria, la implementación de la ciencia de datos en cada etapa y nuevas alianzas entre la academia y la industria. El liderazgo político global también es esencial para implementar modelos adecuados de financiación y organización de la investigación, infraestructuras y políticas de datos, regulaciones de medicamentos y políticas de acceso equitativo para los pacientes.
- La heterogeneidad en la compleja patobiología y presentación de las enfermedades cardiovasculares (ECV), la principal causa de muerte a nivel mundial limita la eficacia de las terapias convencionales “únicas para todos”.
- Los enfoques de sistemas integrativos, que incluyen análisis ómicos imparciales (especialmente proteómica y análisis de células individuales), bioinformática y ciencia de redes, ofrecen ahora el potencial de un paradigma de innovación en medicina de precisión para abordar las ECV.
- La inteligencia artificial (IA) está impulsando nuevas oportunidades en la elaboración de perfiles de pacientes y en el diseño y desarrollo de fármacos de precisión computacional.
- Diversas terapias de ARN en desarrollo ofrecen la promesa de una terapia de precisión eficaz y podrían ayudar a abordar los obstáculos convencionales del desarrollo de fármacos, como el coste y el tiempo.
- La colaboración interdisciplinaria e intersectorial a lo largo de todo el proceso de investigación e innovación, respaldada por el liderazgo de las políticas de salud a nivel mundial, es necesaria para implementar un paradigma de medicina cardiovascular de precisión.
Introducción: los retos son oportunidades
“Cuanto mayor es el obstáculo, mayor es la gloria al superarlo.” Molière
Los desafíos representan oportunidades. Los problemas clínicos y las preguntas sin respuesta en medicina cardiovascular han impulsado enormes esfuerzos globales para comprender las causas subyacentes de las enfermedades cardiovasculares (ECV) ( 1-10 ). Estas necesidades también han propiciado una serie de innovaciones tecnológicas de gran valor. La investigación cardiovascular, en su forma actual, comenzó hace más de un siglo (11-14 ) . En las últimas décadas, nuestra comunidad se ha centrado en educar al público sobre las modificaciones del estilo de vida y las intervenciones dietéticas para prevenir o controlar las ECV ( 15 ) . El desarrollo exitoso de medicamentos eficaces, como las estatinas y los más recientes inhibidores de la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), ha contribuido significativamente a reducir la incidencia de ciertas afecciones cardiovasculares ( 16-19 ) . Además , los avances en ciencia básica han identificado diversas moléculas y vías, como la interleucina (IL)-1β y la IL-6, que ponen de relieve el papel de la inflamación más allá de los factores de riesgo cardiovascular modificables tradicionales ( 20 ).
A pesar de estos esfuerzos y avances notables, persiste un riesgo sustancial para muchos pacientes ( 17 , 21-23 ). Si bien algunas terapias, como los agonistas del receptor del péptido similar al glucagón-1 (GLP-1R), pueden reducir la carga de las enfermedades crónicas ( 24 , 25 ) , aún existe una necesidad imperiosa de identificar estrategias adicionales para abordar la compleja interacción entre estas enfermedades. Aunque el tratamiento óptimo de la diabetes tipo 2 ofrece el beneficio de reducir el exceso de riesgo de mortalidad asociado a las enfermedades cardiovasculares (ECV), este efecto solo se observó en pacientes sin diagnóstico previo de ECV. Esto sugiere una sólida justificación para perfeccionar las estrategias terapéuticas para combatir enfermedades complejas ( 26 ). De 2010 a 2019, el número de muertes causadas por hipertensión aumentó entre los adultos de 35 a 64 años en el 86,2 % de los condados de Estados Unidos ( 27 ). Se prevé que la carga de las ECV aumente en las próximas décadas. Se prevé que el número de pacientes ancianos con estenosis aórtica calcificada, una complicación importante de la enfermedad renal crónica, se duplique con creces para 2050 en Estados Unidos y Europa ( 28 ). En general, las enfermedades cardiovasculares siguen siendo la principal causa de muerte a nivel mundial ( 17 ) , con 19 millones de fallecimientos en 2020. Esta cifra aumentó un 18,7 % en la última década y probablemente ascenderá a 26 millones para 2030 ( 28-30 ).
Los problemas complejos requieren soluciones innovadoras. Uno de los desafíos fundamentales que complica el tratamiento de las enfermedades cardiovasculares (ECV) es la heterogeneidad de sus complejos mecanismos patobiológicos y manifestaciones clínicas. Los datos multiómicos, multimodales y de alto rendimiento han inaugurado una nueva era de macrodatos en la investigación de las ECV, donde cada tipo de dato añade una nueva capa de complejidad al desafío existente de identificar nuevos mecanismos y biomarcadores ( 31 ). Abordar estos numerosos desafíos es necesario para avanzar en la medicina de precisión de las ECV.
En este artículo, exploramos cómo los principales desafíos en medicina cardiovascular han inspirado nuevas tecnologías que prometen mejorar los resultados de salud a nivel mundial. Ilustramos cómo la biología de sistemas, la medicina de redes y la inteligencia artificial (IA), respaldadas por innovaciones tecnológicas en ómicas, proporcionan información biológica valiosa sobre la complejidad de la heterogeneidad de las enfermedades, lo que fomenta nuevos descubrimientos y objetivos para intervenciones de medicina de precisión. A continuación, analizamos el descubrimiento computacional de fármacos y nuevas clases de medicamentos que podrían superar las limitaciones de los fármacos convencionales de molécula pequeña. Finalmente, describimos las acciones interdisciplinarias e intersectoriales, sustentadas en un liderazgo político global, necesarias para implementar un paradigma de innovación basado en la precisión en medicina cardiovascular a nivel mundial.
Desafíos actuales en la investigación de enfermedades cardiovasculares
Biología de la heterogeneidad en las ECV
La heterogeneidad de las enfermedades cardiovasculares (ECV) se manifiesta en la diversidad observada en las presentaciones clínicas, las causas subyacentes y las respuestas a los tratamientos. Esta variabilidad surge de las características únicas de cada individuo a nivel genómico (p. ej., polimorfismos de un solo nucleótido) y exposómico (p. ej., contaminación atmosférica o pesticidas) ( 32-37 ) ( Figura 1A ), lo que subraya la necesidad de descubrir nuevos mecanismos y dianas farmacológicas para avanzar en la medicina cardiovascular de precisión ( 38). Los enfoques multiómicos han proporcionado explicaciones más detalladas sobre cómo dichas firmas genómicas o exposómicas contribuyen al desarrollo de enfermedades complejas (32-36 , 39 ) . Evidencia reciente sugiere que la patobiología humana también es heterogénea en múltiples niveles, desde las respuestas celulares hasta los mecanismos de la enfermedad y las características clínicas ( Figura 1A ). Dicha heterogeneidad plantea importantes desafíos que han dificultado nuestra capacidad para comprender a fondo los mecanismos de las enfermedades y desarrollar terapias más eficaces para enfermedades humanas complejas, que han demostrado ser aún más intrincadamente mecanicistas de lo que se pensaba tradicionalmente ( 35 , 38 , 40-44 ). Entre 1954 y 1977, los hallazgos epidemiológicos del renombrado Estudio del Corazón de Framingham establecieron factores de riesgo para la cardiopatía coronaria y el accidente cerebrovascular, con especial énfasis en la dislipidemia y la hipertensión ( 45-47 ) . Cabe destacar que el colesterol LDL elevado se convirtió en un objetivo viable para reducir la incidencia de eventos cardiovasculares, principalmente mediante el tratamiento con estatinas. A pesar de la eficacia de las estatinas para reducir los niveles de colesterol LDL y la incidencia de eventos cardiovasculares mayores, persiste un riesgo residual significativo ( 48 ).
Figura 1
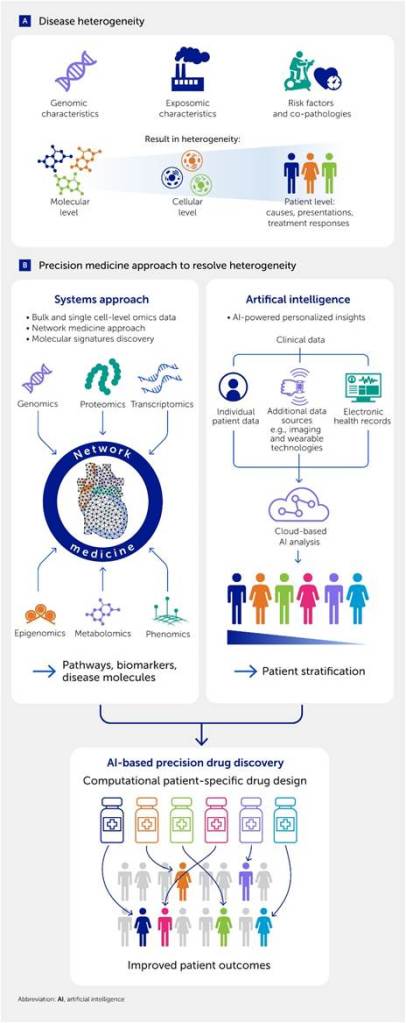
Figura 1. Medicina cardiovascular de precisión como solución a la heterogeneidad en las enfermedades cardiovasculares (ECV). (A) La heterogeneidad en las ECV surge debido a diversos factores y se manifiesta en múltiples niveles. (B) Un enfoque sistémico integral conduce a la medicina de precisión. Por un lado, la integración de datos multiómicos mediante técnicas de medicina de redes revela vías moleculares y biomarcadores de la enfermedad. Simultáneamente, un enfoque basado en inteligencia artificial (IA) utiliza datos clínicos para ofrecer resultados traslacionales, como la estratificación de pacientes y el desarrollo de fármacos y terapias de precisión. En conjunto, estos enfoques tienen el potencial de mejorar significativamente los resultados para los pacientes.
La evidencia clínica, epidemiológica y genética también señala la presencia de heterogeneidad fenotípica en las enfermedades cardiovasculares (ECV), que abarcan afecciones como el infarto de miocardio, la angina de pecho, la miocardiopatía hipertrófica y la insuficiencia cardíaca ( 49-54 ) . Por ejemplo, las mutaciones genómicas en el citocromo P450 2C (CYP2C9), el transportador de aniones de la familia 1B1 (SLCO1B1) y el miembro 2 de la superfamilia G del casete de unión a ATP (ABCG2) influyen en la respuesta a fármacos como las estatinas ( 55 , 56 ). Además, la interacción de patologías puede provocar ECV, incluso en pacientes con predisposición a la trombosis venosa o arterial; en algunos casos, se ha observado incluso una agregación familiar que da lugar a estados de hipercoagulabilidad hereditarios. Los modificadores genéticos, ambientales y fenotípicos también pueden contribuir a este grupo de afecciones, lo que dificulta especialmente el diagnóstico y el tratamiento de estos trastornos ( 57 ). Muchas vías que contribuyen a las enfermedades humanas influyen en la gravedad de la enfermedad al interactuar dentro de una red biológica extensa y compleja de genes, proteínas y vías de señalización.
En paralelo con la evidencia clínica, los hallazgos de conjuntos de datos de secuenciación de ARN de células individuales han sugerido que cada tipo celular asociado con la ECV, como los macrófagos, representa una población heterogénea ( 58-66 ). El equilibrio entre subconjuntos de células inmunitarias (p. ej., subpoblaciones de macrófagos proinflamatorios frente a antiinflamatorios) en un microambiente local, como la placa aterosclerótica, puede determinar el riesgo de progresión de la enfermedad o la aparición de complicaciones clínicas (p. ej., infarto de miocardio) ( 67 , 68 ) . A medida que surgen nuevas tecnologías capaces de realizar un cribado imparcial para el descubrimiento de dianas terapéuticas (p. ej., proteómica plasmática de muestras clínicas y secuenciación de ARN de células individuales en tejidos cardiovasculares o sangre), los conjuntos de datos generados posteriormente se vuelven más grandes y complejos ( 69 , 70 ). Para identificar nuevas dianas prometedoras a partir de grandes conjuntos de datos que analizan factores complejos, debemos emplear plataformas analíticas capaces de procesar la ingente cantidad de datos generados ( 71 ).
Mecanismos patobiológicos complejos de las ECV
Las enfermedades cardiovasculares (ECV) son entidades complejas moldeadas por múltiples factores. Cada vez resulta más evidente que centrarse únicamente en una molécula o vía específica no permite comprender de forma integral las complejas interacciones e interdependencias entre las moléculas y vías que actúan dentro de un sistema biológico más amplio. A pesar de su diversidad fenotípica, las ECV presentan fisiopatologías subyacentes comunes. Esto se observa en afecciones como la aterosclerosis, compartida por enfermedades vasculares como la enfermedad arterial coronaria (EAC) y la enfermedad arterial periférica (EAP). Sin embargo, la progresión de la aterosclerosis involucra diferentes componentes del sistema inmunitario. Las ECV —que incluyen insuficiencia cardíaca, arritmias, hipertensión, miocardiopatías y trombosis/embolia— pueden presentar diversos grados de mecanismos patobiológicos complejos que involucran factores como la respuesta inmunitaria, el metabolismo lipídico, la activación neurohormonal, variaciones estructurales, la modulación del sistema nervioso simpático y la disfunción endotelial ( 72 ).
Junto con los factores ambientales y del estilo de vida, la heterogeneidad genética también desempeña un papel importante en el fenotipo de las enfermedades complejas. Las tecnologías modernas, como la secuenciación del genoma completo, del exoma completo y la secuenciación dirigida, proporcionan información sobre la secuencia de las bases del ADN, lo que permite comprender la variación genética. Tanto la heterogeneidad alélica como la de locus pueden contribuir al desarrollo de enfermedades cardiovasculares (ECV) ( 43 ). Los grandes biobancos y las bases de datos de estudios genéticos de múltiples ancestros desempeñan actualmente un papel crucial en el avance de nuestra comprensión de las ECV y, por lo tanto, contribuyen al enfoque de la medicina de precisión ( 73 , 74 ). Si bien el enfoque tradicional de la biología lineal ha sido valioso para analizar mecanismos individuales e impulsar descubrimientos críticos, no permite una comprensión integral de la patobiología de las enfermedades complejas ( 75 ). La investigación preclínica se basa en numerosos estudios con líneas celulares y cepas de ratones endogámicos ( 76 , 77 ). La disponibilidad de estas herramientas ha permitido muchos avances mecanicistas, pero no ha logrado captar la heterogeneidad observada en la población de pacientes. El uso de modelos animales grandes y ratones no consanguíneos podría ser una consideración importante para un enfoque de biología de sistemas. Además, el uso de células primarias humanas para capturar la heterogeneidad celular ( 68 ) podría aportar nuevos conocimientos sobre los factores que rigen la inflamación y la progresión de la enfermedad. Las tecnologías de microórganos en chip podrían utilizarse para imitar las complejas interacciones interorgánicas que regulan las enfermedades cardiovasculares ( 78 , 79 ). Estos enfoques podrían reforzarse mediante la utilización de células madre pluripotentes inducidas (iPSC) derivadas de pacientes, reprogramadas en tipos celulares patológicos (p. ej., células endoteliales, cardiomiocitos y macrófagos), que a su vez podrían utilizarse para realizar ensayos clínicos en chip para la selección de fármacos específicos para cada paciente ( 80 , 81 ). El desarrollo de nuevos tratamientos basados en una visión holística de un sistema biológico complejo requiere una transición hacia un enfoque más integrado, que incorpore datos ómicos imparciales a múltiples niveles (p. ej., epigenético, transcriptómico y proteómico) de las mismas muestras. La identificación y la comprensión de los procesos subyacentes que rigen los resultados clínicos son fundamentales para el éxito de la medicina de precisión.
Largo tiempo de navegación, altos costos y bajas tasas de éxito en el desarrollo de fármacos
Otros desafíos importantes en medicina cardiovascular incluyen los plazos y costos del descubrimiento de dianas terapéuticas y el desarrollo de fármacos. Los tiempos estimados de desarrollo de nuevos fármacos, desde el descubrimiento de la diana hasta su lanzamiento, oscilan entre 5 y 20 años, con un promedio de 9,1 años para medicamentos innovadores (p. ej., fármacos pioneros) ( 82 , 83 ). Sin embargo, los tiempos de desarrollo de terapias dirigidas al ARN suelen ser más cortos ( 82 , 84 , 85 ). Durante la pandemia de COVID-19, los enfoques de ciencia abierta que impulsaron el intercambio de datos e ideas entre instituciones académicas, la industria farmacéutica e instituciones gubernamentales contribuyeron a acelerar el desarrollo y la implementación de terapias de ARN ( 86 , 87 ).
Las bajas tasas de éxito de los nuevos fármacos en el desarrollo clínico representan otro obstáculo importante. Aproximadamente el 90 % de los fármacos fracasan entre su entrada en los ensayos de fase I y la aprobación regulatoria ( 88 , 89 ). Si se incluyen los candidatos a fármacos preclínicos, las tasas de éxito caen por debajo del 10 %. La causa más común de fracaso es la falta de los efectos esperados, con la excepción de los trastornos genéticos, seguida de la toxicidad/efectos secundarios, parámetros farmacocinéticos deficientes y estrategias de desarrollo clínico deficientes en general ( 88-91 ) . Por ejemplo, la cardiotoxicidad oculta de un fármaco puede llevar a la interrupción de los ensayos clínicos, así como a la retirada del fármaco tras su aprobación ( 92 ) . El enfoque convencional de descubrimiento de fármacos, que se centra en un único factor causal, también muestra una eficacia limitada en la búsqueda de nuevos fármacos para enfermedades humanas complejas, ya que estas involucran múltiples vías moleculares y patologías superpuestas. Esto se debe, en parte, a que este enfoque se basa en una hipótesis simplificada para la diana farmacológica. Estas hipótesis simplistas suelen probarse con líneas celulares monoclonales y ratones endogámicos, modelos que no reproducen completamente la heterogeneidad de las enfermedades crónicas complejas en humanos. El descubrimiento de fármacos basado en el fenotipo, a diferencia de las estrategias basadas en dianas terapéuticas, puede abordar enfermedades cuyos mecanismos aún no se comprenden del todo y se ha utilizado ampliamente en la industria farmacéutica ( 93 ). La predicción, mediante análisis de redes, del impacto potencial de cada diana candidata en la enfermedad humana también puede limitar, en cierta medida, el fracaso de nuevos fármacos en la fase de desarrollo clínico, debido, en parte, a su capacidad para predecir efectos adversos no deseados ( 94-96 ). Las ventajas de este enfoque sistémico integral para el descubrimiento de fármacos reducen , en última instancia, los costes generales de desarrollo y dan como resultado un agente terapéutico más eficaz y seguro. Estos enfoques pueden predecir los perfiles de toxicidad de los fármacos, lo que a su vez evita la selección de compuestos que podrían fracasar en fases posteriores del desarrollo debido a efectos nocivos ( 97 , 98 ).
Tras el desarrollo de numerosos fármacos dirigidos a proteínas causales previamente identificadas, la necesidad de evaluar la capacidad potencial de una nueva diana para ser modulada positiva o negativamente por tratamientos, lo que coloquialmente se conoce como «farmacocinabilidad», sigue siendo un desafío clave en el desarrollo de nuevos fármacos ( 99 , 100 ). Afortunadamente, los avances tecnológicos han aportado soluciones a este desafío. La acumulación de datos biológicos y químicos y la rápida evolución de la computación de alto rendimiento han permitido el desarrollo de diversas estrategias computacionales, incluida la IA, y han contribuido al diseño de nuevos compuestos eficaces o a la predicción de los posibles efectos de fármacos existentes mediante cribado fenotípico. El uso de estas nuevas tecnologías y enfoques computacionales novedosos en el descubrimiento de fármacos ha abierto la posibilidad de convertir dianas tradicionalmente inaccesibles en dianas farmacológicas viables ( 101-103 ). Las nuevas plataformas, en particular las centradas en terapias dirigidas al ARN, también ofrecen métodos precisos para modular dianas previamente inaccesibles , a la vez que reducen los plazos y los costes de desarrollo ( 84 , 104-106 ) .
Medicina cardiovascular de precisión: a través de la biología de sistemas
La esencia de la solución a estos desafíos reside en el concepto de medicina de precisión ( Figura 1 ). Los Institutos Nacionales de la Salud (NIH) y la Administración de Alimentos y Medicamentos (FDA) de Estados Unidos definen la medicina de precisión como un enfoque innovador que considera las diferencias individuales entre los pacientes. El objetivo es utilizar los tratamientos adecuados en los pacientes adecuados y en el momento adecuado. Cada individuo posee características genómicas únicas, experimenta exposiciones distintas (es decir, factores ambientales) y presenta diversas combinaciones de factores de riesgo tradicionales (por ejemplo, dislipidemia, hipertensión, diabetes, estilo de vida, dieta y sexo). Además, los mismos estímulos y terapias pueden provocar respuestas heterogéneas en diferentes individuos. Considerar las características específicas de cada paciente para personalizar la atención médica y las intervenciones con el fin de optimizar la eficacia del tratamiento y minimizar los efectos adversos es clave para la medicina de precisión ( 107 ). Esto requiere un enfoque que permita la caracterización molecular integral, fomente la integración para comprender las interacciones complejas entre diversos componentes y facilite el desarrollo de modelos predictivos para enfermedades y procesos biológicos. La biología de sistemas constituye un marco valioso para alcanzar estos objetivos: es un campo interdisciplinario cuyo principio fundamental es que el comportamiento de un sistema biológico en su conjunto surge de la compleja interacción entre sus partes constituyentes (lo que da lugar a propiedades emergentes del sistema), las cuales no pueden comprenderse completamente estudiándolas individualmente ( 108 , 109 ). A continuación, analizamos diferentes aspectos de la biología de sistemas y posibles soluciones a los desafíos en la investigación de las enfermedades cardiovasculares.
Un enfoque sistémico para desentrañar la biología de la heterogeneidad
Como se ha comentado, las enfermedades cardiovasculares (ECV) surgen de diversos factores que afectan a complejas redes moleculares. Estos complejos mecanismos implican que un enfoque reduccionista tradicional, que consiste en explorar una única causa de la enfermedad en la población general, probar una hipótesis lineal centrada en un único objetivo y desarrollar un medicamento universal, resulta excesivamente simplista ( 75 ) y puede explicar la menor eficacia observada en un grupo considerable de pacientes para los que se ha desarrollado el fármaco aprobado ( 110 ). Este importante desafío ha impulsado nuestros esfuerzos por desarrollar un enfoque sistémico más holístico e integrador, que incluya análisis ómicos imparciales, bioinformática y ciencia de redes, para establecer la medicina de precisión ( Figura 1B ) ( 38 , 40 , 111 , 112 ). La generación de grandes volúmenes de datos biomédicos, o «big data», que abarcan desde información clínica en historias clínicas electrónicas (HCE) hasta la medición molecular de analitos mediante diferentes plataformas ómicas (p. ej., genómica, transcriptómica, proteómica y metabolómica), ha impulsado la necesidad de marcos analíticos que permitan investigar de forma integral la patobiología de las enfermedades. El estudio de las enfermedades cardiovasculares (ECV) mediante múltiples modalidades ómicas también requiere un enfoque sistémico, debido a la participación no solo de tejidos complejos, como el corazón, el sistema vascular y las válvulas, sino también de diversos mecanismos subyacentes comunes —denominados endofenotipos—, entre los que se incluyen la inflamación, la inmunidad, la trombosis, la fibrosis y la calcificación.
Un enfoque sistémico permite la construcción de modelos integrados mediante el análisis simultáneo de entidades de diferentes capas ómicas (p. ej., genes, proteínas y metabolitos) implicadas en cada enfermedad ( Figura 1B ). La combinación de diferentes unidades interactuantes (p. ej., genes y metabolitos) en redes permite identificar componentes moleculares clave y la naturaleza de sus interrelaciones (p. ej., regulación o coexpresión) ( 112 ). De forma similar, la IA y el aprendizaje automático pueden identificar las combinaciones clave de características genómicas predictivas de la progresión de la enfermedad ( Figura 1B ). Así, un enfoque sistémico permite la identificación simultánea de biomarcadores para la progresión de la enfermedad y posibles dianas farmacológicas. Esto incluye la evaluación de los efectos fuera de la diana y los mecanismos de acción, lo que mejora el valor traslacional de estas investigaciones. En las últimas dos décadas, la investigación basada en sistemas se ha aplicado con éxito a sistemas celulares para revelar una amplia variedad de funciones biológicas emergentes. Este enfoque ha complementado y abordado las limitaciones del paradigma reduccionista predominante en biomedicina, especialmente tras la afluencia de datos de alto rendimiento durante la era posgenómica ( 109 , 113-116 ). La incorporación de datos clínicos y la etiología de la enfermedad mediante IA y un enfoque de sistemas avanzados también permite una mejor estratificación de los pacientes en grupos según su respuesta a los fármacos, un principio fundamental de la medicina de precisión ( Figura 1B ).
Medicina de redes para la integración de datos multiómicos
Las redes constituyen la piedra angular del enfoque sistémico en biomedicina ( 109 , 117 ) y se han utilizado para analizar la gran cantidad de datos ómicos generados en las últimas décadas. Debido a su naturaleza multifactorial y a la complejidad de las enfermedades cardiovasculares (ECV), estas se han beneficiado enormemente de la aplicación de la medicina de sistemas y de redes ( 38 , 118 , 119 ). Actualmente, existe una amplia gama de enfoques basados en redes que se pueden aplicar fácilmente a un gran número de datos moleculares, de interacción y ontológicos de alto rendimiento disponibles públicamente. Estos enfoques son fundamentales para inferir moléculas clave, subredes y vías relacionadas con las ECV, proporcionando información valiosa que puede ayudar a identificar mejor nuevas dianas farmacológicas para ensayos preclínicos y clínicos ( 120 ) . Se han desarrollado e implementado métodos de redes para la regulación génica ( 121-125 ) , las interacciones proteína-proteína ( 126-131 ) y la interacción metabólica ( 132 ) con el fin de esclarecer los factores determinantes de las ECV . Se han estudiado los loci de riesgo genético identificados mediante estudios de asociación de genoma completo (GWAS) sobre características como el intervalo PR ( 133 ), la duración del QRS ( 134 ) y la fibrilación auricular ( 135 , 136 ) utilizando redes génicas. Las propiedades estructurales de las redes derivadas de datos ómicos ayudan a identificar fenotipos de ECV que se correlacionan con características de la red, como módulos funcionales en ECV ( 137 , 138 ), cardiopatía congénita ( 139 ), desarrollo cardíaco, hipertrofia e insuficiencia cardíaca ( 140 ). La medicina de redes ha ayudado a identificar genes candidatos para la enfermedad arterial coronaria (EAC) ( 121 , 141 ) o la ECV en general ( 142 ). El análisis de datos proteómicos con la ayuda de enfoques basados en redes ha revelado el impacto global de la activación de macrófagos en la enfermedad vascular ( 94 ) y ha ayudado a identificar los mecanismos subyacentes a la activación proinflamatoria de macrófagos desencadenada por el sulfato de indoxilo ( 95 ). De manera similar, el análisis de redes de vías de señalización nos permite estudiar la activación de macrófagos a través de PCSK9 ( 143 ) y en la enfermedad de injerto venoso ( 144 ), la calcificación vascular ( 145 ) y la valvulopatía reumática ( 146 ). El análisis simultáneo de la transcriptómica y la proteómica globales de la valvulopatía aórtica calcificada ha revelado asociaciones importantes con diversas enfermedades inflamatorias ( 129 ).Además, la integración horizontal de los mismos tipos de datos ómicos, medidos en diferentes condiciones o a partir de distintas fuentes, revela características correlacionadas en diversas capas. Por ejemplo, la integración de la proteómica de células intersticiales valvulares —ya sea en cultivos bidimensionales (2D) sobre superficie plana o en modelos tridimensionales (3D) sobre hidrogeles— con sus vesículas extracelulares mostró proteínas correlacionadas relevantes para la calcificación ( 147 ). La proteómica imparcial y la biología de sistemas de los aneurismas de aorta abdominal en modelos de ratón y pacientes revelaron posibles mecanismos novedosos ( 148 ). Los análisis ómicos integrativos también se han utilizado para estudiar la regulación de la presión arterial y la hipertensión ( 149 , 150 ). Paralelamente a los avances en el campo de la ómica, el uso de la farmacología de sistemas en las enfermedades cardiovasculares ha cobrado importancia ( 151-155 ) .
El enfoque sistémico para el descubrimiento de fármacos
La biología de sistemas —que incluye el cribado ómico imparcial, la bioinformática y el análisis de redes— ha facilitado el descubrimiento de biomarcadores diagnósticos y pronósticos para las ECV. Una de las principales ventajas de este enfoque es su capacidad para descubrir dianas prometedoras con mayor precisión en la predicción de la eficacia de los fármacos en pacientes ( Figura 2 ) ( 38 , 94 , 95 , 144 , 156-158 ). Este enfoque también nos ha permitido identificar posibles dianas con mayor probabilidad de relevancia clínica mediante la integración de diferentes conjuntos de datos ómicos y el análisis holístico de la enfermedad. Mediante un enfoque de biología de sistemas, podemos encontrar conexiones entre genes diana de fármacos y un resultado clínico potencialmente beneficioso ( 94 , 112 , 159 , 160 ) ( Figura 3 ). El análisis de las proteínas que han mostrado una tendencia común a cambiar dentro del interactoma humano predijo posibles reguladores de la activación de macrófagos ( 161 ). Las bases de datos de redes de proteínas también ayudan a identificar proteínas estrechamente asociadas a un nodo o diana terapéutica por «proximidad», las cuales pueden ser el objetivo de fármacos nuevos o reutilizados para interferir en la red de la enfermedad. La investigación de rutas metabólicas, genes clave ( 162 ) y módulos de red asociados a una posible diana farmacológica puede proporcionar información fundamental a los investigadores, permitiéndoles elegir métodos de cultivo celular, modelos animales o incluso la estratificación de pacientes adecuados en ensayos clínicos.
Figura 2
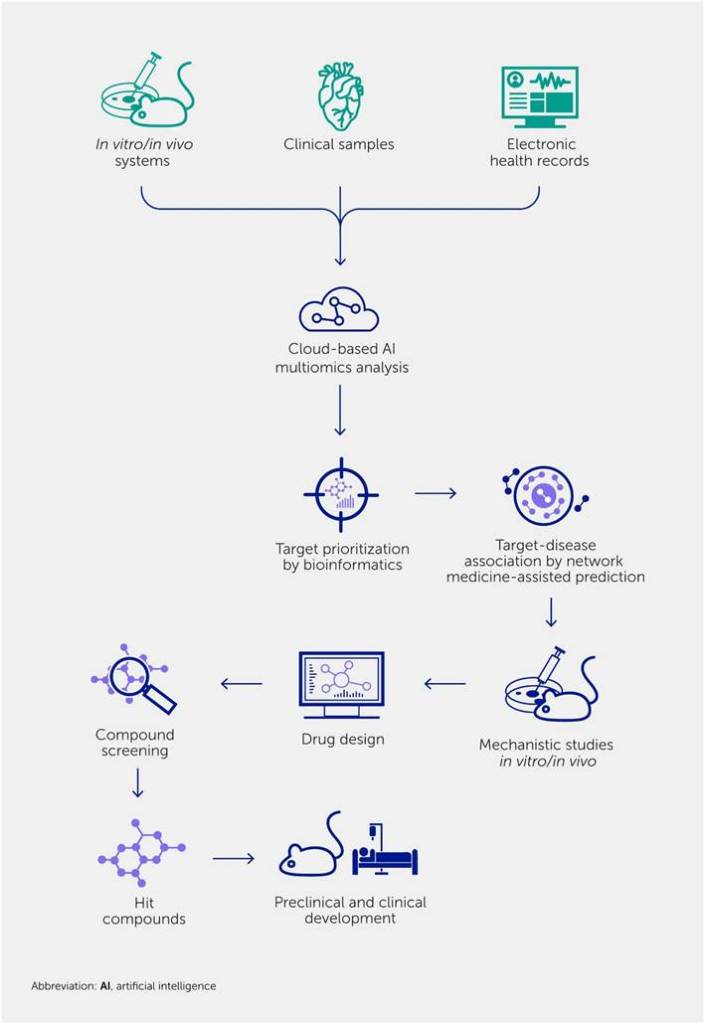
Figura 2. Un enfoque de sistemas multicapa para el descubrimiento de dianas terapéuticas y el desarrollo de fármacos. El enfoque reduccionista, basado en hipótesis, puede haber contribuido a las bajas tasas de éxito de las nuevas terapias basadas en el desarrollo clínico convencional, impulsado por la ciencia básica. Un enfoque de sistemas que incluya análisis ómicos imparciales, seguido de bioinformática para la priorización de dianas y la predicción del impacto clínico mediante medicina de redes, puede facilitar el proceso y aumentar la tasa de éxito en la identificación de nuevas dianas. Experimentos exhaustivos in vitro e in vivo respaldan los nuevos conceptos. Estos modelos permiten una implementación más temprana del diseño de fármacos que los modelos convencionales.
Figura 3

Figura 3. Predicción de la red del impacto clínico de los genes semilla en diversas enfermedades. La proximidad en la red de los genes semilla (en gris) se obtuvo a partir de análisis de genes o proteínas con expresión diferencial y diversos módulos de genes de enfermedades obtenidos mediante bases de datos. El valor p indica la significancia de la proximidad al módulo de enfermedad dado y a otros trastornos, en comparación con la probabilidad aleatoria.
Perspectivas futuras en el enfoque sistémico de la medicina cardiovascular
Una de las promesas más importantes de la medicina de sistemas es su enfoque en el paciente, más que en la enfermedad. Genes específicos y mutaciones individuales causantes de enfermedades pueden contribuir al fenotipo de enfermedad cardiovascular monogénica aparente de un individuo, como las miocardiopatías. Sin embargo, en algunos casos, los genes modificadores «aditivos» también pueden desempeñar un papel, lo que abre el camino a la medicina genética de precisión ( 163 ). Por ejemplo, un estudio previo tuvo como objetivo identificar los factores genéticos determinantes de la miocardiopatía dilatada, un diagnóstico de exclusión entre las miocardiopatías ( 164 ). Tras examinar 51 genes seleccionados, identificaron 19 que mostraban una alta evidencia, pero que solo podían explicar una minoría de los casos, lo que sugiere la necesidad de realizar más estudios para dilucidar el mecanismo de desarrollo de la enfermedad. Prevemos, no obstante, que los objetivos de la medicina de precisión se alcanzarán a gran escala en la próxima década. La implementación de enfoques basados en redes ha acelerado la investigación en ómicas unicelulares integrativas ( 165 ) y ómicas con resolución espacial ( 166 ), lo que permitirá comprender mejor la heterogeneidad en enfermedades complejas ( Figura 1 ) ( 38 , 111 , 167 ). En el contexto de las enfermedades cardiovasculares (ECV), identificar el grado de heterogeneidad de las poblaciones celulares en tejidos complejos como las placas ateroscleróticas, las válvulas aórticas calcificadas o el músculo cardíaco puede proporcionar información valiosa sobre los mecanismos patobiológicos. Por ejemplo, la secuenciación de ARN unicelular ha ayudado a identificar la diversidad del celuloma cardíaco ( 168 ). Los estudios que combinan la medicina de redes y los métodos de aprendizaje automático pueden utilizarse para perfeccionar nuestra comprensión y ayudar a identificar una representación más precisa de los fundamentos regulatorios de la heterogeneidad celular ( 68 , 103 , 129-131 , 147 , 169 ) . Además, la transferencia de conceptos fundamentales entre campos, como el nuevo marco de mecánica estadística propuesto para la biología unicelular ( 170 ), puede acelerar aún más los avances en medicina de sistemas. Como se ha comentado, la integración de datos ómicos multiescala también puede facilitar el desarrollo de terapias de precisión. Finalmente, los recientes avances en la armonización de las metodologías de biología de redes con el poder del aprendizaje automático ( 171-173 ) pronto se materializarán por completo, a medida que los datos moleculares de alta resolución converjan cada vez más con los datos clínicos y de historias clínicas electrónicas correspondientes de los individuos.
Tecnologías innovadoras para impulsar la medicina cardiovascular de precisión
La proteómica ocupa un lugar destacado en el universo multiómico de la investigación de las enfermedades cardiovasculares.
Las tecnologías ómicas, que ofrecen un análisis imparcial de múltiples genes y proteínas, han aumentado significativamente la probabilidad de identificar posibles dianas terapéuticas. Este proceso puede complementarse eficazmente con la proteómica dirigida y las proteoformas recientemente definidas resultantes de modificaciones postraduccionales. Este enfoque puede facilitar el descubrimiento exitoso de dianas y su traslación clínica ( Figura 4 ), como se analiza más adelante en esta sección.
Figura 4

Figura 4. El descubrimiento de dianas farmacológicas depende de múltiples estrategias ómicas. El cribado imparcial del epigenoma, transcriptoma y/o proteoma identifica dianas candidatas que pueden validarse mediante espectrometría de masas/proteómica dirigida. En última instancia, una proteoforma específica (forma modificada postraduccionalmente) de la proteína puede ser, en algunos casos, la mejor diana.
La alta demanda de descubrimiento continuo de nuevas dianas terapéuticas ha impulsado el desarrollo de plataformas globales e imparciales como la epigenómica, la transcriptómica, la proteómica y la metabolómica. En particular, la investigación de proteínas mediante espectrometría de masas se ha reconocido desde hace tiempo como un método prometedor para identificar nuevos biomarcadores y dianas terapéuticas para las ECV ( 174-176 ) . Hoy en día, la espectrometría de masas es fundamental no solo para el perfilado del proteoma ( 177 ), sino también para el del metaboloma ( 178 , 179 ). Al combinarse con otros enfoques ómicos, como la epigenómica ( 179 ) o la transcriptómica ( 180 ) , proporciona bases sólidas para la biología de sistemas y las estrategias de integración de datos multiómicos ( Figuras 1-4 ) ( 38 , 167 , 181 ).
Las proteínas son uno de los principales determinantes del fenotipo celular, lo que impulsa iniciativas como el Proyecto Proteoma Humano para facilitar la investigación traslacional y mejorar la salud humana en general ( 182 ). Se utilizan de forma sistemática enfoques proteómicos imparciales para identificar los factores moleculares que impulsan las enfermedades cardiovasculares, como la cardiopatía isquémica ( 183 ), los aneurismas de aorta abdominal ( 148 ) y la valvulopatía aórtica calcificada ( 129 ). En este último ejemplo, se emplearon la transcriptómica y la proteómica para distinguir las regiones fibróticas y calcificadas de las regiones sanas de las valvas de la válvula aórtica, pero se observó una correlación débil entre los transcritos y las proteínas cuantificadas ( 129 ). Estos hallazgos ponen de manifiesto que la abundancia de proteínas no necesariamente se corresponde con la abundancia de sus transcritos ( 184 , 185 ). Además, los tejidos están compuestos por diversos tipos celulares, de modo que los datos de «ARN y proteoma masivos» proporcionan señales promedio, lo que elimina la oportunidad de identificar posibles «subpoblaciones impulsoras de enfermedades». Si bien las tecnologías transcriptómicas de células individuales se han implementado con éxito para revelar el alcance de las subpoblaciones celulares y la heterogeneidad en los tejidos ( 144 ), la proteómica de células individuales ( 186 , 187 ) es una tecnología aún demasiado reciente, que requiere una amplia experiencia para lograr una implementación generalizada similar.
La proteómica dirigida ya se valora en el ámbito clínico, concretamente para monitorizar la cinética en estado estacionario de posibles dianas para la reducción del colesterol LDL, como la apolipoproteína B (APOB), la proteína de transferencia de ésteres de colesterol (CETP) y la PCSK9, en ensayos de resultados cardiovasculares ( 188-190 ) . Las innovaciones en las tecnologías de espectrometría de masas dirigida permitieron realizar estudios de cinética de trazadores en humanos que capturaron los complejos perfiles metabólicos de varias proteínas asociadas a las lipoproteínas de alta densidad (HDL), lo que respalda la idea de que las HDL constituyen una clase de lipoproteínas heterogénea, en consonancia con sus múltiples funciones ( 191 , 192 ). Estos hallazgos subrayan que los fármacos eficaces para las enfermedades cardiovasculares podrían requerir la focalización en una subpoblación con funciones específicas, en lugar de en la totalidad de una molécula o clase celular determinada.
Las proteínas se componen de diversas isoformas —conocidas como proteoformas— que pueden resultar de variantes genéticas, variantes de empalme del ARN mensajero (ARNm) y modificaciones postraduccionales; de estas, solo una forma puede ser la causante de la enfermedad en cuestión. Por lo tanto, la comunidad proteómica ha impulsado el Proyecto de Proteoformas Humanas, una iniciativa ambiciosa para generar un conjunto de referencia de proteoformas del genoma humano ( 193 ). Si bien la espectrometría de masas es una tecnología fundamental que respalda esta iniciativa, se trata, en esencia, de un estudio multiómico ( Figura 4 ) ( 193 ).
Como se predijo hace más de 20 años, la proteómica basada en espectrometría de masas ofrece a los investigadores de enfermedades cardiovasculares múltiples vías para identificar dianas terapéuticas. Es muy probable que las próximas dianas clave para el tratamiento de las enfermedades cardiovasculares se identifiquen mediante técnicas ómicas. Sin embargo, antes de su comercialización, esta metodología requerirá amplios estudios de validación que, en parte, podrían incluir una o más tecnologías proteómicas adicionales.
Tecnologías unicelulares para abordar la compleja biología de la heterogeneidad celular
Como se ha comentado, la heterogeneidad de las enfermedades representa un importante desafío en la medicina cardiovascular. Por ejemplo, las estatinas reducen el riesgo de complicaciones agudas, como el infarto de miocardio, en muchos pacientes, pero no en todos. Esto puede atribuirse a factores como la potencia y la farmacodinámica de las distintas estatinas, así como a la heterogeneidad de los pacientes. También puede deberse a los diferentes patrones de heterogeneidad de las células asociadas a la aterosclerosis (p. ej., macrófagos) entre los pacientes. Se ha demostrado que la activación proinflamatoria sostenida de los macrófagos está relacionada con trastornos vasculares ( 67 , 194-196 ). Un paradigma anterior sobre la heterogeneidad de los macrófagos proponía un fenotipo M1 proinflamatorio y un fenotipo M2 antiinflamatorio/proresolutivo ( 197 , 198 ). Sin embargo, evidencia más reciente (incluida la nuestra) sugiere que la heterogeneidad de los macrófagos es más compleja que la dicotomía M1/M2 e involucra más subpoblaciones ( 67 , 199-202 ) . Si bien el equilibrio general de las subpoblaciones de macrófagos puede regular los mecanismos o la gravedad de la enfermedad, los análisis tradicionales solo examinan los niveles promedio de expresión génica o proteica en toda la población celular (p. ej., análisis de Western blot y secuenciación masiva de ARN) y no permiten evaluar el comportamiento de las células individuales. Este desafío ha impulsado el desarrollo de diversas plataformas para el análisis de células individuales y su integración ( Figura 5 ).
Figura 5

Figura 5. Integración de análisis unicelulares para la medicina de precisión. (A) Se han producido numerosos avances tecnológicos en las plataformas utilizadas para el análisis unicelular, junto con avances que han aumentado la complejidad de los tipos de datos ómicos analizados e innovaciones en herramientas y recursos computacionales. (B) Los estudios de biología de sistemas en animales y humanos están traduciendo estos avances en atlas unicelulares de múltiples tejidos para proporcionar panoramas in vivo de la heterogeneidad celular. (C) La extensión de las tecnologías unicelulares para perfilar poblaciones a gran escala podría definir el futuro de la investigación biomédica, estableciendo diagnósticos/biomarcadores innovadores y terapias personalizadas para enfermedades causadas por subtipos celulares específicos.
Este desafío ha impulsado el rápido y extenso desarrollo de tecnologías de célula única que permiten una secuenciación más profunda en un mayor número de células, plataformas para el análisis simultáneo de diversas capas ómicas en células e infraestructura computacional y bioinformática para análisis de datos innovadores ( Figura 5A ). Se pueden seleccionar tecnologías como las plataformas basadas en microgotas, en pocillos y de código de barras secuencial según la aplicación específica. El análisis de célula única ha trascendido la caracterización de los niveles de expresión de ARN a nivel de célula individual, permitiendo mapear la expresión superficial de receptores ( 203 ) y la accesibilidad de la cromatina ( 204 ). Si bien estos conjuntos de datos ómicos se pueden analizar individualmente, también se pueden combinar con la expresión de ARNm ( 205 ) de estas células para proporcionar una caracterización multiómica verdaderamente integrada ( 206 ). Además, los recientes avances en proteómica unicelular ( 207 , 208 ), impulsados por la espectrometría de masas, permiten la caracterización imparcial del proteoma a nivel de célula individual. La transcriptómica espacial y la proteómica espacial también se han convertido en plataformas ampliamente disponibles que proporcionan información crucial sobre la distribución espacial de la heterogeneidad celular. El aprovechamiento de estas tecnologías permite la construcción de mapas multiómicos espaciales multinivel a lo largo de la progresión de la enfermedad en el corazón para identificar vías de señalización específicas de diferentes tipos celulares ( 59 , 130 , 209 , 210 ). Los ensayos que caracterizan diferentes tipos de ómicas con resolución unicelular permiten la medición simultánea de la epigenética, la transcriptómica y la proteómica. Estas técnicas incluyen ensayos unicelulares para la secuenciación de cromatina accesible a la transposasa (ATAC) para evaluar la accesibilidad de la cromatina, el perfilado unicelular de modificaciones de histonas ( 211 ), el perfilado transcriptómico espacial (p. ej., Slide-seq) ( 212 ) y el perfilado de receptores de superficie (p. ej., indexación celular de transcriptomas y secuenciación de epítopos; CITE-seq) ( 213 ). Los avances recientes se han extendido incluso al campo de la metabolómica unicelular, que ofrece la posibilidad de evaluar sustratos y metabolitos dentro de la misma célula ( 214-217 ) . Estos enfoques impulsarán significativamente la investigación ómica unicelular integrativa.
La amplia gama de paquetes de software gratuitos disponibles para analizar estos conjuntos de datos ha eliminado barreras de entrada para muchos investigadores, permitiéndoles adoptar estos enfoques para abordar sus necesidades específicas de investigación. Esta transición ha coincidido con la disminución del coste de la computación en la nube y las capacidades de computación segura proporcionadas por instituciones de investigación y empresas privadas, que permiten un procesamiento rápido y rentable de estos grandes conjuntos de datos ( Figura 5A ).
La rápida adopción de las tecnologías de secuenciación de ARN de células individuales ( 218 ) ha permitido la creación de una amplia gama de atlas de células individuales ( 219 ). Los atlas celulares de múltiples tejidos de diversos organismos modelo han proporcionado información valiosa sobre el panorama in vivo de la heterogeneidad celular (220-222 ) . Los atlas centrados en el ser humano han mapeado órganos específicos, lo cual ha sido fundamental para identificar los diversos tipos y subtipos celulares que los componen ( 219 , 223 , 224 ) ( Figura 5B ) . Los atlas celulares específicos permiten discernir cómo una misma célula, identificada en múltiples tejidos, presenta diferentes patrones de señalización transcripcional subyacentes ( 58 , 62-64 , 225-227 ) . Además, estudios recientes han empleado la tecnología de secuenciación de ARN de células individuales para identificar nuevos subtipos celulares que podrían ser factores determinantes de enfermedades en contextos clínicos específicos ( 130 , 228 ) . Estos estudios ayudan a esclarecer aspectos específicos de la señalización celular que regulan la heterogeneidad celular.
Si bien los conjuntos de datos ómicos unicelulares imparciales son cada vez más rentables, su generación, anotación y compartición siguen siendo costosas y requieren muchos recursos. La reproducibilidad y el acceso a los datos son aspectos importantes de los grandes conjuntos de datos ómicos que han experimentado grandes avances recientemente. Actualmente, existen numerosos flujos de trabajo computacionales sencillos y accesibles ( 229 , 230 ). Los requisitos de las revistas científicas que exigen el acceso público a conjuntos de datos unicelulares detallados también contribuyen a ampliar su utilidad una vez generados, lo que facilita la comparación de conjuntos de datos para mejorar la reproducibilidad.
Es importante destacar que, al utilizar datos ómicos unicelulares imparciales y disponibles públicamente, los investigadores pueden perfeccionar sus métodos y generar experimentos de seguimiento con enfoques específicos para validar estos hallazgos en un conjunto de datos más amplio o realizar experimentos de comprobación de hipótesis. En este sentido, el desarrollo de métodos para la secuenciación dirigida de ARNm unicelular reduce significativamente los costos de secuenciación y facilita la secuenciación de un gran número de células ( 231 ). De manera similar, la utilización de citometría de flujo de alta resolución ( 232 ), así como la tinción secuencial de secciones de tejido, resultan cada vez más atractivas ( 232 , 233 ). Los paneles a gran escala de sondas y anticuerpos validados permiten la rápida adopción de estas plataformas en una amplia gama de tejidos.
La caracterización de la heterogeneidad celular mediante estos métodos ayuda a identificar tipos celulares clave en entornos in vivo . Sin embargo, estudios futuros también pueden emplear métodos tanto no sesgados como dirigidos en sistemas de monocultivo para evaluar la heterogeneidad celular en respuesta a estímulos clásicos ( 234-236 ). Estudios previos han utilizado típicamente análisis ómicos masivos para identificar la heterogeneidad en las respuestas ( 94 ) , pero su capacidad para evidenciar cómo diferentes células dentro de un sistema de monocultivo pueden responder de manera distinta al mismo estímulo no se limita a estos métodos ( Figura 5B ). La secuenciación de ARN unicelular y la secuenciación ATAC unicelular ( 237 , 238 ) permitirán identificar nuevas subpoblaciones dentro de un mismo tipo celular.
Si bien las tecnologías de célula única se han desarrollado rápidamente, aún persisten algunas preguntas clave ( 239 ). Es fundamental aprovechar la información sobre la heterogeneidad celular para identificar nuevos mecanismos que se traduzcan en aplicaciones clínicas. También es necesario considerar la contribución de un pequeño subconjunto de células impulsoras de la enfermedad a su progresión. Otro aspecto para considerar es la dinámica temporal de las proteínas y los genes medidos y su contribución relativa a las enfermedades crónicas. Fundamentalmente, también debemos preguntarnos cómo la comprensión de la heterogeneidad de los macrófagos puede proporcionar bases moleculares para el desarrollo de nuevos diagnósticos y terapias ( 240 , 241 ). Estudios recientes ofrecen ejemplos de cómo los datos de heterogeneidad celular pueden traducirse en el desarrollo de fármacos ( 169 ). ¿Cómo podemos asociar la información de subconjuntos de células relacionadas con enfermedades cardiovasculares con pacientes de alto riesgo? Una mayor extensión de las tecnologías de célula única, como el seguimiento de células vivas de alto contenido para la monitorización longitudinal y la localización histológica de datos de célula única de alta dimensión en tejidos enfermos, puede facilitar la traslación clínica ( 31 , 242-245 ) . El uso combinado de datos unicelulares y métodos computacionales de cribado de fármacos ( 68 , 169 ), que se describen más adelante, también puede dar lugar a nuevas terapias potenciales. Estos métodos pueden ayudarnos a desarrollar nuevos enfoques en medicina cardiovascular de precisión ( 246 ), establecer diagnósticos/biomarcadores innovadores ( 247 ) y permitir el diseño de ensayos con criterios de inclusión inteligentes, una interpretación de datos más precisa y una mayor seguridad del paciente en los ensayos clínicos ( 248 , 249 ) ( Figura 5C ).
La IA apoya los descubrimientos traslacionales para las enfermedades cardiovasculares complejas
Los científicos médicos se han enfrentado a desafíos al analizar los enormes conjuntos de datos biológicos y clínicos necesarios para abordar la complejidad y la heterogeneidad de las enfermedades humanas. Los avances tecnológicos exponenciales y su integración en la ciencia básica y las actividades clínicas, como las ómicas y los registros electrónicos de salud (EHR), han acelerado esta tendencia. En las últimas décadas, el campo de la IA ha propiciado una importante revolución tecnológica que ya ha impactado significativamente prácticamente todos los aspectos de la experiencia humana, incluyendo la investigación y la práctica médica ( 250 , 251 ). Sin embargo, el uso de tecnologías basadas en IA en las ciencias médicas no es necesariamente nuevo. En las décadas de 1980 y 1990, los sistemas de apoyo a la decisión, como HELP (Health Evaluation through Logical Processing) o DXplain, asistieron a los médicos durante el proceso de diagnóstico ( 252 , 253 ). No obstante, con el aumento de la potencia computacional y la disponibilidad de grandes volúmenes de datos, la IA ha desvelado sus amplias capacidades en la última década.
La aplicación de la IA en las ciencias cardiovasculares se ha centrado en dos tareas principales: la predicción y la agrupación ( Figura 6 ) ( 254-256 ). Las herramientas de predicción se utilizan para estimar el pronóstico y la supervivencia de las ECV, incluidas la insuficiencia cardíaca ( 257-259 ) y las miocardiopatías (260-263). La predicción mediante IA también se ha implementado con éxito para asistir en el diagnóstico (264-266 ) , especialmente mediante el uso de datos de imagen médica (p. ej . , ecocardiograma, tomografía computarizada o resonancia magnética) ( 267-274 ). Si bien no es tan común como las tecnologías de predicción basadas en IA actuales, el aprendizaje no supervisado se ha utilizado para agrupar poblaciones de pacientes en diferentes fenotipos ( 275-278 ) , lo que facilita el diseño de estrategias terapéuticas más precisas. Además, una nueva herramienta de IA llamada AlphaMissense, que se basa en la herramienta de predicción de estructura de proteínas AlphaFold2 ( 279 ), se puede utilizar para evaluar variaciones genéticas específicas (por ejemplo, variaciones de sentido erróneo raras), abordando el “cuello de botella” anterior en el análisis bioinformático y la asignación de causalidad para vincular una variante genética candidata particular con el fenotipo.
Figura 6
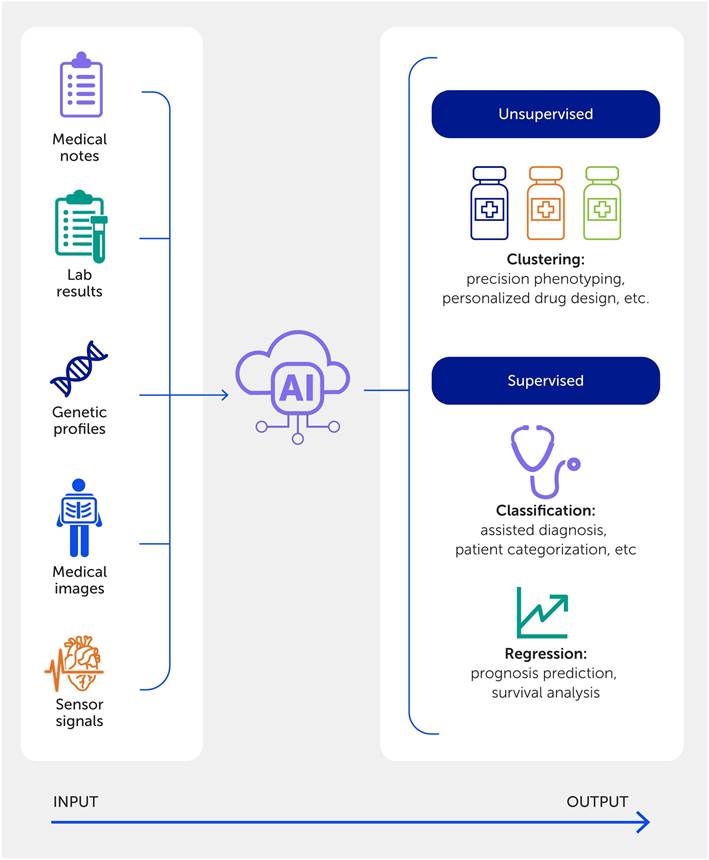
Figura 6. Un enfoque de medicina de precisión basado en inteligencia artificial (IA). Un análisis exhaustivo del flujo de trabajo de la IA en medicina, que destaca las diversas entradas de datos y distingue entre aplicaciones de aprendizaje supervisado y no supervisado en entornos clínicos y de investigación.
Dadas las diferencias individuales, los esfuerzos recientes para la identificación de dianas terapéuticas han utilizado grandes fuentes de datos clínicos, como conjuntos de datos de expresión génica asociados a enfermedades específicas e historias clínicas electrónicas (HCE), además de, o en lugar de, muestras preclínicas de cultivos celulares o modelos animales, para abordar la biología de la heterogeneidad de las enfermedades a nivel poblacional ( 71 ). La Ley de Curas del Siglo XXI, impulsada por el Gobierno de Estados Unidos en 2016, promovió el uso de fuentes de datos clínicos, como las HCE (datos del mundo real), en el desarrollo de fármacos y la toma de decisiones regulatorias ( 280 ). Los programas de IA generativa pueden crear contenido nuevo de forma autónoma aprendiendo patrones de los datos existentes. El papel de la IA en la transformación de los paradigmas regulatorios implicará mejoras en todas las etapas, desde la creación de documentos regulatorios y el diseño de protocolos hasta la selección de pacientes y centros. La capacidad de la IA para analizar grandes conjuntos de datos y construir perfiles detallados de pacientes basados en datos demográficos, historial médico y genética, para crear «gemelos digitales», puede utilizarse para simular resultados mediante ensayos virtuales. Estas son las nuevas fronteras de la IA: promesas de terapias refinadas, mejor atención al paciente y procesos regulatorios optimizados.
En un futuro próximo, la integración de historiales clínicos, conocimientos médicos y datos proporcionados por dispositivos inteligentes, como teléfonos y relojes, con tecnologías de IA, propiciará cambios sin precedentes en nuestra comprensión de la medicina cardiovascular ( 281). Empresas tecnológicas como IBM (282-284 ) , Microsoft ( 285 ), Google ( 286 ) y Apple ( 287 ) han reconocido su potencial y han anunciado importantes inversiones. El uso de la IA en la monitorización continua en tiempo real, el diseño de fármacos de precisión, la fenotipificación precisa y la predicción exacta del desarrollo de enfermedades cardiovasculares representa un avance crucial impulsado por las nuevas tecnologías en la historia de la medicina.
desarrollo de fármacos impulsado por la ciencia de datos
El coste y el tiempo necesarios para el descubrimiento de fármacos han aumentado anualmente, lo que supone un importante reto para la industria farmacéutica en el desarrollo y la comercialización de nuevos medicamentos ( 82-85 , 288 ) . Otro desafío es la baja tasa de éxito de los nuevos objetivos terapéuticos que progresan a las fases clínicas y logran resultados favorables en los ensayos clínicos ( 88 , 89 , 91 ) . Como se mencionó anteriormente, la generación de compuestos para objetivos considerados intratables es un obstáculo importante en el desarrollo de fármacos innovadores ( 99 , 100 ). Por otro lado, se ha acumulado valiosos datos médicos, biológicos y químicos, y el rendimiento de los ordenadores en el manejo de grandes volúmenes de datos ha evolucionado. Para ahorrar costes y tiempo, los enfoques computacionales han contribuido cada vez más a diversos aspectos del descubrimiento de fármacos. En particular, la exploración y el diseño computacionales de compuestos terapéuticos eficaces son importantes campos emergentes. Estas tecnologías innovadoras también pueden ayudar a que objetivos tradicionalmente intratables se conviertan en objetivos terapéuticos ( 101 ).
Una de estas técnicas utiliza la relación cuantitativa estructura-propiedad (QSPR) y la relación cuantitativa estructura-actividad (QSAR), un enfoque estadístico común que correlaciona la estructura molecular con las propiedades o la actividad biológica mediante descriptores cuantificables. Estos descriptores se generan frecuentemente a través de la teoría del funcional de la densidad (DFT) ( 289 ), una teoría cuántica ampliamente utilizada para calcular las estructuras electrónicas de átomos y moléculas. Seleccionar los descriptores más relevantes supone un reto importante, ya que encapsulan las características moleculares responsables de la actividad biológica o las propiedades químicas observadas ( 290 ). Los avances recientes han introducido nuevas metodologías QSAR que enriquecen el análisis de la bioactividad. Sin embargo, los modelos QSAR requieren pruebas y validación rigurosas para evaluar su precisión predictiva y su aplicabilidad práctica ( 291 ).
Un recurso para la identificación de fármacos es el Connectivity Map (CMap) ( 292 ). Esta base de datos incluye cambios en numerosos perfiles de expresión génica («firmas») que se producen al exponer diversos compuestos a distintos tipos celulares. El CMap se ha ampliado para incluir más de un millón de firmas, utilizando más de 20 000 moléculas pequeñas, gracias a la introducción del ensayo L1000, un método de perfilado de expresión génica de bajo coste, alto rendimiento y gran reproducibilidad ( 293 , 294 ). El CMap basado en L1000 identifica rápidamente moléculas pequeñas que modifican las firmas de expresión génica, ya sea revirtiendo o imitando los cambios causados por ciertas enfermedades. Por consiguiente, estos enfoques se han utilizado ampliamente para la rápida reutilización de fármacos ( 102 , 103 , 295-297 ). Este cribado fenotípico, como contraestrategia al descubrimiento de fármacos tradicional basado en dianas, ha tenido éxito en el desarrollo de fármacos pioneros ( 298 , 299 ).
En el descubrimiento de fármacos dirigidos a dianas, que generalmente favorece el desarrollo de fármacos de vanguardia, la identificación de compuestos que interactúan con proteínas diana es una tarea fundamental ( 300 , 301 ). Las interacciones fármaco-diana (IFD) se han estudiado experimentalmente mediante cribado de alto rendimiento. Sin embargo, el número de compuestos que se pueden analizar de esta manera es limitado en comparación con el número teórico de compuestos con propiedades farmacológicas, estimado entre 10<sup> 23</sup> y 10<sup> 60</sup> ( 302 ). Por lo tanto, es conveniente reducir la lista de compuestos candidatos mediante métodos computacionales. La predicción computacional de IFD se puede dividir en métodos basados en ligandos, en acoplamiento molecular y quimiogenómicos.
Los métodos basados en ligandos se basan en el principio de que los compuestos estructuralmente similares a un ligando conocido de una proteína diana probablemente interactúen con ella de forma similar. Si bien estos métodos son racionales y fáciles de seguir, no se puede predecir nada cuando no se conoce ningún compuesto que se una a la proteína diana.
Los métodos basados en acoplamiento molecular calculan las afinidades de unión entre compuestos y proteínas diana mediante la simulación de sus estructuras tridimensionales. Si bien este método permite evaluar interacciones con cualquier compuesto, requiere conocer la estructura in vivo de la proteína diana. Por lo tanto, la predicción se dificulta para compuestos que interactúan con proteínas de membrana o receptores, debido a la complejidad y flexibilidad de sus estructuras.
Los enfoques quimiogenómicos utilizan las características fisicoquímicas del compuesto, como las huellas moleculares, y las características genómicas de la proteína, como las secuencias de aminoácidos. Los modelos de aprendizaje automático aprenden el patrón de estas características necesario para las interacciones mediante el uso de conjuntos de datos de interacciones proteína-proteína (DTI) conocidos, y luego el modelo predice si un compuesto desconocido interactúa con la proteína diana. Este enfoque ha atraído la atención recientemente porque supera las desventajas inherentes de los enfoques basados en ligandos y en acoplamiento molecular ( 303 ). Se han propuesto diversos marcos que emplean métodos clásicos de aprendizaje automático, como las máquinas de vectores de soporte o los bosques aleatorios, y técnicas avanzadas, como el aprendizaje profundo (DL), como modelos computacionales relevantes, y ya han mejorado significativamente la precisión de la predicción de DTI ( 304-306 ) .
Los científicos también han intentado diseñar computacionalmente nuevos compuestos con perfiles moleculares deseados (p. ej., bioactividad, metabolismo de fármacos, farmacocinética o accesibilidad sintética). En este campo, denominado diseño molecular de novo , han surgido diversos modelos generativos basados en la arquitectura de aprendizaje profundo, como las redes neuronales recurrentes, los autoencoders variacionales y las redes generativas antagónicas ( 307-309 ) . Gracias al notable desarrollo de la IA, estos modelos generativos basados en IA crean compuestos factibles, plausibles y completamente nuevos que nunca se han sintetizado en el mundo real. Estos compuestos generados pueden utilizarse sin problemas como una nueva biblioteca de compuestos para la predicción de interacciones fármaco-proteína (DTI). Además, al proporcionar las firmas CMap basadas en L1000 a los modelos generativos mencionados, se ha intentado ampliar el rango de aplicabilidad de CMap basado en L1000 para el diseño de nuevos compuestos que inducen las firmas de expresión génica deseadas ( 310 , 311 ).
Cabe destacar que se están empezando a utilizar métodos computacionales para predecir la estructura terciaria de las proteínas. Un algoritmo basado en IA desarrollado recientemente, AlphaFold2, predice estructuras proteicas 3D a partir de las secuencias de aminoácidos con gran precisión ( 312 ). AlphaFold2 podría acelerar la predicción de interacciones proteína-proteína (DTI), especialmente mediante métodos basados en acoplamiento molecular y quimiogenómicos, ya que puede proporcionar estructuras proteicas precisas cuando no se dispone de una proteína experimental y extraer más características estructurales que las que permiten las secuencias de aminoácidos por sí solas ( 313 ). Gracias a estas mejoras, es probable que los métodos computacionales desempeñen un papel cada vez más importante en la exploración de compuestos para el descubrimiento de fármacos.
Nuevas plataformas terapéuticas: de proteínas a ARN
Actualmente, la mayoría de las enfermedades cardiovasculares se tratan con fármacos de molécula pequeña administrados por vía oral que se unen a proteínas que contribuyen a los mecanismos de la enfermedad. Sin embargo, como ya se mencionó, algunas dianas terapéuticas no son accesibles con las estrategias convencionales. Entre las opciones terapéuticas distintas a las moléculas pequeñas se incluyen los anticuerpos monoclonales contra proteínas, como evolocumab y alirocumab, que actúan sobre la PCSK9 para la hipercolesterolemia familiar ( 314 ). Si bien estos fármacos son eficaces y pueden superar algunos problemas de accesibilidad, sus dianas se limitan a proteínas de membrana celular o proteínas circulantes, y su producción es costosa. Las tecnologías innovadoras que permiten atacar dianas no accesibles incluyen la degradación dirigida de proteínas, como las moléculas quimera de direccionamiento de proteólisis (PROTAC), que pueden degradar una proteína diana controlando el sistema ubiquitina-proteasoma. En comparación con las moléculas pequeñas que bloquean la función proteica pero no alteran los niveles de proteína, el ARN de interferencia pequeño (ARNip) y los enfoques basados en PROTAC pueden modular directamente los niveles de proteína. Si bien la tecnología PROTAC se ha utilizado principalmente para objetivos cancerosos, los avances recientes han extendido su aplicación a enfermedades no cancerosas, en particular trastornos inmunitarios, inflamatorios y neurológicos ( 315 ).
Las intervenciones dirigidas al ARN, una nueva clase de terapias innovadoras, podrían superar algunos de los desafíos mencionados ( 84 , 104-106 ). Sus ventajas incluyen: (i) cada gen de interés es potencialmente susceptible de ser atacado por terapias de ARN, mientras que las moléculas pequeñas o los anticuerpos dirigidos a proteínas solo pueden actuar sobre el 0,05 % del genoma humano ( 316 ); (ii) los costos de fabricación son menores que los de las terapias dirigidas a proteínas; y (iii) los tiempos de desarrollo son considerablemente más cortos que los de los medicamentos convencionales. Las intervenciones de ARN incluyen oligonucleótidos antisentido (ASO), ARNip, edición genómica basada en CRISPR, aptámeros y vacunas de ARNm ( 317-321 ).
El primer fármaco ASO fue fomivirsen, aprobado por la FDA de Estados Unidos a finales de la década de 1990 para el tratamiento de la retinitis por citomegalovirus (CMV) ( 322 , 323 ). Mipomersen, un ASO dirigido al ARNm de la apolipoproteína B-100, fue la primera terapia dirigida al ARN aprobada por la FDA para una enfermedad cardiovascular: la hipercolesterolemia familiar ( 324 ). Inclisiran, un ARNip dirigido a PCSK9, ha demostrado ser seguro y eficaz para reducir el colesterol LDL (en aproximadamente un 50%) y actualmente se están realizando ensayos clínicos sobre resultados cardiovasculares ( 325 ). Otro ASO en desarrollo, pelacarsen, está dirigido contra la lipoproteína(a) [Lp(a)], que se asocia clínicamente con enfermedades cardiovasculares, incluida la estenosis aórtica. Específicamente, pelacarsen actúa sobre la producción de apolipoproteína(a) [Apo(a)], un componente clave de la Lp(a) unida mediante enlaces disulfuro a la apolipoproteína B100. Pelacarsen demostró ser seguro y redujo los niveles de Lp(a) hasta en un 80 % en ensayos de fase 2 ( 326 ). Los ensayos clínicos con ARNip que reducen tanto la transtiretina (TTR) normal como la mutada, causante de la amiloidosis por TTR, mostraron una atenuación de la progresión no solo de la neuropatía periférica asociada, sino también de la miocardiopatía ( 327 , 328 ). Además de estos avances, las vacunas de ARNm contra la COVID-19 demostraron que la administración de ARNm nativo o modificado químicamente (p. ej., pseudouridina) mediante encapsulación en nanopartículas lipídicas es otra opción potencial para tratar diversas enfermedades, incluidas las cardiovasculares. Sin embargo, todos estos métodos se centran en la interacción con proteínas.
Gracias al creciente uso de secuenciadores de nueva generación, sabemos que la mayor parte de nuestro genoma codificante se transcribe como ARN ( 329 ). Solo un pequeño porcentaje codifica proteínas, lo que deja a la mayoría de los ARN transcritos como ARN no codificantes (ARNnc). Además de los ARNnc bien conocidos, como los ARN ribosómicos (ARNr) y los ARN de transferencia (ARNt), en los últimos años se han identificado y caracterizado otros ARNnc reguladores, incluidos los microARN (miARN), los ARN circulares y los ARNnc largos (ARNnc largos) ( 330 ). No es de extrañar que la desregulación de los ARNnc esté relacionada con diversas etiologías de enfermedades cardiovasculares (ECV), por lo que estos ARNnc se están investigando como posibles biomarcadores diagnósticos o dianas terapéuticas para las ECV ( 331 ).
Actualmente se están llevando a cabo ensayos preclínicos y clínicos de terapias basadas en microARN para enfermedades cardiovasculares (ECV) ( 332 ), mientras que la mayoría de los proyectos sobre terapias dirigidas a ARNnc aún se encuentran en la fase preclínica. Los ARNnc están asociados a numerosas enfermedades humanas y se están realizando muchos esfuerzos para desarrollar tecnologías que permitan su uso terapéutico ( 333 , 334 ). Los ARNnc presentan diversos mecanismos de acción, lo que ofrece diferentes oportunidades para modificar sus funciones (p. ej., mediante ARNip, oligonucleótidos antisentido, CRISPR/Cas9 y moléculas pequeñas). Algunos ARNnc mitocondriales han alcanzado la fase de ensayos clínicos como terapias contra el cáncer ( 334 ). La creciente evidencia preclínica ha implicado a los ARNnc en la patogénesis de diversas ECV, como la aterosclerosis, el infarto de miocardio, la insuficiencia cardíaca y las arritmias, lo que proporciona bases moleculares para sus aplicaciones clínicas como dianas terapéuticas o biomarcadores ( 331 , 335 , 336 ). Si bien las terapias dirigidas a los lncRNA tienen un alto potencial, su desarrollo clínico se encuentra rezagado. Esto puede deberse a que aún no comprendemos completamente su mecanismo de acción, lo que exige la realización de más estudios mecanísticos de cada lncRNA. Además, los métodos computacionales innovadores deberían ayudar a dilucidar sus interacciones con los miRNA, los ARN codificantes y las proteínas. El uso combinado de estos enfoques de sistemas dirigidos contribuirá a traducir los avances en la biología de los lncRNA en medicamentos clínicos para las enfermedades cardiovasculares.
Estas nuevas modalidades también pueden combinarse con una amplia gama de estrategias de administración de fármacos para maximizar su eficacia ( 337 ) y reducir los efectos secundarios ( 338 ). Estas combinaciones han sido clave para modalidades emergentes, como las terapias dirigidas al ARN ( 339 ). Si bien estos métodos de administración de fármacos aún no se han probado clínicamente, han acelerado la investigación preclínica al servir como herramientas poderosas para la intervención in vivo ( 95 , 144 ).
Transformando la medicina cardiovascular: enfoques innovadores e iniciativas de colaboración
El descubrimiento de fármacos interdisciplinario y con múltiples partes interesadas impulsa la innovación.
Facilitar el descubrimiento y desarrollo de fármacos para una medicina de precisión innovadora exige nuevos paradigmas. Los avances tecnológicos pueden ayudar a superar limitaciones técnicas específicas y promover descubrimientos científicos. Estos descubrimientos pueden acelerarse mediante modelos que integran múltiples tecnologías innovadoras para abordar de forma integral la biología de la heterogeneidad, identificar dianas farmacológicas prometedoras, predecir sus repercusiones clínicas y diseñar, generar y probar nuevos fármacos. La colaboración dinámica y estrecha entre biólogos y científicos de datos es esencial para establecer una investigación de descubrimiento de fármacos totalmente integrada, como se ha comentado anteriormente. Estos enfoques integrados también requieren una colaboración intersectorial innovadora.
Uno de los principales obstáculos es la gran brecha existente entre la investigación de descubrimiento de dianas terapéuticas en el ámbito académico y el desarrollo de fármacos en la industria ( Figura 7 ). Muchas ideas u dianas identificadas en la investigación académica no logran superar esta brecha por diversas razones, como la falta de experiencia y financiación en el ámbito académico y la reticencia de la industria a invertir en proyectos iniciales de alto riesgo. Para abordar estos importantes desafíos, se han establecido varios modelos de colaboración entre la academia y la industria con el fin de combinar las fortalezas de ambos sectores ( 89 , 340-344 ). El desarrollo de conceptos novedosos mediante la exploración de áreas inexploradas y la realización de proyectos de alto riesgo es una fortaleza típica de los investigadores académicos, mientras que los científicos industriales poseen experiencia específica en el diseño y desarrollo de fármacos y cuentan con un mayor apoyo en infraestructura y recursos financieros ( 341 , 342 ). De hecho, un estudio indicó que la colaboración entre la academia y la industria mostró tasas de éxito en el desarrollo clínico superiores a las que se observan habitualmente en la academia o la industria sin colaboración ( 89 ). Otros tipos de acuerdos de colaboración incluyen la investigación precompetitiva entre compañías farmacéuticas para compartir recursos y experiencia, y las asociaciones público-privadas ( 345 – 348 ).
Figura 7
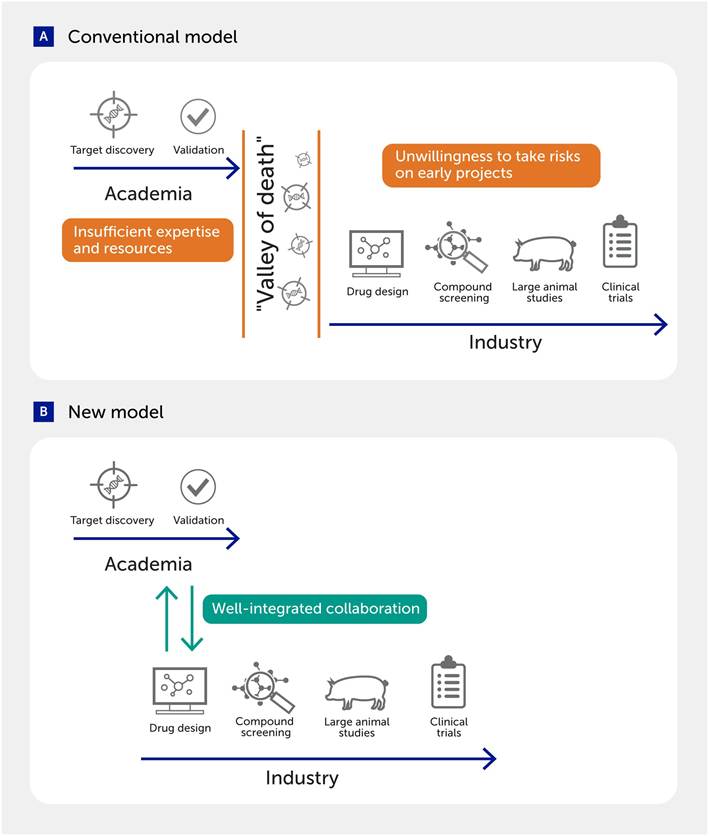
Figura 7. Colaboración entre la academia y la industria para superar las dificultades en el descubrimiento de fármacos. (A) Diversos desafíos suelen obstaculizar la transición de los objetivos descubiertos en la academia al desarrollo de fármacos en la industria. (B) Los nuevos modelos que integran acciones en ambos sectores pueden facilitar la traslación de los descubrimientos a la clínica.
Ciencia de datos colaborativa: clave para la medicina de precisión
Como se ha comentado, los principales desafíos en las enfermedades cardiovasculares han impulsado la adopción de enfoques de medicina de precisión, que a su vez requieren nuevas tecnologías. Estas innovaciones disruptivas no solo resuelven desafíos, sino que también generan nuevos conceptos. El componente clave y esencial en esta relación sinérgica es la ciencia de datos ( 349 ). Entre las nuevas tecnologías en diversas disciplinas, la evolución de la ciencia de datos ha sido particularmente rápida. Es fundamental reconocer la importancia de implementar esta disciplina e involucrar a los científicos de datos en cada etapa de la innovación en medicina cardiovascular, desde la ciencia básica, el descubrimiento y la investigación traslacional hasta el desarrollo clínico de nuevas terapias y, finalmente, su uso en la práctica clínica. También debemos reconocer la diversidad de la ciencia de datos, caracterizada por diversas subespecialidades (por ejemplo, bioestadística, bioinformática, biofísica, ciencia de redes, biología computacional y enfoques basados en aprendizaje automático), lo que permite la conformación de un equipo multidisciplinario de ciencia de datos para cubrir una amplia gama de necesidades. Es necesario destinar más recursos para apoyar el desarrollo de científicos de datos a nivel institucional y gubernamental, con el fin de impulsar la innovación biomédica futura tanto en el ámbito académico como en el industrial. Finalmente, las infraestructuras que apoyan la interoperabilidad entre las múltiples fuentes de datos involucradas también son vitales para mejorar las relaciones sinérgicas entre la ciencia de datos y la medicina cardiovascular ( 350 ).
Lecciones aprendidas de la COVID-19: ¿estamos preparados para la próxima pandemia?
Durante la pandemia de COVID-19, más de 770 millones de personas se infectaron con el virus SARS-CoV-2 en todo el mundo, lo que provocó 7 millones de muertes ( 351 ). La comunidad científica se unió para responder a las demandas que surgieron rápidamente como consecuencia. La concientización pública, política y científica permitió redirigir recursos hacia la lucha contra esta amenaza global. Esto también impulsó el interés por investigar las consecuencias extensas y a largo plazo de la infección viral a gran escala ( 352 ).
Durante este periodo, la FDA de Estados Unidos demostró flexibilidad e innovación al modificar la normativa vigente para acelerar la aprobación de medicamentos que transformaron la vida de los pacientes con COVID-19 ( 353 , 354 ). De igual manera, la Organización Mundial de la Salud (OMS) desempeñó un papel fundamental en la elaboración y distribución de directrices y herramientas para la comunidad médica mundial ( https://covid19.who.int ). Como resultado, se implementaron con una rapidez sin precedentes nuevas tecnologías, como las vacunas de ARNm y los anticuerpos neutralizantes ( 355 , 356 ), para contribuir a reducir la gravedad de la enfermedad. Si bien estas herramientas innovadoras ya se encontraban en desarrollo ( 357 , 358 ), la pandemia de COVID-19 impulsó su adopción como complemento de los tratamientos convencionales. Esta nueva atención a la infección viral aguda exigió que las comunidades científica, médica y regulatoria reestructuraran y acortaran el cronograma de desarrollo e implementación de fármacos ( 359 ). Programas gubernamentales, como el programa RECOVER de los Institutos Nacionales de Salud de Estados Unidos ( 360 ) ( https://recovercovid.org/ ), cuyo objetivo era caracterizar las secuelas postagudas de la infección por SARS-CoV-2 (síndrome PASC o «COVID persistente»), impulsaron la creación de colaboraciones nacionales multiinstitucionales y multidisciplinarias al eliminar las barreras a la ciencia interactiva ( 361 ). Las tecnologías desarrolladas mediante este esfuerzo global se aplicarán para combatir otras enfermedades, como trastornos cardiovasculares, pulmonares y neurológicos.
El conocimiento adquirido en los ámbitos social, político y clínico ha moldeado la forma en que nuestra comunidad científica responde a los desafíos mundiales. El surgimiento de nuevas tecnologías ha incrementado el nivel de responsabilidad, ya que permiten evaluar las intervenciones con mayor rapidez, precisión y a mayor escala que antes ( 362 , 363 ). Será fundamental aprovechar las colaboraciones establecidas durante esta crisis para afrontar con éxito futuras pandemias.
Reformar las políticas sanitarias mundiales para abordar la principal causa mundial de mortalidad
Hemos analizado que invertir en enfoques innovadores y tecnologías de vanguardia contribuirá al desarrollo de tratamientos e intervenciones que mejoren los resultados de las enfermedades cardiovasculares. Sin embargo, no podemos permitirnos perder la perspectiva general. El efecto dominó de las causas antropogénicas de mortalidad constituye el problema de salud humana más acuciante en la actualidad ( 364 ). El cambio climático conlleva un aumento de los desastres naturales, que, a su vez, provocan alteraciones en la seguridad alimentaria e hídrica. Asimismo, genera interrupciones en las cadenas de suministro y desplazamientos de población. Todas estas consecuencias, en conjunto, ejercen una gran presión sobre el sistema sanitario. Esta presión agrava el impacto de los factores ambientales y del estilo de vida en el desarrollo y la progresión de las enfermedades cardiovasculares. Además, existe un mayor riesgo de enfermedades respiratorias y transmitidas por vectores debido a estos factores interconectados ( 365 ).
Se necesitan esfuerzos concertados, aplicados a la escala poblacional de los Objetivos de Desarrollo del Milenio y los Objetivos de Desarrollo Sostenible (ODS), para aumentar la concienciación pública sobre las enfermedades cardiovasculares (ECV) y sus factores de riesgo ( 366 , 367 ). Los enfoques de medicina de precisión pueden ser un recurso invaluable para alcanzar el ODS 3.4, que busca reducir la mortalidad prematura por enfermedades no transmisibles mediante la prevención y el tratamiento. La prevención de estas enfermedades debe priorizarse fomentando estilos de vida saludables, el abandono del tabaco y alternativas alimentarias más nutritivas. Para mitigar , en cierta medida, esta denominada «enfermedad de la civilización» (371), es necesario fortalecer la infraestructura sanitaria, aumentar el acceso equitativo a una atención médica de calidad, reducir las disparidades económicas ( 368 ) y promover el apoyo unánime al Plan de Acción Mundial de la OMS para la Prevención y el Control de las ENT ( 369 , 370 ) .
Imperativo político para garantizar la equidad global
La pandemia de COVID-19 puso de manifiesto las vulnerabilidades de los sistemas de salud mundiales: la falta de cooperación entre los gobiernos y el sector privado, la distribución desigual de los recursos médicos (incluidas las vacunas) y la desatención de las necesidades en el Sur Global. En el contexto de las enfermedades cardiovasculares, la desatención de la carga de morbilidad en los países de bajos ingresos y de ingresos medios bajos (PBI/PIMB) y la exclusión de estas poblaciones de la investigación (incluidos los ensayos clínicos) han provocado graves crisis sanitarias ( 372 ). Si bien la carga de morbilidad es elevada en los PBI y los PIMB, la contribución de estos países a la producción científica mundial es mínima, en parte debido a su limitada capacidad de investigación ( 373 ). Además, en la actualidad, las respuestas mundiales a las principales amenazas para la salud mundial, tanto por enfermedades no transmisibles como infecciosas, se ven obstaculizadas por la división geopolítica, los conflictos y los desequilibrios de poder. ( 374 ) Lograr la equidad sanitaria mundial requiere la participación de múltiples sectores, enfoques multifacéticos y actores ( 375 ) mediante el surgimiento de marcos globales como el acuerdo de la OMS sobre pandemias, adoptado en mayo de 2025 ( 376 ). Si bien las pandemias son temporales, la cooperación continua y la asignación de recursos financieros a la investigación y la divulgación son fundamentales para mitigar futuras calamidades. Un liderazgo mundial eficaz depende del diálogo constructivo sobre la atención sanitaria mundial entre todos los Estados miembros, junto con las contribuciones proactivas de las instituciones intergubernamentales. Para que esto suceda, los principales actores políticos deben reconocer su falta de atención a la carga de las enfermedades cardiovasculares y la insuficiente infraestructura sanitaria del Sur Global, lo que, en consecuencia, agrava sus dificultades. Los esfuerzos concertados para abordar los problemas que afectan a las personas que viven en países de bajos ingresos y de ingresos medios y bajos serán beneficiosos a nivel mundial al reducir la carga tanto de las enfermedades transmisibles como de las no transmisibles. En última instancia, abordar las disparidades en la atención sanitaria mundial no es solo un imperativo moral, sino también una necesidad estratégica para salvaguardar el bienestar de toda la humanidad. Al fomentar la colaboración, la empatía y un compromiso compartido con el bienestar colectivo, podemos construir un mundo donde el acceso a la atención médica sea un derecho fundamental para cada individuo, independientemente de su ubicación geográfica o estatus socioeconómico.
Por lo tanto, la transformación hacia un paradigma de innovación de precisión en medicina cardiovascular requerirá más que los avances científicos y tecnológicos descritos anteriormente. Se necesitan colaboraciones interdisciplinarias, intersectoriales y globales a lo largo de todo el proceso de investigación e innovación ( 352 , 377 , 378 ), respaldadas por el liderazgo de las políticas de salud globales, para implementar modelos adecuados de financiación y organización de la investigación, infraestructuras y políticas de datos, nuevos métodos de ensayos clínicos, regulación de medicamentos y políticas de acceso de los pacientes ( Figura 8 ).
Figura 8

Figura 8. El liderazgo político global impulsa innovaciones cardiovasculares transformadoras. Revolucionar la atención médica exige un compromiso sin precedentes por parte de los líderes políticos globales para fomentar la colaboración interdisciplinaria, la financiación y el apoyo. Esto impulsará la innovación, mejorará la capacidad de la ciencia de datos, establecerá políticas de salud pública centradas en el paciente y coordinará los esfuerzos para reducir la desigualdad global, abordando así la pandemia silenciosa de las enfermedades cardiovasculares.
Hemos analizado cómo los principales retos y necesidades en la medicina cardiovascular clínica han brindado oportunidades a las comunidades científica y médica para implementar innovaciones y desarrollar el enfoque sistémico necesario para facilitar la búsqueda de mecanismos de enfermedad y establecer estrategias no convencionales en el desarrollo de fármacos. La rápida evolución de las tecnologías de vanguardia ha incrementado recientemente nuestra comprensión de la biología de la heterogeneidad a nivel celular y del paciente, lo que permitiría el establecimiento de nuevos paradigmas de medicina de precisión para las enfermedades cardiovasculares. Los métodos computacionales avanzados ayudan a convertir dianas tradicionalmente intratables en dianas terapéuticas viables. Nuevas plataformas, como las terapias de ARN, facilitan la modulación de dianas intratables ( 379 ).
La innovación disruptiva no solo resuelve desafíos, sino que también nos conduce a nuevos paradigmas. El establecimiento de nuevos conceptos, a su vez, requiere el desarrollo de nuevas tecnologías. La clave para una innovación cardiovascular exitosa reside en una relación sinérgica entre las nuevas tecnologías y los nuevos paradigmas, respaldada por una interacción dinámica y estrecha entre la investigación biomédica y la ciencia de datos. Además, las alianzas intersectoriales (por ejemplo, entre la academia y la industria) o internacionales pueden contribuir a la defensa contra los riesgos cardiovasculares residuales globales y a abordar necesidades médicas no satisfechas. Esto se evidenció durante la pandemia de COVID-19, donde nuestra comunidad se vio obligada a desarrollar rápidamente soluciones sin fronteras. Este desafío sin precedentes impulsó un esfuerzo mundial entre científicos de la academia y la industria, lo que condujo a avances en la comprensión de la transmisión del virus, aceleró el desarrollo de nuevas tecnologías (por ejemplo, vacunas de ARNm) y reorganizó la comunidad médica para mejorar las respuestas a futuras crisis. Esta colaboración fluida entre diversas disciplinas, sectores y naciones transformará los paradigmas de innovación para revolucionar la medicina cardiovascular sin fronteras y acelerar la traslación de los descubrimientos a la práctica clínica.