No se debe ser más católico que el papa. Milei.
Luego de la pandemia del Covid 19 observamos que los países productores de medicamentos e insumos privilegiarían el suministro local, y las demandas de su población, por lo tanto, nos enfrentamos a carencias en elementos de protección personal, medicamentos e insumos, que fueron muy tensionantés ante el riesgo de generar un posible costo de oportunidad, o tener que elegir con los últimos respiradores. Se debe fortalecer la industria nacional en fabricar insumos, medicamentos genéricos, y mediante co marketing con algunos que tengan patentes, asi como insumos, tener medicamentos de la china y la india, para gozar de independencia. Si fueramos previsores, importaríamos los medicamentos que se comercializaron el año anterior y ya tenerlos nacionalizados, esto hace a una previsión estratégica. Son los «armamentos de la salud», usarlos antes que se venzan y volver a comprar. Quien debería hacerlo, firmas consorciadas privadas.
La soberanía sanitaria es la capacidad de un Estado para garantizar de forma autónoma, equitativa y soberana el acceso a la salud, medicamentos y recursos esenciales para su población, reduciendo la dependencia externa. Implica el desarrollo de políticas propias, la producción local de insumos, el fortalecimiento de sistemas públicos y la soberanía en investigación científico-tecnológica.
Tendríamos que desarrollar una ley de medicamentos críticos para que los laboratorios que produzcan en argentina se vean incentivados de producir y que haya stock para anticiparse a las crisis. Hoy pueden ser muy económico lo que compramos de China o india, pero en una situación de necesidad extrema se cerrarán las exportaciones y se interrumpirán los contratos, aunque estén las ordenes de compra ingresadas. Este es un buen momento para plantearlo, puesto que además se quiere retrotraer algunos aspectos proteccionistas de las patentes con los laboratorios EE.UU. no debemos ser más católicos que el Papa, además Trump, no lidera un gobierno liberal sino nacionalista, populista y proteccionista.
Implicaría fortalecer la industria nacional para que produzca y mantenga stock de estos medicamentos, con la exigencia que tenga stock de drogas para producir medicamentos de las ventas potenciales de un año. para que si se cierra la exportación tengamos los insumos fundamentales para producción. También de vidrio y blísteres.

¿Qué se sabe ya sobre el tema?
Para abordar los problemas de disponibilidad de medicamentos en Europa, los gobiernos han considerado fomentar la relocalización de la producción de API como una opción política para mejorar la seguridad del suministro. Si bien algunos países y empresas ya han implementado iniciativas de relocalización, aún no se comprende con certeza si el proceso de relocalización de la producción de API a Europa es viable y, de ser así, qué factores podrían contribuir o incluso ser necesarios para impulsarla.
¿Qué aporta este estudio a la literatura?
Para orientar a los responsables políticos, este estudio explora las principales barreras, facilitadores y prerrequisitos para la relocalización de la producción de API en Europa, según se menciona en la literatura y desde diferentes partes interesadas, incorporando las perspectivas de la formulación de políticas, la investigación y el sector privado. Si bien la producción de API parece ser un asunto de política industrial, tiene importantes implicaciones para la salud pública y, por lo tanto, es relevante para los responsables políticos del sector sanitario.
¿Cuáles son las implicaciones políticas?
Este estudio destaca el potencial de las soluciones de política industrial para abordar los problemas de salud pública. Por ello, destaca la importancia de la coordinación y la colaboración intersectoriales a nivel nacional y europeo.
1 . Antecedentes
A nivel mundial, la escasez de medicamentos ha aumentado en los últimos años, incluso en Europa [ [1] , [2] , [3] , [4] , [5] , [6] , [7] , [8] ]. Ciertos grupos de medicamentos, como los antibióticos, se ven particularmente afectados por la escasez, lo que puede tener un impacto importante en la salud de los pacientes [ [9] , [10] , [11] , [12] ]. Las implicaciones de la escasez de medicamentos para la salud pública se hicieron aún más evidentes en los últimos años, cuando ciertos medicamentos críticos no estaban disponibles [ 5 ]. Las razones de la escasez de medicamentos son multifactoriales y complejas, e incluyen aumentos inesperados en la demanda de medicamentos, interrupciones en la cadena de suministro, problemas de calidad como contaminaciones o problemas durante el transporte [ 4 ].
La disponibilidad de ingredientes farmacéuticos activos (API) es un prerrequisito importante para la seguridad del suministro [ 13 ]. Desde la década de 1960, India y China han estado invirtiendo en su producción local de API y se convirtieron en líderes mundiales, en particular para API de baja complejidad y alto volumen [ 14 ]. Por ejemplo, India y China proporcionan casi exclusivamente suministro para la demanda europea de API como simvastatina (60% India; 40% China) o candesartán (5% India; 90% China) [ 15 ]. En las últimas décadas, varios sitios de producción de API que se habían establecido inicialmente en Europa se cerraron y se trasladaron a Asia principalmente debido a los menores costos en esa región. Esto resultó en una fuerte dependencia de Europa en los países asiáticos, lo que agravó la frágil situación de los mercados de API y fue un factor para las interrupciones en la disponibilidad de algunos medicamentos en Europa, incluidos algunos medicamentos críticos [ 5 ].
Para asegurar el suministro de medicamentos y mitigar y prevenir la escasez de medicamentos, los gobiernos nacionales y la Comisión Europea han implementado diferentes medidas [ 4 , 10 , [16] , [17] , [18] , [19] ]. Se discutieron acciones adicionales, por ejemplo, la propuesta de la Ley de Medicamentos Críticos [ 20 ] se publicó en marzo de 2025, y se planea una revisión de la legislación biotecnológica, con la propuesta de la Ley de Biotecnología prevista para 2026 [ 21 ]. Entre ellas, el fortalecimiento de la producción local, donde el término «local» describe una producción más cercana, se considera una estrategia prometedora para fomentar la seguridad del suministro de medicamentos en Europa [ 13 , 22 , 23 ]. Una variante del fortalecimiento de la producción local es traer la producción de API de vuelta a Europa. Esto se conoce como reshoring y se relaciona con un proceso en el que las actividades de producción se transfieren de vuelta a una ubicación o país en particular [ 24 , 25 ]. Los sinónimos que se utilizan comúnmente en la literatura son backshoring, relocation, onshoring y nearshoring, que son términos algo ambiguos [ 22 , [26] , [27] , [28] ].
Las instituciones de la Unión Europea (UE) publicaron varios documentos que solicitan mayores inversiones por parte de los gobiernos y la industria en la producción de API en la UE [ 10 , [29] , [30] , [31] ]. Algunos fabricantes farmacéuticos europeos, como Sandoz o Boehringer-Ingelheim, anunciaron que ampliarían sus capacidades de fabricación en Europa [ [32] , [33] , [34] ]. Sumándose a las iniciativas de la industria, los gobiernos de los Estados miembros de la UE también implementaron políticas de apoyo para fortalecer la producción local de API, o anunciaron que lo harían [ 18 ].
Estos esfuerzos sugieren la disposición de los sectores público y privado a invertir en la producción europea de API. Sin embargo, se sabe poco sobre lo que se necesita para recuperar la producción de API en Europa. Los resultados de una revisión bibliográfica realizada por los autores a principios de 2023 sugirieron que algunas partes interesadas no consideraban viable la relocalización debido a barreras económicas y legales. Sin embargo, una evaluación exhaustiva quedó fuera del alcance de dicha investigación.
Por lo tanto, el objetivo de este estudio es explorar las evaluaciones de las partes interesadas y los expertos con respecto a la viabilidad de relocalizar la producción de API en los países europeos basándose en la identificación de las principales barreras, facilitadores y prerrequisitos informados para la relocalización de la producción de API en Europa.
Caja 1
Definiciones de barreras, facilitadores y prerrequisitos
Las barreras se definieron como factores que dificultan el proceso de relocalización o añaden complejidad sustancial a su implementación. Pueden surgir antes (por ejemplo, durante la fase de toma de decisiones) o durante el proceso mismo (por ejemplo, factores que dificultan la implementación continua).
Los facilitadores se definieron como factores que apoyan o facilitan la relocalización de la producción de API a Europa. Entendidos como contrapartes de las barreras, los facilitadores pueden facilitar la implementación de iniciativas de relocalización, acelerar el proceso o reducir el riesgo de fracaso. También pueden representar factores que fomentan activamente la decisión de relocalización (similar a [ 40 ]) y ofrecen ventajas sobre, por ejemplo, la deslocalización de plantas de producción. Investigaciones previas [ 36 , 39 , 41 ] han utilizado el término «impulsores» de forma similar o sinónima.
Los prerrequisitos se definieron como las condiciones necesarias para la relocalización de la producción de API. En ausencia de estos prerrequisitos, implementar una iniciativa de relocalización eficaz puede resultar poco realista o difícil. Los prerrequisitos pueden, en cierta medida, ayudar a mitigar las barreras, pero no necesariamente tienen que hacerlo. Si bien los facilitadores/impulsores y las barreras se han examinado en investigaciones previas, los prerrequisitos para la relocalización han recibido comparativamente menos atención [ 38 ].
2.2 . Revisión de la literatura
Se realizó una revisión bibliográfica específica en febrero de 2023 (para un informe encargado por el Parlamento Europeo [ 27 ]), y se actualizó en septiembre de 2024 para este artículo. Para identificar la literatura pertinente, buscamos artículos revisados por pares, así como literatura gris. Para los artículos revisados por pares, se realizó una búsqueda en MEDLINE a través de Pubmed y SCOPUS. La literatura gris se identificó mediante una búsqueda manual en varios sitios web, incluidos los del Parlamento Europeo, la Comisión Europea, la Organización para la Cooperación y el Desarrollo Económicos, la Organización Mundial de la Salud, la Organización Mundial del Comercio, la Organización Mundial de la Propiedad Intelectual, las autoridades públicas nacionales de los Estados miembros de la UE, la industria farmacéutica y las asociaciones mayoristas a nivel europeo y nacional. Además, se utilizaron Google Scholar y Google para identificar más informes y comunicados de prensa. La estrategia de búsqueda detallada, incluidos los criterios de elegibilidad, se puede encontrar en el Suplemento en línea (SI).
2.3 . Entrevistas de grupos focales
Se realizaron tres entrevistas grupales con actores nacionales de tres países (Austria, Francia y España), representando a responsables políticos, la industria farmacéutica y la investigación, para obtener información adicional y más detallada que posiblemente no esté incluida en la literatura. Para cada uno de los tres países seleccionados, se organizó un grupo focal compuesto por cuatro participantes de Austria, siete de Francia y solo dos de España, ya que uno de ellos canceló su participación con poca antelación. A continuación, se presenta un resumen de las instituciones entrevistadas.
Instituciones participantes en las entrevistas grupales focales.
| Austria | Ministerio Federal de Trabajo, Asuntos Sociales, Salud, Asistencia y Protección del Consumidor de Austria (BMASGPK) |
| Asociación Austriaca de la Industria de Genéricos (Österreichischer Generikaverband) | |
| Universidad de Ciencias Aplicadas de Krems | |
| Francia | Ministère de l’Economie, des Finances et de la souveraineté industrielle et numérique; Dirección general de empresas |
| SICOS Biochimie (organismo representativo de los fabricantes de productos químicos finos en Francia) | |
| Organización para la Cooperación y el Desarrollo Económicos (OCDE)* | |
| España | AFAQUIM (Asociación de empresas productoras de productos químicos para la salud) |
| Farmaindustria (Asociación Nacional de la Industria Farmacéutica de España) |
Nota: *Representante de Francia, pero aportando la perspectiva de una organización internacional.
2.3.1 . Selección de países
Los países para las entrevistas de los grupos focales se seleccionaron con base en tres criterios. En primer lugar, las entrevistas se centraron en países europeos de altos ingresos, en consonancia con el objetivo de la investigación; sin embargo, con variaciones en los ingresos nacionales. En segundo lugar, los países elegibles para ser seleccionados habían implementado medidas para fortalecer la producción local de API o habían anunciado planes para hacerlo. En tercer lugar, dichas iniciativas habían sido establecidas y financiadas, al menos parcialmente, por las autoridades públicas (es decir, no estaban impulsadas exclusivamente por la industria).
Como resultado, se seleccionaron Austria, Francia y España. Como valor añadido, la selección de estos países también garantiza una mezcla de países con diferentes características geográficas, ingresos y demografías (para obtener información sobre los criterios de selección de los países incluidos, véase la Tabla 1 ).
Tabla 1. Criterios para la selección de los países.
| País | Geografía | Habitantes | Índice de volumen per cápita por PIB* | Iniciativas de producción local de API apoyadas por los gobiernos |
| Austria | Europa Central | 9 millones | 123 | Desde 1946 existe un centro de producción de API, específicamente penicilina, en Kundl, Tirol (Austria) [ 42 ]. |
| En 2020, Novartis/Sandoz anunció una expansión de esa planta de fabricación de API, que según se informó estaba subvencionada por el gobierno austriaco (50 millones de euros de inversión aportados por el gobierno, 100 millones de euros por la empresa). | ||||
| Con el apoyo a esta ampliación, el gobierno austriaco espera garantizar la sostenibilidad de la planta de producción de Kundl durante los próximos diez años. | ||||
| Se esperaba que un aumento en la producción de penicilina pudiera ayudar a satisfacer la mayor demanda en Europa [ 32 ]. Sin embargo, faltan datos a largo plazo sobre el impacto del sitio de producción. | ||||
| En 2024 se anunció que el sitio de producción se ampliará aún más [ 43 ]. | ||||
| Francia | Europa Occidental | 68 millones | 101 | Una iniciativa gubernamental para impulsar la producción de API se refiere a la empresa fabricante EuroAPI, que produce una serie de API y medicamentos, incluidas prostaglandinas, esteroides y alcaloides. |
| El gobierno francés posee una participación del 12% en EuroAPI a través del banco público de inversión francés «EPIC Bpifrance». Otros accionistas son Sanofi, de donde surgió EuroAPI, con una participación del 30%, L’Oréal (5%) y Free float (5%) [ 44 ]. El gobierno se comprometió a un bloqueo de las acciones de EuroAPI durante 24 meses a través del banco de inversión, a partir del 17 de junio de 2022. | ||||
| En 2021, la empresa generó 770 millones de dólares estadounidenses en ventas de API [ 45 ]. | ||||
| Otra empresa de fabricación de API apoyada por el gobierno es Seqens, que produce principalmente paracetamol. | ||||
| En 2021, recibió el apoyo financiero del gobierno francés (94 millones de euros) a través del banco de inversión «EPIC Bpifrance» [ 46 ]. | ||||
| Sequens está ampliando continuamente sus capacidades y su cartera: sus unidades multipropósito producirán productos intermedios en el corto plazo y API en el largo plazo [ 47 ]. | ||||
| España | Europa del Sur | 48 millones | 88 | Está prevista una ampliación y escalado tecnológico del centro de producción de API de penicilina estériles y mezclas de API estériles de Sandoz en la comunidad española de Palafolls. |
| Además de la inversión de la empresa, que ronda los 50 millones de euros [ 33 ], se desconoce el importe de la subvención del gobierno español. | ||||
| Se informó que el sitio de fabricación de API se beneficiará de las inversiones en Kundl, ya que la producción de API estériles se trasladará de Kundl a Palafolls en 2025 [ 48 ]. |
Abreviaturas: API = Ingrediente farmacéutico activo; PIB = Producto Interno Bruto.
Fuente: Habitantes [ 49 ], ingresos [ 50 ], fuentes de datos para las iniciativas de producción local incluidas en la Tabla. Nota: API = ingrediente farmacéutico activo. *Se utilizó como medida el índice de volumen por PIB, tal como lo utiliza la Comisión Europea para la comparación internacional de datos contables a nivel nacional.
2.3.2 . Selección de grupos de interés y entrevistas
Consideramos esenciales tres grupos de interés para conocer sus perspectivas: la industria farmacéutica, los responsables políticos y la investigación. Se reclutaron investigadores, tanto académicos como de investigación aplicada, con formación en economía (de la salud), en particular con experiencia en el contexto de la relocalización. Se esperaba que los entrevistados que representaban a estos grupos de interés conocieran las iniciativas y planes de sus países para fortalecer la producción local de API y que pudieran participar en un debate en inglés o alemán.
2.3.3 . Procedimiento y análisis de datos
Para cada uno de los tres países del estudio de caso, los autores organizaron un grupo focal con representación planificada de los tres grupos de partes interesadas. Las entrevistas del grupo focal se llevaron a cabo en línea a través de Zoom en octubre y noviembre de 2023. Se programó que los grupos focales duraran alrededor de 90 minutos y se llevaron a cabo en inglés o alemán. Una guía de entrevista semiestructurada (ver Suplemento SII), el formulario de consentimiento informado y una breve información sobre las iniciativas de reshoring de los países seleccionados se enviaron a los participantes antes de la entrevista. Las tres entrevistas del grupo focal se grabaron y transcribieron textualmente. Las grabaciones se utilizaron únicamente para fines internos (transcripción y análisis) y no se publicarán. Para asegurar la calidad de los hallazgos, las notas de las entrevistas fueron validadas por los entrevistados. Con base en las transcripciones, se realizó un análisis de contenido cualitativo según Mayring [ 51 ]. Se aplicó un enfoque deductivo, determinando tres categorías principales (barreras, facilitadores, prerrequisitos), así como varias subcategorías que se derivaron de la literatura antes del análisis de las transcripciones. Se incluyeron subcategorías adicionales de forma inductiva a lo largo del procedimiento de codificación, seguido de debates entre los autores para garantizar la distinción y claridad de las categorías y la validez del análisis [ 51 ]. Luego, los hallazgos se resumieron e interpretaron en función de las categorías principales.
3 . Resultados
Las siguientes subsecciones se estructuran de la siguiente manera: primero, se describen los hallazgos de la revisión bibliográfica y, posteriormente, se presentan los hallazgos de las entrevistas grupales. Ambas secciones se agrupan en las categorías principales: barreras, facilitadores y prerrequisitos, seguidas de una evaluación de viabilidad.
3.1 . Resultados de la revisión bibliográfica
En total, la búsqueda bibliográfica arrojó 1246 registros, de los cuales 1195 artículos (títulos y resúmenes) se evaluaron según criterios predefinidos. De los registros examinados, se seleccionaron 39 para un análisis exhaustivo (16 artículos científicos y 23 documentos clasificados como literatura gris). La búsqueda detallada se documenta en el diagrama de flujo PRISMA
3.1.1 . Barreras para la relocalización de la producción de API en Europa
Como barrera principal, que podría dificultar la reubicación de la producción de API a ciertos países europeos o a Europa en general, la literatura reportó costos relativamente altos para la fabricación en Europa en comparación con Asia; en particular, se mencionaron los costos de inversión y los costos de personal [ 23 , [52] , [53] , [54] , [55] , [56] ]. Además, se informó que la implementación de estándares más altos para cumplir con regulaciones estrictas e impuestos y tarifas locales era un factor adicional para aumentar los costos operativos para los productores europeos [ 56 ]. Por ejemplo, la literatura se relaciona con las diferencias en los estándares ambientales entre Europa y Asia como una barrera para producir en Europa, ya que el cumplimiento de estándares más altos implica costos más altos [ 52 ]. Se argumentó que en Europa, la rentabilidad de ciertos API puede ser menor ya que las economías de escala son más difíciles de lograr [ 22 , 57 ]. Esto se debe al hecho de que la producción europea se centra en API más complejas y de bajo volumen, mientras que los sitios de producción asiáticos producen API de mayor volumen y baja complejidad, para los cuales las economías de escala son más fáciles de lograr [ 58 ]. Según la literatura, el enfoque en producir API más complejas en Europa también refuerza la vacilación de la industria europea para relocalizar su producción en países europeos [ 59 ]. Otra barrera para la relocalización mencionada en la literatura son las prácticas de licitación actuales y las políticas de precios en Europa, que, según estudios y documentos de posición incluidos en la revisión, se centrarían en reducir los precios. En consecuencia, esto resultaría en menores ganancias para los proveedores europeos, en particular a la luz de que los costos en Europa superan a los de Asia [ 22 , 54 , 57 , 60 ].
3.1.2 . Facilitadores para la relocalización de la producción de API en Europa
Según la literatura, la razón para relocalizar la producción de API a Europa (ya sea a países específicos o a Europa en general) radica en su potencial para mejorar la competitividad de los mercados europeos. El aumento de la producción de API en Europa brinda a los gobiernos y a la industria la oportunidad de dirigir la producción hacia los medicamentos más necesarios [ 22 , 52 ] y beneficiarse de una mayor flexibilidad [ 61 ]. Según Raza et al., 2021, también permite una mejor preparación para emergencias, mejorando la capacidad local para responder a fluctuaciones repentinas en la demanda, como las precipitadas por escasez o pandemias [ 22 ]. La literatura también sugiere que la calidad de los API producidos localmente en Europa puede ser superior a la de los producidos en Asia [ 22 , 52 , 61 ]. Bornert et al. argumentaron que algunos impulsores para relocalizar la producción a Europa también parecen deberse a problemas asociados con la fabricación de productos en el extranjero, como procedimientos de coordinación complejos, alta rotación de personal o flexibilidad limitada [ 61 ]. Además, la literatura destacó la importancia del compromiso político para relocalizar la producción de API a Europa. El compromiso político de relocalizar la producción de API en Europa, para acelerar y asegurar el suministro mediante un transporte más corto, se suma a la situación de apoyo de los sitios de producción existentes para API en Europa [ 52 , 54 , 57 ]. Además, la fuerza laboral en Europa se considera altamente calificada en términos de conocimientos técnicos, lo que es una ventaja de ubicación y también puede facilitar la relocalización [ 52 , 61 ]. El transporte reducido a través de la producción en Europa y, por lo tanto, una cadena de suministro más corta no solo son una ventaja en términos de seguridad de suministro, sino que también se consideran beneficiosos para el medio ambiente [ 52 , 61 ]. En tiempos de cambio climático, las implicaciones ambientales de la producción local también podrían orientar una decisión a favor de la relocalización. Además, la literatura mencionó criterios de sostenibilidad más estrictos en Europa en comparación con Asia, que facilitan prácticas de producción conscientes del medio ambiente; nuevamente, dada la mayor conciencia para la protección del medio ambiente, las regiones con estándares ambientales más altos pueden volverse atractivas para la relocalización. En la literatura, los subsidios y otros incentivos financieros (por ejemplo, exenciones fiscales) para repatriar la producción de API a Europa se consideran facilitadores importantes y prerrequisitos, ya que se informó que estas medidas financieras impactan fuertemente la viabilidad económica de las iniciativas de repatriación para la industria [ 5 , 13 , 60].]. Además, el uso de tecnologías de producción avanzadas puede respaldar los procesos de producción de API, puede mejorar la competitividad de los mercados europeos y, por lo tanto, podría facilitar las decisiones a favor de la relocalización [ [60] , [61] , [62] , [63] ]. Finalmente, se mencionaron como ejemplos de buenas prácticas las acciones coordinadas y colaborativas entre las partes interesadas, por ejemplo, mediante el intercambio de datos o el uso conjunto de infraestructura [ 23 , 55 ].
3.1.3 . Requisitos previos para la relocalización de la producción de API
La literatura también hizo referencia a ciertas circunstancias, políticas o marcos que se consideran establecidos para traer la producción de API de vuelta a Europa. En primer lugar, algunas piezas de la literatura consideran los subsidios, en forma de impuestos o tasas reducidas para los API producidos localmente, como un prerrequisito para que los fabricantes produzcan API en Europa [ 62 , 63 ]. Se consideran necesarias mayores ganancias en los mercados europeos para que la industria europea amplíe su producción de API [ 5 , 54 , 64 , 65 ]. En segundo lugar, la literatura también argumentó que los compradores en los países europeos necesitarían cambiar sus procedimientos de licitación actuales (por ejemplo, considerar criterios de adjudicación adicionales al precio) para incitar a los productores de API a decidir sobre la relocalización [ 54 , 66 ]. En tercer lugar, la literatura sugiere que una fuerte interacción y colaboración entre todas las partes interesadas relevantes podría tener un impacto en las decisiones de relocalizar la producción, es decir, entre los actores relevantes del sistema como los formuladores de políticas y la industria [ 31 , 65 , 67 , 68 ].
3.1.4 . Viabilidad de la relocalización de la producción de API en Europa según la literatura.
Si bien la literatura reportó barreras, facilitadores y también algunos prerrequisitos para reshoring producción de API a Europa, se encontraron muy pocos estudios que comentaran sobre la viabilidad de esta iniciativa. Los pocos estudios que lo hicieron concluyeron que reshoring sería factible, sin embargo solo para un número limitado de API. Se argumentó que el enfoque debería ponerse en API críticas [ 56 , 66 ] sin especificar razones. Aun así, este proceso sería lento y tomaría varios años [ 56 ]. Además, se argumentó que evaluar la viabilidad de reshoring producción de API a países europeos no sería una decisión simple y única, sino que requeriría una toma de decisiones multicriterio [ 60 ].
Los resultados de la revisión de la literatura, con indicaciones de las fuentes individuales, se incluyen en el Suplemento (SIII).
3.2 . Resultados de las entrevistas de los grupos focales
3.2.1 . Barreras, facilitadores y requisitos previos para la relocalización de la producción de API en Europa
Los hallazgos clave de las tres entrevistas de grupos focales se resumen en la Tabla 2 (para más detalles, véase la tabla de descripción general más detallada que incluye citas de entrevistas en el Suplemento SIV).
Tabla 2. Recopilación de los hallazgos clave de los grupos focales.
| Subcategorías basadas en las entrevistas | Descripción de la categoría | Indicación de las partes interesadas | ||
| Barreras para la relocalización de la producción de API en Europa | ||||
| Costos de producción e inversión en Europa comparados con Asia | Los componentes importantes de los costos de producción, como el costo de la energía y la mano de obra, son más altos en Europa que en los países asiáticos. Además del costo actual, las actividades para iniciar la producción local como parte de la relocalización requerirían una inversión inicial elevada. | – | I | R |
| Complejidad de la producción de APIs | La instalación y gestión de la producción de API requiere la experiencia adecuada. Es posible que aún sea necesario establecer o ampliar estos conocimientos técnicos. Se argumentó que el nivel de conocimientos técnicos necesario para la producción local en Europa es probablemente mayor que en Asia, ya que en Europa se producen principalmente API más complejos. Además, la dependencia de otros proveedores para obtener materias primas y auxiliares para la producción de ciertos API (para los cuales no es posible relocalizar todos los pasos de la cadena de suministro) también puede aumentar la complejidad. | P.M | I | R |
| Diseño actual de los procedimientos de contratación | Los procedimientos de contratación actuales son percibidos como restrictivos por las partes interesadas, ya que el precio suele ser el único criterio de adjudicación y las licitaciones suelen organizarse con un solo ganador. Existe la preocupación de que estas prácticas de contratación puedan desincentivar a los proveedores a presentar ofertas. | P.M | I | R |
| Barreras en el marco legal y organizativo | Los estándares legales y regulatorios en Europa son más altos (por ejemplo, mayores costos de inversión, criterios de sostenibilidad más estrictos), lo que requiere mayores esfuerzos organizacionales, probablemente desacelera los procesos y crea costos adicionales para las empresas. | – | I | R |
| Altos estándares medioambientales en Europa | Los altos estándares medioambientales de Europa en comparación con los países asiáticos hacen que sea más difícil trasladar la producción de API a Europa, principalmente debido a los costes adicionales. | P.M | I | – |
| Facilitadores para la relocalización de la producción de API en Europa | ||||
| Preparación para emergencias | Un sistema de salud (incluido su entorno político) con posibles soluciones a largo plazo para abordar la seguridad del suministro, incluida una mejor reacción a las fluctuaciones de la demanda. | P.M | I | – |
| Visión estratégica y política para la relocalización | Un entorno en el que los responsables de las políticas ofrecen una visión clara de la relocalización y en el que se han puesto en práctica objetivos definidos para fomentarla a nivel nacional e internacional (por ejemplo, mediante el establecimiento y la comunicación de las condiciones que las empresas deben cumplir para ser elegibles para recibir apoyo (financiero). | P.M | I | R |
| Un enfoque político europeo coordinado y alineado con las soluciones nacionales | Se consideró favorable la coordinación de la UE sobre las prioridades relacionadas con la relocalización de la producción de API a Europa. Esto incluiría la claridad en temas relacionados, como el posible aumento de la capacidad de producción y la diversidad, y el trabajo hacia la armonización, cuando sea posible, en áreas como la política industrial, el mercado laboral y las normas medioambientales, que puedan incidir en las decisiones sobre relocalización y producción local. | P.M | I | R |
| Compromiso político y de las partes interesadas | El compromiso de los dirigentes políticos y de las partes interesadas de la industria de invertir en la producción local de medicamentos críticos en sus países y a nivel de la UE, ya que, como se argumentó, esto contribuiría a mejorar la atención a los pacientes. | P.M | I | R |
| Inversiones en tecnologías de producción innovadoras | La innovación en la fabricación y las habilidades (en términos de personal y conocimientos técnicos) se mencionó como un factor que contribuye a mejorar la competencia y a aumentar la eficiencia. Un representante del sector mencionó, por ejemplo, la transición de la síntesis química tradicional de ingredientes activos a una síntesis enzimática de ingredientes activos, menos perjudicial para el medio ambiente, con mayor rendimiento y mayor eficiencia. | P.M | I | R |
| Mayor transparencia en la cadena de suministro | Una imagen más transparente de las responsabilidades de los diferentes actores involucrados en el sistema y la cadena de suministro (especialmente las empresas en diferentes etapas de la producción, por ejemplo, cumpliendo con la Buena Documentación y las Operaciones de Fabricación, producción de materiales terminados) se percibe como un facilitador para la relocalización de la producción. | P.M | – | – |
| Legislación, políticas y prácticas actualizadas que premian el cumplimiento de las normas ambientales | Un ejemplo que se menciona frecuentemente se refiere a la aplicación de otros criterios de adjudicación además del precio en los procedimientos de licitación (por ejemplo, criterios medioambientales) y su recompensa suficiente. | P.M | I | R |
| Requisitos previos para relocalizar la producción de API en Europa | ||||
| Condiciones de mercado sostenibles para producir en Europa | Según las partes interesadas, garantizar la demanda del mercado y las condiciones del mercado que valoricen la producción europea son esenciales para incentivar a los proveedores a mantener y aumentar la producción de API en Europa. | P.M | I | R |
| Subvenciones financieras | Los sistemas de incentivos, incluida la financiación de CapEx (asignación de recursos financieros para gastos de capital), la financiación de inversiones, etc., pueden contribuir a aumentar la viabilidad económica de los proveedores para trasladar la producción a Europa. | P.M | I | R |
| Lista prioritaria de API críticas que se reubicarán en Europa | Las partes interesadas consideran necesario establecer una lista de API y priorizar las API críticas que se producirán en Europa. Esta lista crítica debería establecerse y coordinarse a nivel de la UE. También puede ayudar a evaluar los costes de la producción local y la posible relocalización de ciertas API. | P.M | I | R |
| Menos trámites burocráticos en Europa | Se considera un requisito indispensable unos procesos menos burocráticos y más rápidos para la ampliación de expedientes y de las capacidades de producción de los proveedores. | – | I | – |
| Voluntad, cooperación y responsabilidad de los actores del sistema para producir localmente | La capacidad, la voluntad y la acción responsable de las partes interesadas en el sistema son necesarias para producir API en Europa, ya que las partes interesadas (por ejemplo, los tomadores de decisiones y la industria) deben cooperar para crear con éxito un marco que haga posible (en términos de condiciones financieras y legales) relocalizar la producción. | P.M | I | R |
Nota: Indicación de las partes interesadas: PM = Perspectiva de formulación de políticas, I = Perspectiva de la industria, R = Perspectiva de investigación
Según las partes interesadas entrevistadas, la relocalización de la producción de API a Europa requiere una visión estratégica y una estricta coordinación de políticas en la UE, junto con un alto nivel de compromiso político y preparación para invertir. Además, mejorar la transparencia del sistema podría facilitar una mejor coordinación y fortalecer la acción responsable de las diferentes partes interesadas. La barrera mencionada con más frecuencia para la relocalización son los mayores costos de producción e inversión en Europa en comparación con Asia, que también se deben a las complejas propiedades de los API producidos en Europa y los numerosos pasos involucrados en su cadena de suministro. Se informó que varias condiciones y factores funcionan como prerrequisitos clave para el éxito de la relocalización. Estos incluyen condiciones de mercado favorables, actualizaciones legislativas, subsidios financieros y un enfoque en una lista priorizada de API para ser relocalizados. Los cambios legislativos, en particular, son percibidos como prerrequisitos y facilitadores del proceso de relocalización por algunas partes interesadas.
En general, varios factores identificados en las entrevistas coincidieron con los reportados en la revisión bibliográfica. Además, se identificaron otros factores adicionales en las entrevistas. La figura 2 presenta la coincidencia entre ambas fuentes, destacando los factores identificados tanto en la revisión bibliográfica como en las entrevistas, así como los específicos de cada fuente.
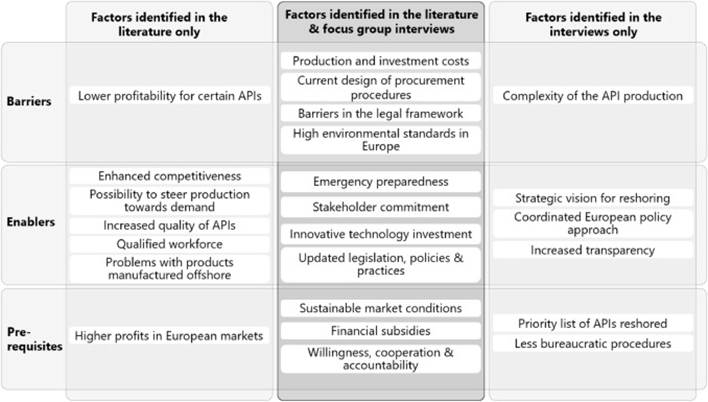
Fig. 2. Resumen de barreras, facilitadores y prerrequisitos identificados en el estudio a través de diferentes métodos.
3.2.2 . Viabilidad de la relocalización de la producción de API según las partes interesadas
Si bien las partes interesadas entrevistadas de Francia y España consideraron viable la relocalización en determinadas circunstancias, las de Austria destacaron las barreras, como los altos costos y la alta complejidad de la producción. Dado que los materiales producidos en Asia seguirían siendo necesarios para otras partes de la cadena de suministro, se enfatizó la dependencia persistente de los productores asiáticos. Las partes interesadas de España se mostraron especialmente a favor de la relocalización como enfoque. En comparación con otras opciones para prevenir la escasez de medicamentos (por ejemplo, el acaparamiento), argumentaron que la relocalización podría tener un efecto positivo en el sistema de salud y fortalecería el suministro en Europa. Las partes interesadas francesas también apoyaron la relocalización, pero consideraron que la relocalización de la producción solo es viable para ciertos principios activos farmacéuticos (PI).
La viabilidad de la relocalización fue evaluada de manera diferente por los grupos de partes interesadas entrevistadas. Los representantes de la formulación de políticas y la investigación tendieron a ser más bien reacios a sacar una conclusión concreta sobre la viabilidad de la relocalización. Por ejemplo, las partes interesadas de Austria y Francia, en particular, arrojaron luz sobre el hecho de que los subsidios financieros son necesarios para considerar la relocalización viable. Todas las partes interesadas enfatizaron que, además de las iniciativas de relocalización, el fortalecimiento de la producción local de API y medicamentos en general (por ejemplo, invirtiendo y apoyando a los sitios de fabricación que aún se encuentran en Europa) sería un paso importante para asegurar el suministro de medicamentos a largo plazo. Los entrevistados expresaron la esperanza de que la relocalización no solo abordaría la escasez de medicamentos, sino que también mejoraría la transparencia en la cadena de suministro e impulsaría la economía de Europa. Si bien todas las partes interesadas consideraron que la inversión en la producción local de API y medicamentos era una prioridad, no hubo consenso sobre la viabilidad de la relocalización de la producción de API.
4 . Discusión
El objetivo de esta investigación fue explorar la evaluación de las partes interesadas con respecto a la viabilidad de relocalizar la producción de API a los países europeos basándose en la identificación de barreras clave, facilitadores y prerrequisitos para hacerlo. Los hallazgos de esta investigación sugieren que la relocalización se considera factible si se cumplen ciertos prerrequisitos. Estos últimos incluyen, en particular, incentivos financieros y el compromiso de las partes interesadas, lo que subraya la importancia de contar con un marco que motive tanto a las empresas como a los gobiernos a trabajar en conjunto. Un enfoque coordinado para las áreas políticas relevantes a nivel de la UE y la innovación en tecnologías de producción también se identificaron como facilitadores importantes, ya que la formulación de políticas que se alineen con las necesidades del sector farmacéutico puede crear un entorno favorable para el desarrollo sostenible. Se encontró que los avances en tecnologías como la inteligencia artificial y la robótica, y en particular la fabricación continua de API [ 69 ], contribuyen a un mejor acceso a los medicamentos al reformar la forma de producción en estudios previos [ 70 ], lo que también podría ser beneficioso al relocalizar la producción a Europa, permitiendo así mejorar la calidad y reducir los tiempos de entrega. Sin embargo, la confluencia de mayores costos y menores economías de escala en Europa en comparación con Asia y un entorno empresarial en Europa que se percibe como de precios bajos y baja rentabilidad por parte de los proveedores pueden plantear barreras significativas para la reubicación de la producción de API a Europa, lo que requiere un análisis exhaustivo de las soluciones potenciales para mitigar estas desventajas y convertirlas en oportunidades de crecimiento para el sector.
Si bien los hallazgos de la literatura y las entrevistas fueron coherentes en términos de beneficios y desafíos para la relocalización de la producción de API y el potencial de la relocalización para hacer que la cadena de suministro sea más resiliente no fue cuestionado, no se encontró consenso con respecto a la viabilidad de la relocalización con base en las opiniones de las partes interesadas. Ambos ejercicios de recopilación de datos realizados para este documento encontraron la coordinación europea de las iniciativas de políticas de relocalización y los subsidios financieros como facilitadores o incluso prerrequisitos, y los altos costos en Europa relacionados con la producción o el marco regulatorio en Europa en comparación con Asia como la principal barrera para la relocalización. Si bien no se reportó ninguna declaración significativa sobre la viabilidad de la relocalización en la literatura, las opiniones de las partes interesadas encontradas en las entrevistas de los grupos focales difirieron. Se observó que la viabilidad se evaluó con base en la existencia de ciertos prerrequisitos, como incentivos financieros. En general, la preparación de los representantes de la industria para la relocalización dependió del país. Los participantes de Austria argumentaron que se debe dar prioridad al fortalecimiento y mantenimiento de la producción local en su nivel actual dentro del país para evitar que las empresas reubiquen su producción de Europa a Asia, es decir, la deslocalización. Sin embargo, se desconoce la justificación de este argumento. Cabe especular que, en países que ya cuentan con una importante producción de API, la relocalización podría no estar alineada con las prioridades de la política industrial del país, o que las partes interesadas están bastante familiarizadas con los desafíos de la producción local. Las partes interesadas austriacas también destacaron en particular que la producción de API es solo una parte de la cadena de suministro, y que la consideración de otras partes de la cadena es igualmente importante para mejorar su resiliencia. La sólida producción local en Austria podría haber contribuido a la reticencia de las partes interesadas austriacas entrevistadas a evaluar la viabilidad de la relocalización.
El propósito principal de las entrevistas fue proporcionar ejemplos de casos ilustrativos y capturar perspectivas adicionales que pueden no haberse reflejado completamente en la literatura publicada. Por lo tanto, observamos que nos abstuvimos de extraer conclusiones importantes con respecto a las diferencias transnacionales o intentar comparaciones sistemáticas entre los grupos de partes interesadas. Lo que se hizo evidente tanto en la revisión de la literatura como en las entrevistas fue que la delimitación entre las categorías no siempre fue clara (en particular, entre facilitador y prerrequisito); o los factores eran aplicables a múltiples categorías dependiendo del contexto. Por ejemplo, los subsidios financieros fueron considerados necesarios (es decir, un prerrequisito) por algunas fuentes o partes interesadas, mientras que otras piezas de literatura y partes interesadas los consideraron como «agradable de tener» (es decir, un facilitador). Los estándares ambientales más altos en Europa en comparación con Asia se consideraron un factor facilitador, ya que sugieren una mayor conciencia del medio ambiente en general, y una barrera debido a los mayores costos relacionados con una regulación más estricta.
Para la interpretación de los hallazgos, debe reconocerse que se preguntó a los entrevistados sobre su evaluación, que puede reflejar opiniones personales, percepciones y el contexto de su propio país. Además, alguna literatura incluida, como los documentos de posición, proporciona evaluaciones de las partes interesadas. Por ejemplo, si bien los contratos de adquisición adjudicados solo por precio fueron criticados en la literatura y en algunas entrevistas, es importante señalar que la Directiva 2014/24/UE del Parlamento Europeo y del Consejo, de 26 de febrero de 2014, sobre contratación pública, ya fomenta el uso de los criterios MEAT (oferta económicamente más ventajosa) [ 71 ], que comprenden varios criterios de adjudicación, incluido el precio. La propuesta de la Comisión de la Ley de medicamentos críticos incluso solicita el uso obligatorio de los criterios MEAT [ 20 ]. Además, parece bastante improbable que las decisiones sobre la relocalización se vean significativamente influenciadas por las prácticas de adquisición dentro de los países individuales, dado que las empresas que fabrican API generalmente sirven a un mercado global. Además, las licitaciones que se mencionaron como una barrera potencial se refieren principalmente a productos terminados en lugar de API.
Si bien existe una falta general de estudios centrados específicamente en la relocalización de la producción de API, los hallazgos de este estudio son coherentes con la investigación existente. Por ejemplo, un estudio de Baraldi et al. (2022) mencionó beneficios y desafíos similares para la relocalización de API en el contexto sueco. Sin embargo, el estudio se centró específicamente en los API para antibióticos [ 52 ]. Al igual que hallazgos anteriores [ 60 ], esta investigación confirmó que la evaluación de la viabilidad de la relocalización requiere un enfoque multifacético que considere factores económicos, ambientales, estratégicos y técnicos.
El llamado a un enfoque de política europea para apoyar la relocalización de API puede considerarse uno de los principales resultados de este estudio. Con base en los desarrollos recientes, se puede esperar progreso en una mayor expansión de la producción local e incentivos de relocalización a nivel de la UE. Además de medidas a corto plazo para mitigar la escasez de medicamentos, se prevén medidas a largo plazo para garantizar la seguridad del suministro de medicamentos a través de la Ley de Medicamentos Críticos (CMA), que fue propuesta por la Comisión Europea en marzo de 2025. Si bien no aborda específicamente la relocalización como un concepto, llama a fortalecer la producción local en la Unión Europea y reducir las dependencias de los proveedores de API del extranjero [ 20 ]. En particular, la CMA de la UE, si se adopta como se propone, abordaría varios facilitadores y prerrequisitos identificados en este estudio y establecería una acción sólida para el compromiso político a largo plazo.
Este estudio tiene algunas limitaciones. A pesar de aclarar el concepto de reshoring al inicio de las entrevistas de los grupos focales para llegar a un entendimiento común, la diferenciación entre reshoring de la producción de API y la producción local de API no siempre fue clara durante las entrevistas. Esto también apareció en investigaciones anteriores donde se usaron diferentes términos mientras se abordaba el mismo concepto de reshoring [ 40 ]. En algunos casos, las perspectivas de los entrevistados también se centraron en la seguridad del suministro de medicamentos y el acceso de los pacientes en general, sin centrarse en las especificidades de la reshoring. La generalización de los hallazgos de los grupos focales es limitada, ya que se centraron únicamente en tres países, todos ellos países de altos ingresos. Otras selecciones de países podrían producir diferentes perspectivas sobre la viabilidad de reshoring de API a Europa (por ejemplo, los entrevistados de países de Europa del Este con un historial de producción local podrían haber ofrecido diferentes perspectivas). Además, el número de participantes y la variedad de perspectivas de las partes interesadas en las entrevistas de los grupos focales fueron limitados, en particular para las entrevistas con las partes interesadas de España. A pesar de su alcance limitado, creemos que los resultados de los grupos focales ofrecen información complementaria valiosa sobre los temas, proporcionando así perspectivas adicionales a las de la literatura.
Aunque este estudio no pudo extraer una conclusión clara sobre la viabilidad de la relocalización, mostró que la decisión de relocalizar la producción de API es compleja y requiere un proceso de toma de decisiones con múltiples criterios para evaluar si la relocalización es razonable y factible en el contexto específico del país. Se deben considerar aspectos económicos, legales, ambientales y técnicos tanto desde el lado de la oferta como de la demanda para determinar si la relocalización de la producción de API a Europa es razonable y factible. De manera similar a hallazgos anteriores, este estudio también enfatiza la importancia de comprender el impacto que una política puede tener en un contexto determinado (nacional y a nivel de la UE) y entre una cierta combinación de políticas [ 72 , 73 ]. Si bien la relocalización de API puede contribuir a mitigar la escasez de medicamentos, como se encuentra en la literatura, las entrevistas de los grupos focales indican que la implementación de dicha política requiere una comprensión profunda de cómo las partes interesadas nacionales ven y se comprometen con dichas acciones a nivel nacional.
5 . Conclusión
Esta investigación evaluó la viabilidad de relocalizar la producción de API en Europa, basándose en una revisión sistemática de la literatura y entrevistas grupales con representantes de las partes interesadas de la investigación, la formulación de políticas y la industria farmacéutica. Entre los factores que favorecen, o incluso son esenciales, la relocalización de la producción de API en Europa se incluyen el compromiso de las partes interesadas, los incentivos económicos y la innovación en el progreso tecnológico, mientras que los altos costos relacionados con la producción, el personal y los requisitos regulatorios se perciben como una barrera importante. Reconociendo los desafíos de la relocalización, un marco político estratégico integral, así como una sólida colaboración entre las partes interesadas a nivel de la UE, son esenciales para su éxito. Si bien una combinación de políticas y una toma de decisiones con múltiples criterios se consideran esenciales para prevenir la escasez de medicamentos, la relocalización puede contribuir a la resiliencia de la cadena de suministro y, por lo tanto, ayudar a mitigar la escasez en cierta medida. Además, es fundamental fomentar un entorno que priorice la sostenibilidad y la reducción del impacto ambiental, ya que estas consideraciones juegan un papel cada vez más crucial en la industria farmacéutica moderna. Por otro lado, la adaptación a las regulaciones cambiantes y el fortalecimiento de las capacidades locales también son aspectos que deben ser considerados cuidadosamente para garantizar que la balanza se incline a favor de una producción local más eficiente y responsable.
Soberanía Sanitaria
Me gustaMe gusta
Excelente reflexión del Dr Carlos Diaz respecto a la Soberanía Sanitaria, definiendola como la capacidad del Estado para asegurar a su población un acceso a la salud, medicamentos y recursos esenciales, independientemente de la necesidad de importar los mismos.
Me gustaMe gusta