- Claudio Fenizia, Mara Biasin, Irene Cetin, Patrizia Vergani, Davide Mileto, Arsenio Spinillo, María Rita Gismondo, Francesca Perotti, Clelia Callegari, Alessandro Mancón, Selene Cammarata, Ilaria Beretta, Nebuloni, Daria Trabattoni, & Valeria Savasi
Nature Communications volume 11, Número de artículo: 5128 (2020)
El impacto de la infección por SARS-CoV-2 durante la gestación sigue sin estar claro. Aquí, analizamos el genoma viral en hisopos nasofaríngeos maternos y neonatales, hisopos vaginales, plasma de cordón materno y umbilical, biopsias de placenta y cordón umbilical, fluidos amnióticos y leche de 31 madres con infección por SARS-CoV-2. Además, también probamos anticuerpos anti-SARS-CoV-2 específicos y la expresión de genes implicados en respuestas inflamatorias en placentas, y en plasma de cordón materno y umbilical. Detectamos el genoma del SARS-CoV-2 en una sangre de cordón umbilical y en dos placentas a término, en una mucosa vaginal y en una muestra de leche. Además, informamos de la presencia de anticuerpos específicos anti-SARS-CoV-2 IgM e IgG en una sangre de cordón umbilical y en una muestra de leche. Finalmente, en los tres casos documentados de transmisión vertical, la infección por SARS-CoV-2 fue acompañada de una fuerte respuesta inflamatoria. Juntos, estos datos apoyan la hipótesis de que en el útero la transmisión vertical SARS-CoV-2, aunque baja, es posible. Estos resultados podrían ayudar a definir el manejo obstétrico adecuado de las mujeres embarazadas COVID-19, o indicaciones putativas para el modo y el momento del parto.
Se sabe que las adaptaciones fisiológicas maternas al embarazo aumentan el riesgo de desarrollar enfermedades graves en respuesta a infecciones virales, como la gripe; los datos preliminares sugieren que el pronóstico de la infección por coronavirus 2 (SARS-CoV-2) del síndrome respiratorio agudo grave también podría ser más grave en mujeres embarazadas8. Nunca se documentó la transmisión vertical del SARS-CoV y del síndrome respiratorio de Oriente Medio (MERS), los otros dos coronavirus animales conocidos por infectar a los seres humanos. Sin embargo, el número de casos notificados de mujeres embarazadas infectadas fue muy bajo y no suficiente para extraer conclusiones firmes (12 casos notificados de SARS-CoV y 11 para MERS)9,10. Por el contrario, a medida que el número de pacientes con SARS-CoV-2 positivos está aumentando en todo el mundo, múltiples informes se centran en las mujeres embarazadas con SARS-CoV-2 positivos11,12,13,14,15,16. No se detectó rastro del virus por PCR en tiempo real11,12,14,15,17; sin embargo, dos manuscritos independientes describieron los niveles elevados de inmunoglobulina G (IgG) específica del SARS-CoV-2 y de anticuerpos IgM en la sangre de tres recién nacidos de madres infectadas por ELS-CoV-218,19. Como el IgG, pero no el IgM, normalmente se transfieren a través de la placenta, esto sugiere una infección en el útero18,19. Además, se informó que la submembrana placentaria y el cotiledones eran positivos para el virus en un aborto espontáneo de 20 semanas de una mujer embarazada con SARS-CoV-2 positiva20.
Como se ha informado recientemente, los dos receptores conocidos SARS-CoV-2 enzima convertidora de angiotensina 2 (ACE2) y transmembrana proteasa serina 2 están ampliamente diseminados en tipos celulares específicos de la interfaz materno-fetal21. Por lo tanto, el impacto del virus en la placenta y el potencial de transmisión vertical del SARS-CoV-2 deben abordarse con cuidado.
Aquí, informamos de la presencia del genoma del SARS-CoV-2 en la sangre del cordón umbilical y en las placentas a término, en la mucosa vaginal de las mujeres embarazadas y en la muestra de leche. Además, informamos de la presencia de anticuerpos específicos anti-SARS-CoV-2 IgM e IgG en la sangre del cordón umbilical de las mujeres embarazadas, así como en un espécimen de leche. Por último, una respuesta inflamatoria intensa es provocada por la infección por SARS-CoV-2 en mujeres embarazadas tanto a nivel sistémico como placentaria y, con respecto a la realidad, en el plasma sanguíneo del cordón umbilical. En conjunto, estos resultados sugieren que, aunque raro, SARS-CoV-2 en la transmisión vertical del útero es posible y que el conocido estado inflamatorio relacionado con SARS-CoV-2 se extiende a los fetos. Comprender el comportamiento biológico del virus durante el embarazo es esencial para definir el manejo obstétrico adecuado de las mujeres embarazadas con COVID-19.
Resultados
Población
Cuatro pacientes fueron clasificados como casos graves, definidos por la necesidad de un parto urgente para el deterioro de las afecciones maternas o por la admisión de la Unidad de Cuidados Intensivos (UCI) y los cuidados intensivos. Se obtuvo una confirmación radiológica de neumonía intersticial en el ingreso o anteparto para todos los casos graves y en 10 (32%) de los casos leves. El tratamiento farmacológico durante el período anteparto de la hospitalización se notifica en la Tabla 1. En el único caso grave de parto prematuro (sujeto n.o 17), se administraron corticoesteroides para la profilaxis del síndrome de dificultad respiratoria.
Los resultados maternos y del embarazo en la población del estudio se notifican en la Tabla 2. En cuanto al modo de parto, tres pacientes se sometieron a un parto de emergencia para indicación respiratoria materna. Entre los casos graves, se necesitó la admisión posparto en la UCI y la ventilación invasiva durante 11 días en total.
| Población total del estudio n.o 31 | |
|---|---|
| Modo de entrega | |
| Vaginal, n (%) | 25 (81) |
| Cesárea, n (%) | 6 (19) |
| GA en el momento del parto, semanas medianas (rango) | 39 (34.4–41.4) |
| Inducción de la entrega relacionada con COVID-19, n (%) | 6 (19) |
| Cesárea para enfermedades maternas graves relacionadas con COVID-19, n (%) | 3 (9) |
| Entrega prematura, n (%) | 1 (3) |
| Género fetal, masculino, n (%) | 18 (58) |
| Peso al nacer, g, mediana (rango) | 3200 (2180–4165) |
| PH de la arteria umbilical, mediana (rango) | 7.31 (7.14–7.43) |
| Puntuación APGAR 5′ <7, n (%) | 1 (3) |
| Neonatos infectados, positivos, n (%) | 2 (6) |
| Admisión de niCU, n (%) | 2 (6) |
| Piel a piel, n (%) | 4 (13) |
| Lactancia materna, n (%) | 29 (94) |
El sujeto no 31 se convirtió en negativo en la semana 35 del embarazo y dio a luz espontáneamente en la semana 38. Excepto en un caso (sujeto no 17), todos los embarazos fueron a término. El sujeto no 17 fue admitido prematuro a las 33 + 6 semanas con fiebre y disnea y se entregó espontáneamente a las 34 + 4 semanas. Una bebé nació, con un peso de 2180 g, con una puntuación de Apgar de 9 y 10 a 1 y 5 min, respectivamente, con un pH de arteria umbilical de 7,14. El recién nacido fue diagnosticado con infección por SARS-CoV-2 a través de un hisopo nasofaríngeo y fue ingresado en la UCI neonatal para la prematuridad. Sujeto No. 25 entregado espontáneamente en la semana 39 + 2. Un bebé varón nació, pesando 3340 g, con una puntuación de Apgar de 9 y 10 a 1 y 5 min, respectivamente, y el pH de la arteria umbilical fue de 7,14. El recién nacido fue diagnosticado con infección por SARS-CoV-2 a través de un hisopo nasofaríngeo al momento del parto, mientras que dio negativo 48 h más tarde. Excepto en los dos casos antes mencionados, ningún otro recién nacido dio positivo por la detección del genoma del SARS-CoV-2 por hisopos nasofaríngeos. Excepto en dos casos, todos los recién nacidos fueron amamantados. Todos los neonatos estaban sanos y los dos bebés con SARS-CoV-2 positivos eran totalmente asintomáticos.
Detección de genoma viral y anticuerpos
Investigamos la presencia de SARS-CoV-2 en los especímenes recogidos, como se muestra en el Cuadro 3 y resumidos en el Cuadro 4a. Detectamos el genoma del SARS-CoV-2 en 2 (6%) muestras de plasma materno (sujeto n.o 4 y 17), ambas caracterizadas por un resultado clínico grave. Además, detectamos la presencia del genoma SARS-CoV-2 en hisopos vaginales, tejido placentario y plasma de cordón del sujeto no 17. Además, detectamos ARN SARS-CoV-2 en tejido placentario del sujeto no 25. El recién nacido del sujeto no 17 podría clasificarse como una infección congénita confirmada debido a la detección del genoma viral por PCR en un hisopo nasofaríngeo al nacer (recogido después de que el bebé fue limpiado), en la muestra placentaria y en el plasma del cordón umbilical. El sujeto no 25 podría clasificarse como una posible infección neonatal adquirida intraparto debido a la detección de ARN viral por PCR en hisopos nasofaríngeos al nacer (recogidos después de que el bebé fue limpiado) pero no a las 24-48 h de edad y de anticuerpos específicos del SARS-CoV-2 en el plasma del cordón umbilical.
Tabla 3 Genoma materno
| Sujeto no. | Resultado clínico | T1-T0 (días) | Plasma materno | Hisopo vaginal | Placenta | Líquido amniótico | Plasma de cordón umbilical | Cordón umbilical | Hisofaríngeo para recién nacidos | Leche | Sistema de clasificación por Shah et al.36 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ARN viral | Igm | Igg | ARN viral | ARN viral | ARN viral | ARN viral | Igm | Igg | ARN viral | ARN viral | ARN viral | Igm | Igg | ||||
| 1 | Muy fuerte | 2 | − | − | − | − | − | N/A | − | − | − | − | − | + | + | − | No infectado |
| 2 | Leve | 1 | − | − | − | − | − | N/A | N/A | N/A | N/A | − | − | − | − | − | No infectado |
| 3 | Leve | 1 | − | − | − | − | − | − | − | − | − | − | − | − | − | N/A | No infectado |
| 4 | Muy fuerte | 2 | + | − | + | − | − | N/A | − | − | − | − | − | − | − | − | No infectado |
| 5 | Leve | 7 | − | − | − | − | − | N/A | − | − | − | − | − | N/A | N/A | N/A | No infectado |
| 6 | Leve | 1 | − | + | + | − | − | N/A | − | − | − | − | − | − | N/A | − | No infectado |
| 7 | Leve | 12 | − | + | + | − | − | − | − | − | − | − | − | − | − | − | No infectado |
| 8 | Muy fuerte | 6 | − | + | + | − | − | N/A | − | − | − | − | − | N/A | N/A | N/A | No infectado |
| 9 | Leve | 1 | N/A | N/A | N/A | − | − | N/A | − | − | − | − | − | − | − | − | No infectado |
| 10 | Leve | 1 | − | − | − | − | − | N/A | − | − | − | − | − | − | − | − | No infectado |
| 11 | Leve | 5 | − | − | − | − | − | N/A | − | − | − | − | − | − | − | − | No infectado |
| 12 | Leve | 4 | − | − | + | − | − | N/A | − | − | − | N/A | − | N/A | N/A | N/A | No infectado |
| 13 | Leve | 3 | − | − | + | − | − | N/A | − | − | + | − | − | − | − | − | No infectado |
| 14 | Leve | 3 | − | − | + | − | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
| 15 | Leve | 4 | − | − | − | − | − | N/A | − | − | − | N/A | − | N/A | N/A | N/A | No infectado |
| 16 | Leve | 2 | − | − | − | − | − | N/A | − | − | − | N/A | − | N/A | N/A | N/A | No infectado |
| 17 | Muy fuerte | 6 | + | + | + | + | + | N/A | + | − | + | N/A | + | N/A | N/A | N/A | Confirmado |
| 18 | Leve | 2 | − | − | + | − | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
| 19 | Leve | 9 | − | + | + | − | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
| 20 | Leve | 3 | − | + | + | − | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
| 21 | Leve | 13 | − | − | + | − | − | N/A | − | − | − | N/A | − | N/A | N/A | N/A | No infectado |
| 22 | Leve | 10 | − | − | − | − | − | N/A | − | − | − | N/A | − | N/A | N/A | N/A | No infectado |
| 23 | Leve | 9 | − | − | − | − | − | − | − | − | − | N/A | − | N/A | N/A | N/A | No infectado |
| 24 | Leve | 12 | − | − | − | − | − | N/A | − | − | − | N/A | − | N/A | N/A | N/A | No infectado |
| 25 | Leve | 17 | − | + | + | − | + | N/A | − | + | + | N/A | + | N/A | N/A | N/A | Posible |
| 26 | Leve | 13 | − | + | + | − | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
| 27 | Leve | 1 | − | − | + | − | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
| 28 | Leve | 3 | − | + | + | − | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
| 29 | Leve | 2 | − | − | + | − | − | N/A | − | − | − | N/A | − | − | − | − | No infectado |
| 30 | Leve | 1 | − | − | + | − | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
| 31 | Recuperado | N/A | − | − | + | N/A | − | N/A | − | − | + | N/A | − | N/A | N/A | N/A | No infectado |
- El tiempo que abarca el primer diagnóstico COVID19 (T0) y el parto (T1) se refiere al tiempo que abarca el primer diagnóstico COVID19 (T0).
- N/A no disponible.
Detectamos el genoma del SARS-CoV-2 en una muestra de leche sólo a partir de un caso de resultado clínico grave (sujeto no 1). Ni los 3 fluidos amnióticos probados ni los 12 cordones umbilicales fueron positivos (Tablas 3 y 4a).
IgM específico de SARS-CoV-2 se detectaron en el 32% del plasma materno, mientras que IgG específico del virus estaban presentes en el 63% de los casos. Curiosamente, detectamos la presencia de IgM en el plasma del cordón en un solo recién nacido (no 25), cuya placenta dio positivo para SARS-CoV-2, mientras que IgG estaba presente en el 40% del plasma del cordón umbilical. Asunto no 1 mostrado IgM en la muestra de leche (Tabla 3, resumido en el Cuadro 4b).
Respuesta inflamatoria en sujetos S SRAS-CoV-2 positivos
Para determinar si la infección por SARS-CoV-2 produce una alteración de la expresión génica inflamatoria en el tejido placentario, analizamos la expresión de 84 genes implicados en la respuesta inflamatoria en 4 biopsias placentarias seleccionadas. Los resultados mostraron que las placentas de pacientes infectados por ELS-CoV-2 (sujeto nos 17 y 25) muestran un perfil de activación inmune generalizada en comparación con el perfil no infectado (CTR) (Fig. 1). Del mismo modo, el sujeto 31, que se infectó en la semana gestacional 32 pero se recuperó completamente 4 semanas antes del parto, mostró un mayor perfil inflamatorio en comparación con CTR. En particular, tal estado de hiperactivación fue mucho más evidente en una biopsia placentaria del sujeto no 17 y aún más en uno de no 25, cuyo hisopo nasofaríngeo dio positivo para la detección del genoma del SARS-CoV-2 en T1, en comparación con la biopsia de placenta del paciente 31, que dio negativo en el momento del parto. Los genes cuya expresión de ARNm fue claramente regulada en los sujetos 17 y 25 están involucrados en diferentes aspectos de la respuesta inflamatoria e incluyen citoquinas y quimioquinas efectores, mediadores de inmunidad adaptativa, moléculas de señalización aguas abajo y receptores similares a peajes (Fig. 1).
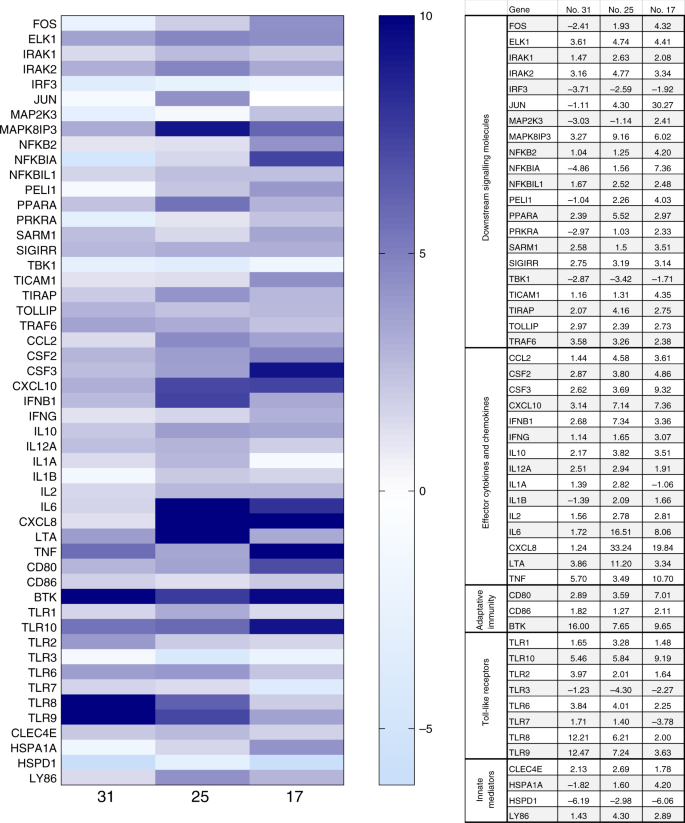
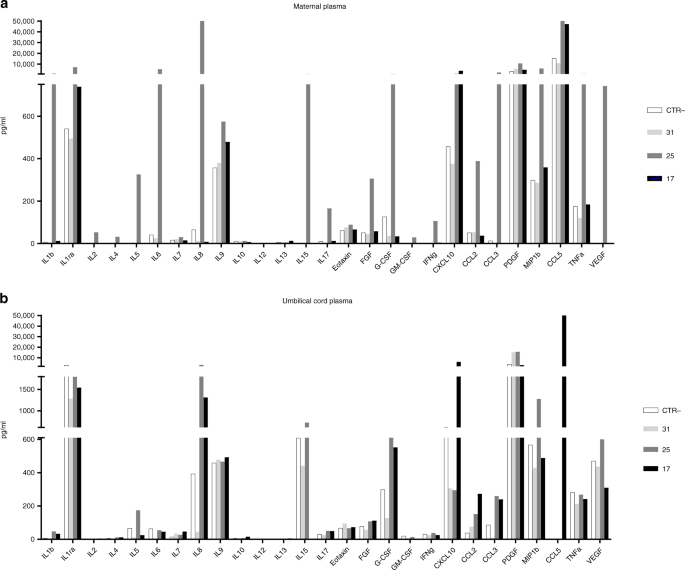
A continuación se llevó a cabo una investigación en profundidad del perfil de citoquinas/quimiocinas en CTR, 17, 25 y 31 sujetos debido a sus peculiaridades. Se realizó un ensayo de multiplex de 27 citoquinas en plasma aislado de muestras de sangre materna y funicular. En general, los resultados obtenidos en el plasma materno confirmaron lo que se observó a nivel de ARNm en las placentas. En resumen, las citoquinas antivirales proinflamatorias y las quimioquinas fueron reguladas al alza en el número de paciente 17 y 25, en comparación con los sujetos CTR y 31. El sujeto 25 mostraba un perfil proinflamatorio más pronunciado. En particular, la producción de IL-1 e IL-6 fue mayor en el tema 25 en comparación con todos los demás sujetos (Fig. 2a). El mismo análisis se realizó en plasma funicular. En cuanto al plasma materno, la concentración de moléculas proinflamatorias aumentó fuertemente en recién nacidos a partir del sujeto nos. 17 y 25. Este aumento fue mayormente evidente para las quimioquinas IL-8, CCL2, CCL3, CCL5 y CXCL10 (Fig. 2b).
Discusión
Informamos que el genoma del SARS-CoV-2 se encuentra en la sangre del cordón umbilical11,19,22,23,24,25,26. Además, de acuerdo con la literatura, encontramos el genoma sarS-CoV-2 en la mucosa vaginal de una mujer embarazada23,27 y en placentas a término20,27,28,29,30,31. Además, informamos de la presencia de anticuerpos específicos anti-SARS-CoV-2 IgM e IgG en la sangre del cordón umbilical de las mujeres embarazadas, así como en los especímenes de leche. En particular, también proporcionamos evidencia de que el ARN SARS-CoV-2 se puede encontrar en muestras de leche. Nuestros datos indican que en la transmisión vertical del útero es posible en mujeres embarazadas con SARS-CoV-2 positivos, de conformidad con los informes anteriores27. Por último, este informe describe la respuesta inflamatoria desencadenada por la infección por SARS-CoV-2 en mujeres embarazadas tanto a nivel sistémico como placentaria.
Nuestros resultados sugieren en la transmisión vertical del útero en 2 de los 31 (6%) mujeres con SARS-CoV-2-positivas. Un caso se caracterizó por un resultado clínico grave (sujeto no 17), mientras que el otro caso se clasificó como leve (sujeto no 25); especulamos que el riesgo de transmisión viral de madre a hijo no depende directamente de la gravedad de la progresión de la enfermedad. Apoyando esta observación, la historia clínica, así como los resultados de la prueba viro-inmunológica realizada en estos dos sujetos fueron divergentes. El sujeto no 17, caracterizado por afecciones graves, fue SARS-CoV-2 positivo en diferentes muestras, incluyendo plasma materno, vagina, así como plasma de cordón umbilical y placenta. En este caso, hipotetnciamos que el virus se propaga por el cuerpo a través del torrente sanguíneo, llegando a la vagina y la placenta y finalmente infectando al feto. En realidad, el hisopo nasofaríngeo de su recién nacido recogido al momento del parto fue positivo. En particular, el tema No. 17 fue el único que dio a luz prematuramente en la semana 34. De hecho, se informó que la prematuridad era más frecuente en pacientes infectados por ELS-CoV-28. Suponemos que esto podría estar relacionado con el estado inflamatorio como consecuencia de la infección viral; alternativamente, esto podría haber sido el resultado de una condición preexistente que desencadenó el parto prematuro y facilitó la entrada viral a través de la positividad placenta SARS-CoV-2 del plasma del cordón umbilical del recién nacido del sujeto 17, lo que demuestra que la infección fue adquirida prenatalmente por transmisión transplacentaria como recientemente establecida por la clasificación internacional sobre la infección materna, fetal y neonatal SARS-CoV-232. De hecho, si bien la coexistencia del lado materno y fetal en la placenta no nos permite sacar conclusiones firmes sobre la transmisión intrauterina, el plasma del cordón es exclusivamente material fetal, cuya infección puede ocurrir únicamente en el útero. En la misma mujer, se encontró que la vagina era positiva para SARS-CoV-2. Dado que la presencia del virus en la sangre del cordón umbilical indica en la transmisión del útero antes del parto, no podemos especular sobre el riesgo de adquirir el virus durante el parto vaginal en este caso. Sin embargo, no podemos excluir la posibilidad de infección viral por intraparto cuando el virus está presente en la vagina. Sujeto No. 17 entregado 6 días después del primer diagnóstico sars-cov-2. Lo más probable es que debido al corto lapso de tiempo T1-T0, no se detectó un IgM específico anti-SARS-CoV-2 en la sangre del cordón umbilical. Por el contrario, el sujeto no 25, que manifestó síntomas leves, fue SARS-CoV-2 negativo en todas las muestras biológicas analizadas (plasma materno, vagina, plasma de cordón umbilical) pero no en la placenta. Sin embargo, su recién nacido tuvo un hisopo nasofaríngeo positivo con SARS-CoV-2 al nacer y tanto IgM e IgG específicos de SARS-CoV-2 fueron detectados en plasma de cordón umbilical. Aunque sigue siendo polémico33, la presencia de anti-SARS-CoV-2 IgM sugiere fuertemente la infección por SARS-CoV-2 en el útero32. Cabe destacar que la positividad de los hisopos nasofaríngeos de los recién nacidos no se sostuvo con el tiempo, ya que las siguientes pruebas fueron negativas. También detectamos IgM e IgG en plasma materno. Esto es consistente con el lapso de tiempo entre el diagnóstico y el parto COVID-19 (17 días), donde la mediana de detección de IgM/IgG específico es de 13 días34. Es importante mencionar que T0 corresponde al diagnóstico inicial de SARS-CoV-2, que no coincide necesariamente con el momento de la infección. Esto puede dar lugar en algunos casos en la detección de anticuerpos específicos del SARS-CoV-2, aunque se produjeron unos días entre el diagnóstico inicial y el parto. Por lo tanto, no es posible establecer una correlación precisa entre el T1-T0 y la presencia de anticuerpos, ya sea en muestras de sangre maternas o fetales.
Decidimos recoger todos los especímenes de leche materna a los 5 días después del parto (T2) por dos razones: la primera relacionada con una mayor producción de leche materna, como no interferir con la alimentación del recién nacido durante los primeros días de vida; el segundo estaba relacionado con la mayor cantidad de anticuerpos en la leche madura. Detectamos la presencia de ARN SARS-CoV-2 en un solo caso (sujeto no 1), que fue un caso grave. Esto es consistente con lo que se informó previamente35. Sin embargo, la posible contaminación de la leche materna por SARS-CoV-2 sigue siendo controvertida y aún no se ha alcanzado un consenso11,36. Se requieren más estudios para evaluar si esto representa un virus infeccioso y replicativo o no y si puede depender de la viremia u otros factores. Se ha informado previamente que otros β-coronavirus pueden pasar a través de la leche37,38,39. Aunque se adoptaron precauciones, no podemos excluir la contaminación de la muestra por otros sitios positivos maternos. Además, probamos muestras de leche para detectar la presencia de IgM e IgG específicos anti-SARS-CoV-2. Pudimos detectar IgM sólo en el sujeto n.o 1. Anteriormente se informó que la ausencia de IgM e IgG en la leche no es infrecuente, especialmente en el caso de virus respiratorios40. Todavía no se ha estimado el papel protector de los anticuerpos anti-SARS-CoV-2 maternos. Esta información es urgente para evaluar el riesgo-beneficio de la lactancia materna e identificar nuevas pautas potenciales36. Un estudio reciente mostró la alta sensibilidad y especificidad del sistema automatizado iFlash para la detección de anticuerpos41. Sin embargo, esta metodología se ha adaptado para la detección de anticuerpos en la leche y la sensibilidad puede ser atenuada en este espécimen en particular.
Se necesitan más estudios para determinar los resultados a largo plazo y la posible transmisión vertical intrauterina en mujeres embarazadas infectadas en el primer o segundo trimestre. Esta observación es aún más relevante teniendo en cuenta que la expresión temporal y espacial del principal receptor SARS-CoV-2, ACE2, se ha divulgado para cambiar significativamente en los tejidos de interfaz materno-fetal en los diferentes trimestres21,42. Podemos especular sobre la posibilidad de que la modulación ACE2 podría estar directamente relacionada con la susceptibilidad de la placenta a la infección SARS-CoV-2. Alternativamente, podemos razonar en la posibilidad de que debido a la permeabilidad/daño alterado de la placenta, probablemente secundario a un estado inflamatorio, SARS-CoV-2 es capaz de pasar por alto la barrera placentaria y llegar a la sangre fetal. Esta cuestión aún está por abordarse e investigarse más a fondo.
Como varias líneas de evidencia indican que la infección materna sistémica y la consiguiente inflamación contribuyen a la interrupción del desarrollo/función de la placenta y posiblemente favorecen la transmisión vertical viral43,44, decidimos perfilar el estado inflamatorio de cuatro pacientes seleccionados a nivel local (placenta) y sistémico (maternal y fetal). Los resultados obtenidos por diferentes enfoques moleculares (expresión de ARN y secreción proteica) nos dan el mismo mensaje de llevar a casa al mostrar una tendencia de activación inmune generalizada en aquellos pacientes (17 y 25), que fueron POSITIVOS DE SARS-CoV-2 al momento del parto y, según los análisis viral-inmunológicos, infectaron a sus neonatos en el útero. Inesperadamente, este estado de hiperactivación fue mucho más evidente en muestras biológicas negativas del SARS-CoV-2 (biopsia de placenta, plasma de cordón materno y umbilical) del sujeto no 25, en comparación con el sujeto no 17, cuya condición clínica era grave. Una explicación plausible de esta aparente incoherencia se deriva de la observación de que el sujeto no 17 estaba siendo sometido a profilaxis de cortisona durante el período anteparto que podría haber debilitado la síntesis y liberación de citoquinas/quimioquinas inflamatorias. Entre los factores inflamatorios, su expresión se incrementó evidentemente en muestras de placenta y sangre de cordón umbilical del sujeto nos. 17 y 25; las quimioquinas CXCL10, CXCL8, CCL5, CCL3 y CCL2 podrían haber desempeñado un papel importante en favor de la transmisión vertical. De hecho, podrían haber creado un gradiente quimiotáctico entre las vellosidades y el espacio intervinoso, donde circulan los linfocitos maternos, favoreciendo así la diseminación viral45. Para realizar estos análisis moleculares, sólo cuatro sujetos (CTR, nos. 17, 25 y 31) fueron elegidos debido a sus peculiaridades. Es razonable suponer que tal perfil inflamatorio puede dar lugar a múltiples averías placentarias, como se ha informado recientemente46. Sin embargo, se prevén nuevos experimentos para confirmar este perfil distintivo y la consiguiente fisiopatología.
En conclusión, el genoma del SARS-CoV-2 se detectó en el plasma del cordón umbilical, lo que indica que en el útero la transmisión de madre a hijo, aunque rara, es posible y aparentemente está relacionada con un estado inflamatorio materno y fetal alto. Aunque se necesitan más estudios y no se pueden extraer conclusiones firmes debido al bajo número de casos analizados, esto debe tenerse en cuenta en el tratamiento de las mujeres embarazadas COVID-19. Nuestros hallazgos, junto con los resultados obtenidos por Vivanti et al.27, entregar un mensaje importante que no debe subestimarse. El genoma del SARS-CoV-2 se detectó en diferentes muestras biológicas; sin embargo, tanto Vivanti et al.27 y nuestro estudio confirmó que se produjo una infección transplacental SARS-CoV-2, según Shah et al.32. De hecho, la infección por SARS-CoV-2 de fetos, recién nacidos y lactantes generalmente no se considera ni se percibe como que no tiene consecuencias. El porcentaje que observamos es aproximadamente consistente con los resultados reportados previamente por Zeng et al.47. En general, muchos casos sospechosos se han notificado hasta ahora11,19,23,26,48,49,50,51,52,53,54,55,56,57. Los neonatos nacidos de madres infectadas deben ser examinados y cuidadosamente monitorizados clínicamente. Por lo tanto, alentamos a la comunidad científica y médica a considerar profundamente qué directrices deben ser más apropiadas en la práctica clínica.