Los enfoques de vacunación basados en vectores virales y en ARNm actualmente aprobados contra la enfermedad por coronavirus 2019 (COVID-19) consideran solo la vacunación homóloga de primer impulso de toda campaña de vacunación, pero la aparición de efectos adversos por la administración de la vacuna de Astra Zeneca, llevó a la realización de una vacunación heteróloga, que no solo demuestra que es efectiva, sino que podría ser mas beneficiosa. estas experiencias que se deberían corroborar en pocas semanas en Argentina, abrirá una perspectiva más favorable en la posibilidad de combinar Astra Zeneca con Sputnik, cuyo segundo componente es difícil de elaborar y producir.
Después de los informes de eventos tromboembólicos, varios gobiernos europeos recomendaron usar ChAdOx1-nCov-19 (ChAd) de AstraZeneca solo en individuos mayores de 60 años, dejando a millones de individuos ya preparados para ChAd con la decisión de recibir una segunda inyección de ChAd o un impulso heterólogo con vacunas basadas en ARNm.
Sin embargo, tales combinaciones no se han probado hasta ahora.
Utilizamos la cohorte de profesionales de la salud covid-19 contact study de la Facultad de Medicina de Hannover para monitorear las respuestas inmunitarias preparadas por ChAd antes y 3 semanas después del refuerzo con ChAd(n = 32) o BNT162b2 de BioNTech/Pfizer(n = 55).
Aunque ambas vacunas aumentaron la inmunidad inducida, BNT 162b2 Biontech indujo frecuencias significativamente más altas de células T CD4 y CD8 específicas de picos y, en particular, altos títulos de anticuerpos neutralizantes contra las variantes B.1.1.7, B.1.351 y P.1 de preocupación del coronavirus del síndrome respiratorio agudo severo 2.++
Principal
La primera vacuna aprobada contra el COVID-19 fue la vacuna de ARNm formulada por nanopartículas lipídicas BNT162b2 (Comirnaty, BNT), que fue desarrollada por BioNTech/Pfizer. Se demostró que la TNB era segura y 95% efectiva en la prevención de COVID-19 (ref. 1). Del mismo modo, ChAdOx1-nCov-19 (Vaxzevria, ChAd), una vacuna vectorizado por adenovirus de chimpancé deficiente en replicación desarrollada por la Universidad de Oxford en colaboración con AstraZeneca, tenía un perfil de seguridad aceptable, aunque con una eficacia algo menor del 70,4% contra el COVID-19 sintomático (ref. 2). Estos datos, junto con la eficacia de otras vacunas, incluidas las de Moderna3 y Johnson & Johnson4, aumentó la esperanza de un final rápido de la pandemia del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2).
Sin embargo, en la primera quincena de marzo de 2021, las vacunas con ChAd se detuvieron después de los informes de trombocitopenia moderada a grave y casos inusuales de trombosis en vacunas.5,7. Este nuevo síndrome, llamado trombocitopenia trombótica inducida por la vacuna6 o trombosis con síndrome de trombocitopenia, parece ser inducida por anticuerpos dirigidos contra el factor plaquetario 4 que conducen a la activación plaquetaria8. A pesar de las preocupaciones, la Agencia Europea de Medicamentos concluyó que los beneficios de la vacunación con ChAd superan los riesgos potenciales para un individuo (https://www.ema.europa.eu/en/news/astrazenecas-covid-19-vaccine-benefits-risks-context; consultado el 17 de junio de 2021), y ChAd sigue siendo una herramienta valiosa contra el COVID-19. Sin embargo, muchos países recomendaron a los vacunados, que recibieron la primera dosis de ChAd, que tuvieran una vacuna de ARNm o que eligieran entre vacunas basadas en ChAd o en ARNm como segunda dosis (de impulso). Un informe inicial del Estudio Com-COV aleatorizado del Reino Unido sugirió una reactogenicidad más a corto plazo de los programas heterólogos de impulsos primario9.
Además, las mutaciones en la proteína espiga del SARS-CoV-2 conducen a variantes de preocupación (VoC) de rápida expansión, incluyendo las variantes B.1.1.7 (Alfa), B.1.351 (Beta), P.1 (Gamma, anteriormente denominadaS B.1.1.28.1) y B.1.617.2 (Delta)10, que suscitó preocupación por la contención de las variantes del SARS-CoV-2 a través de la vacunación. Los anticuerpos inducidos por las vacunas BNT y ChAd neutralizan eficientemente la variante B.1.1.7, y la neutralización de las variantes P.1 y B.1.351 parece reducirse11,12,13. Además, la vacunación contra el BNT ha demostrado ser aproximadamente un 13% y un 28% menos protectora contra el desarrollo de COVID-19 sintomático para las variantes B.1.1.7 y B.1.351, respectivamente.14. Del mismo modo, se ha informado de que la protección contra el COVID-19 sintomático después de la vacunación con ChAd se reduce ligeramente para la variante B.1.1.715, mientras que no se observó ninguna protección contra el COVID-19 leve a moderado causado por la variante B.1.35116. Queda por determinar si los regímenes heterólogos de primo-impulso pueden inducir respuestas inmunes iguales o incluso más fuertes contra las nuevas variantes virales en comparación con los regímenes homólogos de impulso primaria
Para analizar la eficacia del calendario heterólogo de vacunación de primer impulso, utilizamos nuestra cohorte de profesionales de la salud (HCPs) del Estudio de Contacto COVID-19 (CoCo, por sus, HCPs)17,18 y respuestas monitoreadas a los programas de tratamiento de la vacuna covid-19 homóloga y heteróloga (Métodos). A los vacunados HCP de la Escuela de Medicina de Hannover que recibieron una dosis de ChAd se les ofreció elegir entre las vacunas ChAd y BNT para una segunda dosis. Para determinar la inmunogenicidad de los regímenes inmunes homólogos y heterólogos, estudiamos 129 vacunas ChAd-preparadas sin la infección anterior SARS-CoV-2, de quienes 32 eligieron la energía homóloga y 55 eligieron la estimulación heteróloga. Para la comparación, se incluyó un grupo de 46 BNT/BNT vacunados con HCP. El calendario de vacunación y extracción de sangre se muestra en la Fig. 1a, con información demográfica adicional (edad y sexo) en la Fig. 1a–c. Un análisis retrospectivo reveló que el pico medio anti-SARS-CoV-2 IgG (anti-S IgG) e IgA había disminuido en un 42% y 66%, respectivamente, desde los títulos medios 30 d después de ChAd primo a poco antes de la estimulación, lo que es similar a las disminuciones en los individuos vacunados con BNT /BNT (Datos Extendidos Fig. 2a,b). En particular, encontramos niveles similares de anticuerpos Anti-S IgG e IgA en los grupos ChAd/ChAd y ChAd/BNT antes del booster, lo que indica que ambos grupos respondieron igual de bien después del cebado con ChAd
(Fig. 1b).1: Respuestas inmunitarias humorales más fuertes contra todas las variantes de SARS-CoV-2 después de la vacunación heteróloga chAd/BNT versus chad/chad homóloga.
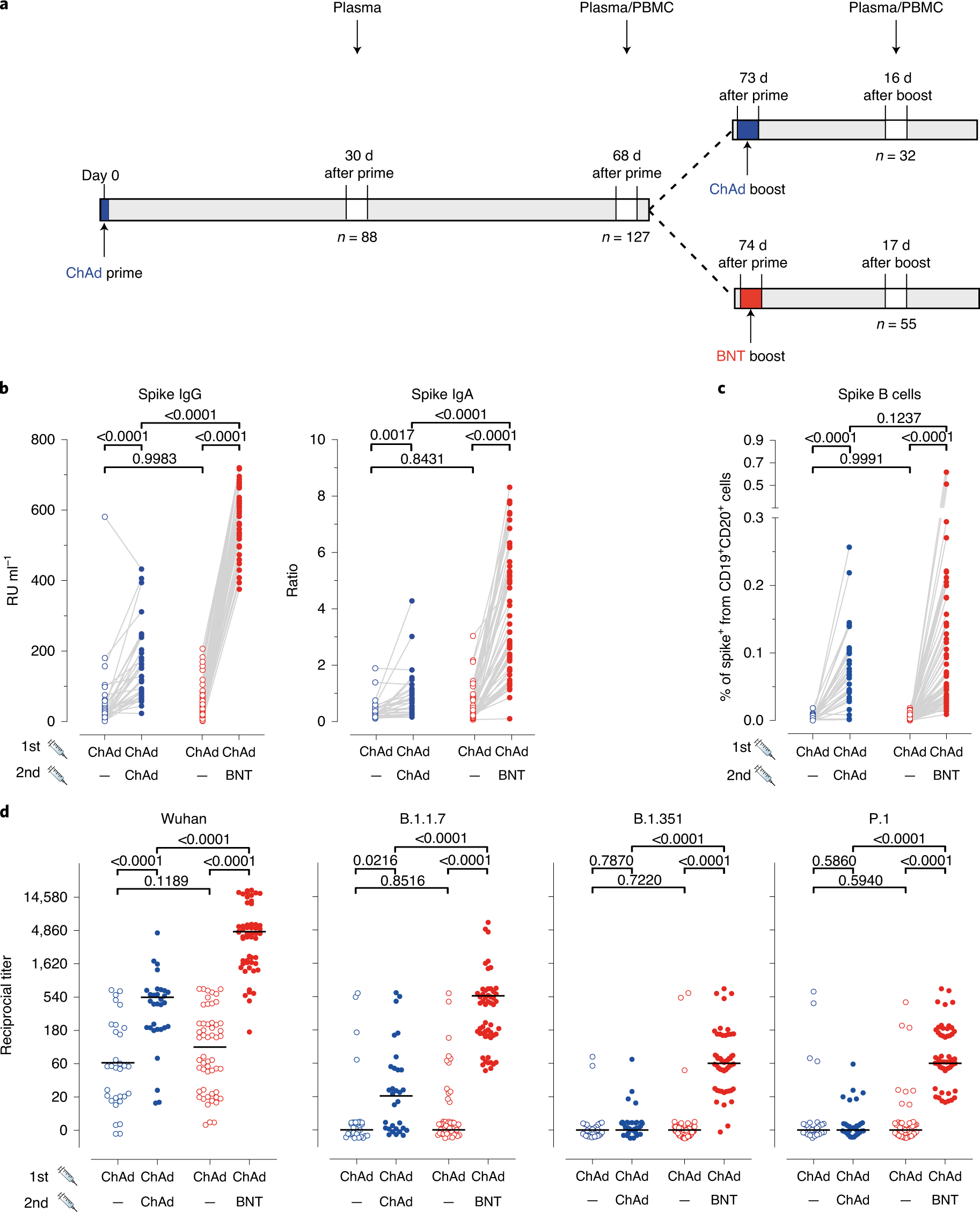
Después de la inmunización del aumentador de presión, las respuestas crecientes de IgG e IgA del anti-punto (s) fueron encontradas en ambos grupos. La vacunación heteróloga con ChAd/BNT llevó a un aumento significativo de 11,5 veces para la IgG anti-S(P < 0,0001) en comparación con un aumento de 2,9 veces después de la vacunación homóloga con ChAd(P < 0,0001) (Fig. 1b y Fig. 2cde Extended Data). Las diferencias en la IgG anti-S no fueron influenciadas significativamente por la edad o el sexo de los participantes (Datos Extendidos Fig. 2d). Se observaron cambios similares para la IgA anti-S (Fig. 1b),lo que indica mejores respuestas inmunitarias humorales después de la inmunización heteróloga de estimulación primo. Las concentraciones de IgG e IgA anti-S después de la vacunación con ChAd/BNT estaban dentro del rango de individuos completamente vacunados con BNT/BNT (Datos extendidos Fig. 2b y Datos extendidos Fig. 3a,b).
A continuación se determinó la frecuencia y el fenotipo de las células B portadoras de inmunoglobulinas unidas a la membrana específicas para la proteína espiga (Métodos y datos extendidos Fig. 4). Curiosamente, en muestras tomadas antes de la vacunación de refuerzo, las células B de memoria específicas de picos se pudieron detectar en solo el 53,1% (17/32) de los vacunados del grupo ChAd/ChAd y en solo el 43,6% (24/55) de los vacunados del grupo ChAd/BNT. Por otra parte, si está presente, las células B de memoria específicas del pico representaron solamente un raro (~0.003%) población de células B de sangre entera, sin diferencia significativa entre los grupos ChAd/ChAd y ChAd/BNT (Fig. 1c,círculos abiertos). Por el contrario, las células B de memoria específicas de picos aumentaron significativamente en todos los vacunas de los grupos ChAd/ChAd y ChAd/BNT después de la vacunación de refuerzo (Fig. 1c,puntos llenos). En contraste con las respuestas del anticuerpo anti-S, las vacunas heterólogas de ChAd/BNT y homólogas de ChAd/ChAd llevaron a la extensión de las células de B punto-específicas de la memoria a un grado similar. El aumento de las frecuencias de las células B de memoria específicas de espiga después de la inmunización de refuerzo, combinado con el aumento de las cantidades de anticuerpos específicos de pico, ponen de relieve la importancia de la vacuna de refuerzo para la protección completa contra la infección por SARS-CoV-2.
Para probar la actividad neutralizante de los anticuerpos inducidos por la infección o la vacunación, recientemente desarrollamos un ensayo de inmunoabsorción ligado a enzimas (ELISA) basado en la prueba de neutralización del virus sustituto (sVNT)19. Adaptamos el sVNT para incluir proteínas spike de los B.1.1.7, P.1 y B.1.351 VoC(Métodos). Para validar estos nuevos ensayos, se aplicaron sueros de vacunas que habían sido recientemente probadas por su capacidad neutralizante, aplicando la prueba de neutralización del virus de la estomatitis vesicular (VSV) basada en la prueba de neutralización del virus (pVNT)12. Comparando los resultados obtenidos usando pVNT con los de los sVNTs recientemente desarrollados, observamos un alto grado de correlación entre ambos ensayos, con R2 valores que oscilan entre 0,50 y 0,69 (Datos extendidos Fig. 5). Estos hallazgos demuestran que el sVNT es adecuado para evaluar cuantitativamente la capacidad de neutralización de los anticuerpos inducidos por la vacunación, no solo contra la cepa de Wuhan, sino también contra las variantes B.1.1.7, P.1 y B.1.351 del SARS-CoV-2.
Aplicando ensayos de sVNT, encontramos que 81 de 88 participantes tenían anticuerpos neutralizantes contra la cepa de Wuhan en plasma previo al impulso. Por el contrario, los anticuerpos neutralizantes contra las variantes B.1.1.7 (17/88), P.1 (12/88) y B.1.351 (5/88) fueron menos frecuentes (Fig. 1d y Fig. 6de Extended Data). A las 2-3 semanas después de la inmunización de refuerzo, las frecuencias y títulos de anticuerpos neutralizantes contra la cepa de Wuhan aumentaron en los grupos ChAd/ChAd y ChAd/BNT, con títulos que alcanzaron valores más altos en este último grupo (Fig. 1d y Fig. 6de Extended Data). Las diferencias entre el ChAd y la vacunación de refuerzo BNT se hicieron aún más evidentes al analizar la capacidad de neutralización de los anticuerpos inducidos contra el VoC. En el grupo ChAd/ChAd, la inmunización de refuerzo aumentó la neutralización de la variante B.1.1.7 en algunos individuos, pero no mostró ningún efecto contra las variantes P.1 y B.1.351 (Fig. 1d y Extended Data Fig. 6). Por el contrario, la inmunización de refuerzo con BNT indujo anticuerpos neutralizantes a altas frecuencias contra todos los VoC analizados. En el grupo ChAd/BNT, todos los participantes tenían anticuerpos neutralizantes contra las variantes B.1.1.7 y P.1, y todos menos dos participantes también tenían anticuerpos neutralizantes contra la variante B.1.351 (Fig. 1d y Extended Data Fig. 6). En el grupo ChAd/BNT, la capacidad de neutralización post-boost fue más alta contra la cepa wuhan, seguida de la variante B.1.1.7 y menos eficiente contra las variantes P.1 y B.1.351 (Fig. 1d y Extended Data Fig. 6). En conjunto, estos datos indican que la inmunización de refuerzo llevó a un aumento de anticuerpos neutralizantes en ambos grupos de vacunación y que la vacunación de refuerzo de BNT heteróloga indujo eficientemente anticuerpos neutralizantes contra todos los VoC probados.
Además de las respuestas inmunitarias humorales, también se analizaron las frecuencias y fenotipos de las células T específicas de espigas(Métodos y datos extendidos Fig. 7). Las frecuencias de células T CD4 específicas de espiga en muestras de sangre recogidas antes de la vacunación de refuerzo fueron significativamente más altas para ambos grupos de vacunación en comparación con los péptidos MNE (control) o DMSO solos (Fig. 2a y Fig. 8de Extended Data). No se encontraron diferencias significativas entre los grupos ChAd/ChAd y ChAd/BNT (Fig. 2a,círculos abiertos). Después de aumentar, las frecuencias para las células T CD4 específicas de espiga aumentaron en ambos grupos y fueron significativamente más altas en el grupo ChAd / BNT (Fig. 2a,puntos llenos). El mismo efecto fue observado para las células de T punto-específicas CD8. Estas células estaban presentes en frecuencias similares en ambos grupos antes de impulsar y aumentaron de frecuencias después de impulsar. De nuevo, el impulso con BNT indujo frecuencias más altas que el impulso con ChAd (Fig. 2b,puntos rellenos). En cuanto a la distribución de células T CD8 específicas de espiga productoras de interferón (IFN)-γ o factor de necrosis tumoral (TNF)-α, la aplicación de ambas vacunas de refuerzo condujo a un aumento en la proporción de células productoras de ambas citoquinas simultáneamente (Fig. 2c). El aumento significativo en las células T productoras de IFN-γ específicas de espiga en el grupo ChAd/BNT pero no en el grupo ChAd/ChAd fue confirmado por la medición de citoquinas en sobrenadantes después de la estimulación del péptido spike SARS-CoV-2 (Fig. 2d).++++
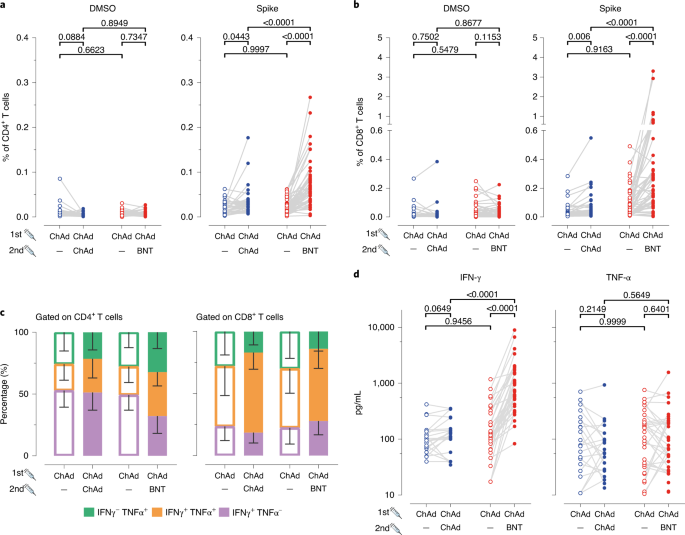
Debido a la abrupta recomendación de varios gobiernos europeos de suspender el uso de ChAd en la población joven y de mediana edad, se creó una situación única en la que se aplicaron regímenes de vacunación heterólogos de primer impulso a pesar de la falta de información disponible sobre los aspectos de inmunogenicidad y seguridad.
Este estudio proporciona penetraciones en el resultado inmunogénico de protocolos homólogos y heterólogos de la vacunación con dos vacunas: BNT y ChAd. La comparación cabeza a cabeza de los vacunados preparados con ChAd que recibieron una inmunización de refuerzo de ChAd o BNT reveló que ambos regímenes mejoraron las respuestas inmunitarias humorales y celulares.
Aunque esta configuración no permitió la aleatorización de los participantes, y somos, por lo tanto, incapaces de excluir completamente los factores de confusión, nuestro estudio reveló que el grupo impulsado con BNT mostró respuestas inmunes significativamente más fuertes que el grupo impulsado con ChAd.
Las respuestas de la célula de T CD4 y CD8 dirigidas contra los epítopos de la proteína del punto eran más altas en frecuencias, y las células produjeron más IFN-γ sobre el reestimulación. Asimismo, el grupo impulsado con BNT desarrolló títulos más altos de anticuerpos anti-spike de la proteína de las subclases de IgG y de IgA, y estas diferencias no fueron influenciadas perceptiblemente por edad o sexo. Cabe señalar que estos anticuerpos fueron altamente eficientes en la neutralización de los tres VoC probados en el presente estudio.
Anteriormente se informó que los vacunados inmunizados con BNT/BNT también desarrollan anticuerpos neutralizantes contra el VoC++20.
Confirmamos estos hallazgos en el presente estudio utilizando datos de los participantes de la cohorte del Estudio CoCo que también fueron inmunizados con BNT/BNT. Nuestros datos indican que los individuos vacunados con BNT/BNT y vacunados con ChAd/BNT desarrollan anticuerpos neutralizantes en grados similares de 2 a 3 semanas después de la vacunación de refuerzo. Asimismo, las inmuno respuestas del grupo de ChAd/ChAd estaban en la gama de resultados divulgados anterior11,12,13,21. Aunque habría sido interesante caracterizar también inmuno respuestas en una cohorte de la gente inmunizada con BNT/ChAd, tales individuos no estaban disponibles a nosotros. Queremos acentuar que nuestros datos obtenidos en HCPs sobre todo sanos y relativamente jóvenes no se pueden generalizar a la gente mayor o a los grupos pacientes específicos. Otra limitación de nuestro estudio es que no pudimos probar la actividad neutralizante contra la variante Delta y recopilar datos sobre seguridad y reactogenicidad después de la vacunación.
Se necesitan estudios prolongados, idealmente incluyendo criterios de valoración clínicos, para caracterizar aún más las respuestas inmunitarias no solo en cohortes heterólogamente inmunizadas. Será de particular importancia examinar la actividad neutralizante contra la nueva VoC, como la variante Delta, y cuánto tiempo se mantienen las respuestas inmunitarias protectoras, tanto en individuos que tienen un riesgo elevado de desarrollar COVID-19 grave como en individuos que son conocidos por montar respuestas inmunitarias deterioradas.
métodos
Participantes
Los participantes para este análisis fueron del Estudio CoCo (Registro Alemán de Ensayos Clínicos, DRKS00021152), que comenzó en marzo de 2020 y es un estudio observacional en curso, prospectivo y que monitorea la inmunoglobulina IgG anti-SARS-CoV-2 y las respuestas inmunitarias en 1.493 HCP en la Escuela de Medicina de Hannover y en individuos con contacto potencial con el SARS-CoV-2 (refs. 18,22). An amendment from December 2020 allowed us to study the immune responses after COVID-19 vaccination. According to German regulations, HCPs were prioritized for SARS-CoV-2 vaccination, and HCPs at Hannover Medical School received first doses of either the BNT vaccine after 6 January or the ChAd vaccine after 16 February 2021. In general, booster vaccination took place approximately 21 d after BNT prime and 2–3 months after ChAd prime. Booster vaccination of ChAd-primed HCPs started on 3 May 2021, and individuals could choose to receive either ChAd or BNT for second vaccination. We assumed that about 25% of all ChAd-primed vaccinees would opt for a homologous booster. The power calculation, performed with G*Power (v3.1.9.6), determined that a sample size of 30 individuals in each arm is sufficient to detect clinically meaningful differences within each group, assuming that spike protein-specific IgGs double from first vaccination (mean, 95 relative units (RU) ml−1, with an s.d. of 113 RU ml−1) y cuando se utiliza una prueba tpareada de dos colas para las diferencias entre medias con una potencia del 95% y un nivel de significancia del 1%. Sobre la base de los cálculos anteriores y una tasa de pérdida esperada de seguimiento del 10%, se invitó a 130 vacunas preparadas con ChAd de la cohorte del Estudio CoCo a donar sangre antes de que comenzara su impulso a principios de mayo de 2021. La programación de las citas para la vacunación fue coordinada por un equipo de vacunación independiente de acuerdo con la disponibilidad de la vacuna. Después del consentimiento informado por escrito, se obtuvieron muestras de sangre periférica por venopunción. Por orden de llegada, realizamos nuestro análisis estadístico formal una vez que al menos 30 individuos en cada brazo habían recibido una vacuna de refuerzo y habían pasado el día 13 después del refuerzo. Excluyeron a un individuo con la infección anterior SARS-CoV-2, según lo determinado por IgG positivo de la nucleocápsis anti-SARS-CoV-2 (NCP) antes de vacunas. Los participantes eran 25% hombres y 75% mujeres, con una edad media de 38 años (rango 19-64 años) y, por lo tanto, representativos de todas las vacunas del Estudio CoCo (72% mujeres, 28% hombres; edad media 40 años, rango 19-67 años). Después de la recolección de sangre, separamos el plasma de la sangre de EDTA o heparina de litio (S-Monovette, Sarstedt) y lo almacenamos a −80 °C hasta su uso. Para la estimulación con piscinas peptídicas de SARS-CoV-2, se utilizó sangre completa o células mononucleares de sangre periférica (PBMCs) de muestras de sangre entera aisladas por centrifugación de gradiente de Ficoll.
pVNT
Los pVNTs se realizaron en la Unidad de Biología de Infecciones del Centro Alemán de Primates en Göttingen como se describió anteriormente12. Brevemente, las partículas pseudotipadas rabdovirales se produjeron en células 293T transfectadas para expresar la variante deseada de SARS-CoV-2-S inoculada con VSV*DG-FLuc, un vector del virus de la estomatitis vesicular deficiente en replicación (VSV) que codifica para la proteína fluorescente verde mejorada y la luciferasa de luciferasa (FLuc) en lugar de la proteína VSV-G (amablemente proporcionada por Gert Zimmer, Instituto de Virología e Inmunología, Mittelhäusern, Suiza). Las pseudopartículas producidas se recogieron, se eliminaron de los desechos celulares por centrifugación y se almacenaron a −80 °C hasta su uso. Para los experimentos de neutralización, se mezclaron e incubaron volúmenes iguales de partículas pseudotipadas y muestras de plasma inactivadas por calor (56 °C, 30 min) diluidas en serie en medio de cultivo durante 30 min a 37 °C. Posteriormente, las muestras, junto con las partículas pseudotipadas no expuestas al plasma, se utilizaron para experimentos de transducción. El ensayo se realizó en placas de 96 pozos en las que las células Vero fueron inoculadas con las respectivas mezclas de partículas/plasma pseudotipadas. La eficacia de la transducción se analizó a las 16-18 h después de la inoculación midiendo la actividad de FLuc en células lisiadas (Cell Culture Lysis Reagent, Promega) utilizando un sustrato comercial (Beetle-Juice, PJK) y un luminómetro de placa (Hidex Sense Microplate Reader, Hidex) con el software Hidex Sense Microplate Reader (v0.5.41.0).
serología
Se determinó la serología de IGG SARS-CoV-2 por ELISA cuantitativo (dominio de proteína espiga anti-SARS-CoV-2 S1/dominio de unión a receptores (RBD) IgG SARS-CoV-2 QuantiVac, Euroimmun) de acuerdo con las instrucciones del fabricante (dilución 1:400 o 1:600). Proporcionamos niveles de anticuerpos expresados en RU ml−1 evaluado a partir de una curva de calibración, con valores superiores a 11 RU ml−1 definido como positivo. Se realizaron mediciones anti-SARS-CoV-2 S1 spike protein domain IgA o anti SARS-CoV-2 NCP IgG según las instrucciones del fabricante (Euroimmun) y se expresaron cantidades de anticuerpos como relación IgA (densidad óptica (OD) dividida por calibrador). Usamos un AESKU. LECTOR (AESKU. GROUP) y el software Gen5 versión 2.01 para su análisis.
sVNT para variantes del SARS-CoV-2
Para determinar los anticuerpos neutralizantes contra el pico de Wuhan, el B.1.1.7-spike (Alfa), el P.1-spike (B.1.1.28.1; Gamma) y las variantes de B.1.351-spike (Beta) de SARS-CoV-2-S en plasma, modificamos nuestro sVNT recientemente establecido19. En este ensayo, el receptor soluble para el SARS-CoV-2 —la enzima convertidora de angiotensina 2 (ACE2)— se une a placas de 96 pocillos a las que se pueden unir diferentes RBDs purificados etiquetados de la proteína espiga del SARS-CoV-2 una vez añadidos al ensayo. El atascamiento es revelado más a fondo por un anticuerpo peroxidasa-etiquetado de la anti-etiqueta y una cuantificación colorimétrica. La preincubación de la proteína espiga con suero o plasma de pacientes convalecientes o vacunas impide la posterior unión a ACE2 en diversos grados, dependiendo de la cantidad de anticuerpos neutralizantes presentes. En detalle, las placas Maxisorp 96F (Nunc) fueron recubiertas con proteína hACE2-Fc (IgG1) soluble recombinante a 300 ng por pozo en 50 μl de tampón de recubrimiento (30 mM Na2co3, 70 mM NaHCO3, pH 9,6) a 4 °C durante la noche. Después del bloqueo con hACE2-Fc (IgG1), las placas se lavaron con PBS, 0,05% Tween-20 (PBST) y se bloquearon con el diluyente de ensayo BD OptEIA durante 1,5 h a 37 °C. Mientras tanto, las muestras de plasma se diluyeron en serie tres veces a partir de la 1:20 y luego se preincubaron durante 1 h a 37 °C con 1,5 ng de espiga recombinante de SARS-CoV-2 RBD de la cepa wuhan (Trenzyme), la variante B.1.1.7 (N501Y; Alfa), la variante B.1.351 (K417N, E484K, N501Y; Beta) o la variante P.1 (K417T, E484K, N501Y; Gamma) (los tres últimos de SinoBiological), todos con una C-terminal His-tag. El diluyente del ensayo BD OptEIA fue utilizado para preparar la muestra del plasma así como las diluciones del RBD. Después de la preincubación con RBDs de espiga sars-CoV-2, se dieron muestras de plasma en las placas MAXISORP ELISA recubiertas de hACE2 durante 1 h a 37 °C. Sars-CoV-2 espiga RBDs pre-incubadas con tampón sólo sirvió como controles negativos para la inhibición. Las placas se lavaron tres veces con PBST y se incubaron con un anticuerpo conjugado conjugado con peroxidasa de rábano picante (HRP) (clon HIS 3D5, proporcionado por Helmholtz Zentrum München) durante 1 h a 37 °C. El anticuerpo sin encuadernado fue quitado por seis lavados con PBST. Una señal colorimétrica fue desarrollada en la reacción enzimática de HRP con el substrato cromogénico 3,3′,5,5′-tetramethylbenzidine (CONJUNTO DEL REACTIVO DEL SUBSTRATO DE BD OptEIA TMB). Un volumen igual de 0,2 M H2así que4 se añadió para detener la reacción, y las lecturas de absorbancia a 450 nm y 570 nm se adquirieron utilizando un lector de microplacas SpectraMax iD3 (Dispositivos moleculares) utilizando el software SoftMax Pro versión 7.03. Para cada pocillo, el porcentaje de inhibición se calculó a partir de los valores de OD después de la resta de los valores de fondo como: Inhibición (%) = (1 − Valor de OD de la muestra/Valor promedio de RBD OD de SARS-CoV-2 S) × 100. Los títulos neutralizantes de sVNT se determinaron como la dilución con reducción de unión > media + 2 s.d. de valores de una piscina plasmática que consistía en tres muestras de plasma pre-pandemia.
Piscinas de péptidos de proteína SARS-CoV-2
Pedimos 15 aminoácidos (aa)-largo y 10 aa-superpuestos péptidos que abarcan toda la longitud de SARS-CoV2-Spike (-S) (total 253 péptidos), -Membrana (-M) (total 43 péptidos), -Nucleocápsido (-N) (total 82 péptidos) o -Envoltura (-E) (total 12 péptidos; el péptido no. 4 no se pudo sintetizar) de GenScript. Todos los péptidos liofilizados se sintetizaron con una pureza superior al 95% y se reconstituyeron a una concentración de 50 mg ml−1 en DMSO (Sigma-Aldrich), excepto nueve péptidos superpuestos SARS-CoV2-S (nos. 24, 190, 191, 225, 226, 234, 244, 245 y 246), dos para SARS-CoV2-M (nos. 15 y 16), uno para SARS-CoV2-N (no. 61) y los 12 péptidos SARS-CoV2-E que se disolvieron a 25 mg ml−1 debido a problemas de solubilidad. Todos los péptidos en las existencias de DMSO se almacenaron a −80 °C hasta que se utilizaron.
Ensayo de reestimulación de células T
Los PBMCs, aislados usando un gradiente de Ficoll, fueron resuspended en una concentración de 20 × 106 células por ml en medio RPMI completo (RPMI 1640 (Gibco)) suplementadas con 10% de FBS (GE Healthcare Life Sciences), piruvato de sodio de 1 mM, 50 μM de β-mercaptoetanol y 1% de estreptomicina-penicilina (todo Gibco). Para el estímulo, las células fueron diluidas con volúmenes iguales de piscinas del péptido que contenían la S-proteína o la mezcla de M, de N- y de E-proteínas. Las piscinas del péptido fueron preparadas en RPMI completo que contenía brefeldin A (Sigma-Aldrich) en una concentración final de 10 μg ml−1. En la mezcla final, cada péptido tenía una concentración de 2 μg (~1,2 nmol) ml−1, a excepción de los péptidos SARS-CoV2-S 24, 190, 191, 225, 226, 234, 244, 245 y 246, los péptidos SARS-CoV2-M 15 y 16 y el péptido SARS-CoV2-N 61, que se utilizaron a una concentración final de 1 μg ml−1 debido a problemas de solubilidad. Como control negativo, estimulamos las células con DMSO, utilizadas en volumen máximo correspondiente a la cantidad de DMSO en piscinas peptídicas (igual al 5% de DMSO en volumen medio final). En cada experimento, utilizamos células estimuladas con forbol-12-miristato-13-acetato (Calbiochem) e ionomicina (Invitrogen) a una concentración final de 50 ng ml−1 y 1.500 ng ml−1, respectivamente, como control positivo interno. Las células se incubaron durante 12-16 h a 37 °C, 5% de CO2. Después del lavado, las células fueron resuspended en el almacenador intermediario de los MACS (PBS complementado con el 3% FBS y 2 milímetros EDTA). La unión a anticuerpos no específicos se bloqueó mediante la incubación de muestras con suero de ratón al 10% a 4 °C durante 15 min. A continuación, sin lavado, una mezcla de anticuerpos anti-CD3-AF532 (UCHT1; nº 58-0038-42, lote nº 2288218; Invitrogen; 1:50), anti-CD4-BUV563 (RPA-T4; núm. 741353, lote n.º 9333607; BD Biociencias; 1:200), anti-CD8-SparkBlue 550 (SK1; no. 344760, lote no. B326454; BioLegend; 1:200), anti-CD45RA (HI100; no. 740298, lote no. 0295003; BD Biociencias; 1:200), anti-CCR7 (G043H7; no. 353230, lote no. B335328; BioLegend; 1:50), anti-CD38 PerCP-eF710 (HB7; no. 46-0388-42, lote no. 2044748; Invitrogen; 1:100) y Zombie NIR Fixable Viability Kit (no. 423106, lote no. B323372; BioLegend) fue agregado. Después de la tinción durante 20 minutos a temperatura ambiente, las células se lavaron antes de que se fijaran y permeabilizaran (nº 554714, BD Biosciences) de acuerdo con el protocolo del fabricante. Después, los cytokines intracelulares fueron manchados usando anti-IFN-PE-Cy7 (B27; no. 506518, no de la porción. B326674; BioLegend; 1:100), anti-TNF-AF700 (Mab11; no. 502928, lote no. B326186; BioLegend; 1:50) y anti-IL-17A-BV421 (BL168; no. 512322, lote no. B317903; BioLegend; 1:50) durante 45 min a temperatura ambiente. El exceso de anticuerpos se lavó y se adquirieron células en un citómetro de flujo espectral Cytek Aurora (Cytek) equipado con cinco láseres que funcionaban a 355 nm, 405 nm, 488 nm, 561 nm y 640 nm. Todos los datos de citometría de flujo se adquirieron utilizando la versión 2.2.0 de SpectroFlo (Cytek) y se analizaron con FCS Express 7 (Denovo).
Análisis citométrico de flujo de células B específicas de espiga
Los leucocitos totales fueron aislados de sangre entera usando erythrolysis en la solución del cloruro de amonio 0,83%. Las células aisladas se lavaron, contaron y resuspendieron en PBS y se tiñeron durante 20 minutos a temperatura ambiente con una mezcla de anticuerpos que contiene anticuerpos enumerados en la Fig. 4 de Extended Data junto con la proteína spike-mNEONGreen (5 μg por reacción; la producción se describirá en otra parte). Después de un lavado, las muestras fueron adquiridas en un citómetro de flujo espectral, y los datos fueron analizados según lo descrito arriba.
Cuantificación de la liberación de IFN-γ y TNF-α
A continuación, se estimularon 0,5 ml de sangre completa con las partes seleccionadas por el fabricante del dominio SARS-CoV-2 S1 de la proteína espiga durante un período de 20-24 h. Se llevaron a cabo controles negativos y positivos de acuerdo con las instrucciones del fabricante (Ensayo de liberación gamma de interferón SARS-CoV-2 (Euroimmun)). Después de la estimulación, los sobrenadantes se recogieron después de la centrifugación y se examinaron mediante el kit LEGENDplex (BioLegend) de acuerdo con las instrucciones del fabricante. Los datos de mediciones duplicadas se adquirieron con un citómetro de flujo LSR II (BD Biosciences) utilizando el software FACSDiva versión 8.0.1 de BD y se analizaron con el software LEGENDplex Data Analysis Software Suite, Gen5 versión 2.01.