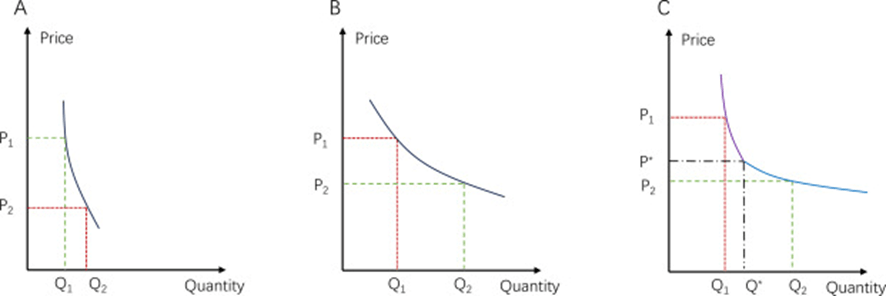
Esta serie dedicada del blog es para ver las causas que impulsan el aumento del gasto en salud y que debemos gestionar se utiliza un trabajo que resume que tendencia lleva el gasto en salud en EE.UU. En otro ejemplo más que supera al crecimiento de la economía: fue un 7,5%- La causa principal fue el aseguramiento de mayor cantidad de habitantes, el gasto en la atención hospitalaria aumento en la dispensación y precio de los medicamentos recetados en la farmacias (al por menor). Tener cobertura, y de acuerdo a la oferta y la forma de pago, será el aumento del gasto. Junto con la innovación en tecnología, las enfermedades crónicas, la fragmentación y la ineficiencia. Hace muchos años, dos décadas que al contrario de otras industrias, la tecnología en la salud es aditiva no sustitutiva de los costos. Asegurar sin racionalizar, contener, basar más las decisiones en la evidencia, en las guías clínicas y no tener datos, como historia clínica única, puede llevar a incrementar el gasto en forma superflua. Siempre estará la duda, de cuanto en los primeros años, de aumento de cobertura no es demanda contenida lo que se observa. Resulta importante señalar que el aumento del gasto en salud debe ser analizado en todas sus «caras»: cobertura, financiamiento, oferta, contratación, gobernanza, educación, desigualdad social, formas de pago, autorización de las innovaciones, organización de la oferta, su control, la acreditación, fijación o no de precios, envejecimiento de la población y otras medidas que la salutogénesis pueda introducir. No es una simple participación de factores, de sectores, de industrias, todas tienen sus intereses e procurarán tener una participación mayor en el mercado, sin importar la suma total y cuantos quedan fuera. Los sistemas de salud no tienen naturalmente a la equidad. La obligación de los gestores está en intentar mitigar esos «efectos Adversos».
Las prestación que está cubierta por los financiadores se prescribe más hay aumento de la utilización. Lo que tiene financiamiento puede constituirse en un silo, sobre el cual van los que «venden» productos intermedios. La forma en que las innovaciones entran al mercado y el precio que se autoriza, hace que las nuevas tecnologías sean mucho más costosas que las anteriores. La forma en como se pagan las prestaciones a los hospitales y los sanatorios, determinará los días de internación. La acreditación los parámetros de calidad. La oferta en una parte puede ser generadora de su propia demanda. La organización de la oferta, más o menos integrada, más fragmentada afecta el gasto. La desigualdad social. La falta de educación hace que se atiendan pacientes con menos nivel de alarma. El control que se ejerce sobre la oferta. La competencia que exista en el mercado de medicamentos.

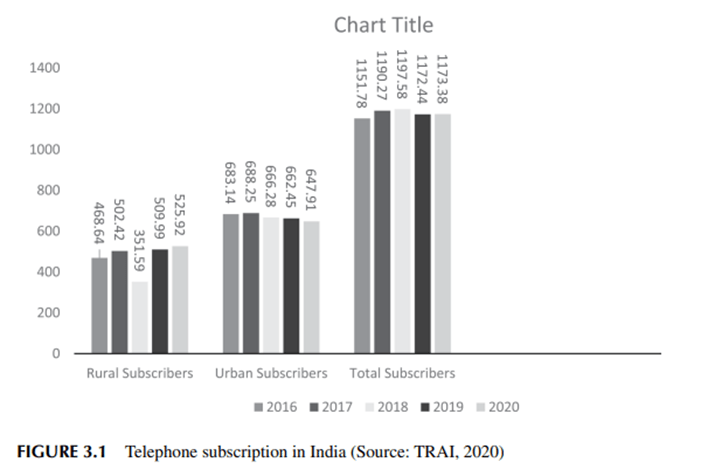
El gasto en atención médica en EE. UU. alcanzó los 4,9 billones de dólares y aumentó un 7,5 % en 2023, frente a una tasa del 4,6 % en 2022. En 2023, la proporción de asegurados de la población alcanzó el 92,5 %, gracias a un fuerte aumento de la afiliación a seguros médicos privados por segundo año consecutivo, y tanto el gasto en seguros médicos privados como en Medicare creció más rápido que en 2022. En el caso de Medicaid, el crecimiento del gasto y la afiliación se desaceleró al finalizar la emergencia de salud pública por la COVID-19. La participación del sector salud en la economía en 2023 fue del 17,6 %, similar a su participación del 17,4 % en 2022, pero inferior a la de 2020 y 2021, durante el pico de la pandemia de la COVID-19. Los gobiernos estatales y locales representaron una mayor proporción del gasto en 2023 que en 2022, mientras que la proporción del gobierno federal fue menor debido a que el financiamiento relacionado con la COVID-19 disminuyó y el crecimiento del gasto federal en Medicaid se desaceleró.
El gasto nacional en atención médica alcanzó los $4.9 billones en 2023 (o $14,570 por persona), aumentando un 7.5 por ciento con respecto a 2022 ( gráfico 1 ). Esta tasa de crecimiento fue más rápida que en 2021 y 2022, cuando el gasto en atención médica aumentó un 4.2 por ciento y un 4.6 por ciento, respectivamente. El menor crecimiento durante 2021 y 2022 se vio afectado por el vencimiento de la financiación federal temporal asociada con la pandemia de COVID-19 (que se inició en 2020 y se asoció con un aumento del 10.4 por ciento en el gasto en salud en ese año). En 2023, cuando terminó la emergencia de salud pública y quedaba poca financiación federal para la COVID-19, la aceleración del crecimiento del gasto reflejó en gran medida un mayor uso de bienes y servicios de atención médica, lo que influyó en el fuerte crecimiento tanto del seguro médico privado como del gasto de Medicare. Además, la inscripción al seguro médico privado aumentó y los niveles de inscripción a Medicaid se mantuvieron altos, lo que llevó a una proporción asegurada de la población que alcanzó el 92.5 por ciento ( gráfico 2 ).
| 2017 a | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | |
| Monto del gasto | |||||||
| NHE, miles de millones | $3,446.4 | $3,603.8 | $3,762.1 | $4,153.9 | $4,327.7 | $4,525.8 | $4,866.5 |
| PIB, miles de millones | $19,612.1 | $20,656.5 | $21,540.0 | $21,354.1 | $23,681.2 | $26,006.9 | $27,720.7 |
| NHE como porcentaje del PIB | 17.6 | 17.4 | 17.5 | 19.5 | 18.3 | 17.4 | 17.6 |
| Población (millones) b | 325.8 | 327.7 | 329.3 | 330.7 | 331.2 | 332.4 | 334.0 |
| ENH per cápita | $10,579 | $10,998 | $11,423 | $12,563 | $13,068 | $13,617 | $14,570 |
| PIB per cápita | $60,202 | $63,042 | $65,404 | $64,581 | $71,509 | $78,249 | $82,996 |
| Precios (2017 = 100.0) | |||||||
| Deflactor NHE ponderado por cadena | 100.0 | 102.2 | 103.3 | 106.3 | 108.0 | 111.3 | 114.6 |
| Índice de precios del PIB | 100.0 | 102.3 | 104.0 | 105.4 | 110.2 | 118.0 | 122.3 |
| Gasto real | |||||||
| NHE, miles de millones de dólares encadenados | $3,446 | $3,526 | $3,643 | $3,907 | $4,008 | $4,065 | $4,245 |
| PIB, miles de millones de dólares encadenados | $19,612 | $20,194 | $20,716 | $20,268 | $21,495 | $22,035 | $22,671 |
| Crecimiento anual | |||||||
| Envenenamiento por hepatitis no alcohólica (NHE) | 4,2% | 4,6% | 4,4% | 10,4% | 4,2% | 4,6% | 7,5% |
| PIB | 4.3 | 5.3 | 4.3 | −0,9 | 10.9 | 9.8 | 6.6 |
| Población b | 0.7 | 0.6 | 0.5 | 0.4 | 0.2 | 0.4 | 0.5 |
| ENH per cápita | 3.5 | 4.0 | 3.9 | 10.0 | 4.0 | 4.2 | 7.0 |
| PIB per cápita | 3.6 | 4.7 | 3.7 | −1.3 | 10.7 | 9.4 | 6.1 |
| Precios (2017 = 100.0) | |||||||
| Deflactor NHE ponderado por cadena | 1.1 | 2.2 | 1.0 | 3.0 | 1.6 | 3.1 | 3.0 |
| Índice de precios del PIB | 1.8 | 2.3 | 1.7 | 1.3 | 4.5 | 7.1 | 3.6 |
| Gasto real | |||||||
| NHE, miles de millones de dólares encadenados | 3.0 | 2.3 | 3.3 | 7.2 | 2.6 | 1.4 | 4.4 |
| PIB, miles de millones de dólares encadenados | 2.5 | 3.0 | 2.6 | −2.2 | 6.1 | 2.5 | 2.9 |
FUENTES: Centros de Servicios de Medicare y Medicaid, Oficina del Actuario, Grupo Nacional de Estadísticas de Salud; y Departamento de Comercio, Oficina de Análisis Económico y Oficina del Censo. NOTAS: Las definiciones, fuentes y métodos para las categorías de ENS se pueden encontrar en CMS. Cuentas Nacionales de Gasto en Salud: documento metodológico, 2023 (véase la nota 8 en el texto). Es posible que las cifras no sumen los totales debido al redondeo. Los cambios porcentuales se calculan a partir de datos no redondeados.
a Crecimiento anual, 2016-17.
b Las estimaciones reflejan la definición de población residente de la Oficina del Censo, que incluye a todas las personas que residen habitualmente en los 50 estados o Washington, D. C., pero excluye a los residentes de Puerto Rico y las zonas bajo soberanía estadounidense, a los miembros de las Fuerzas Armadas de EE. UU. en el extranjero y a los ciudadanos estadounidenses cuya residencia habitual se encuentra fuera de EE. UU. Las estimaciones también incluyen un pequeño ajuste (normalmente inferior al 0,2 % de la población) para reflejar el subregistro censal.
| 2017 a | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | |
| Seguro médico privado | |||||||
| Gastos (miles de millones) | $1,077.8 | $1,124.3 | $1,152.9 | $1,147.9 | $1,230.3 | $1,313.8 | $1,464.6 |
| Crecimiento del gasto | 4,8% | 4,3% | 2,5% | −0,4% | 7,2% | 6,8% | 11,5% |
| Gasto por inscrito | $5,331 | $5,603 | $5,704 | $5,736 | $6,126 | $6,441 | $7,065 |
| Crecimiento del gasto por inscrito | 4,7% | 5,1% | 1,8% | 0,6% | 6,8% | 5,1% | 9,7% |
| Matrícula (millones) | 202.2 | 200.7 | 202.1 | 200.1 | 200.8 | 204.0 | 207.3 |
| Crecimiento de la matrícula | 0,2% | −0,8% | 0,7% | −1,0% | 0,3% | 1,6% | 1,6% |
| Seguro médico del estado | |||||||
| Gastos (miles de millones) | $705.0 | $751.6 | $804.5 | $834.6 | $895.6 | $952.5 | $1,029.8 |
| Crecimiento del gasto | 4,3% | 6,6% | 7.0% | 3,7% | 7,3% | 6,4% | 8,1% |
| Gasto por inscrito | $12,320 | $12,795 | $13,355 | $13,560 | $14,309 | $14,933 | $15,808 |
| Crecimiento del gasto por inscrito | 1,6% | 3,9% | 4,4% | 1,5% | 5,5% | 4,4% | 5,9% |
| Matrícula (millones) | 57.2 | 58.7 | 60.2 | 61.6 | 62.6 | 63.8 | 65.1 |
| Crecimiento de la matrícula | 2,6% | 2,7% | 2,6% | 2,2% | 1,7% | 1,9% | 2,1% |
| Seguro de enfermedad | |||||||
| Gastos (miles de millones) | $578.5 | $596.5 | $615.1 | $672.3 | $736.2 | $807.5 | $871.7 |
| Crecimiento del gasto | 2,4% | 3,1% | 3,1% | 9,3% | 9,5% | 9,7% | 7,9% |
| Gasto por inscrito | $7,821 | $8,127 | $8,443 | $8,820 | $8,691 | $8,869 | $9,502 |
| Crecimiento del gasto por inscrito | 1,7% | 3,9% | 3,9% | 4,5% | −1,5% | 2,1% | 7,1% |
| Matrícula (millones) | 74.0 | 73.4 | 72.9 | 76.2 | 84.7 | 91.0 | 91.7 |
| Crecimiento de la matrícula | 0,7% | −0,8% | −0,7% | 4,6% | 11,1% | 7,5% | 0,8% |
| Personas sin seguro y población | |||||||
| Sin seguro (millones) | 29.7 | 30.6 | 31.8 | 31.2 | 28.5 | 26.6 | 24.9 |
| Crecimiento sin seguro | 3,7% | 2,9% | 3,8% | −1,9% | −8,6% | −6,6% | −6,3% |
| Población (millones) b | 325.8 | 327.7 | 329.3 | 330.7 | 331.2 | 332.4 | 334.0 |
| Crecimiento poblacional | 0,7% | 0,6% | 0,5% | 0,4% | 0,2% | 0,4% | 0,5% |
| Porcentaje de asegurados de la población total | 90,9% | 90,7% | 90,4% | 90,6% | 91,4% | 92.0% | 92,5% |
El crecimiento económico general, medido por el producto interno bruto (PIB), aumentó un 6,6 % en 2023 tras un período de volatilidad que incluyó una disminución del 0,9 % en 2020, seguida de aumentos del 10,9 % en 2021 y del 9,8 % en 2022 ( gráfico 1 ). A pesar de la volatilidad del gasto en atención médica y del crecimiento del PIB en los últimos años, en promedio, sus tasas de crecimiento fueron similares durante 2020-23, con un 6,6 % anual y un 6,5 % anual, respectivamente (calculado a partir del gráfico 1 ). En consecuencia, el gasto en atención médica como porcentaje del PIB constituyó el 17,6 % en 2023, similar a la proporción del 17,5 % de 2019 antes de la pandemia de COVID-19.
La aceleración del crecimiento del gasto en salud (del 4,6 % en 2022 al 7,5 % en 2023) reflejó el crecimiento de factores no relacionados con el precio, como el uso y la intensidad de los servicios. 1 Al ajustarse a la inflación de los precios de la salud (medida por el deflactor del Gasto Nacional en Salud), el gasto real en salud aumentó un 4,4 % en 2023, una tasa superior al aumento del 1,4 % para dicho gasto en 2022 y superior a la tasa de crecimiento del PIB real, que fue del 2,9 % en 2023 ( gráfico 1 ). 2
Los precios de la atención médica, medidos por el deflactor del Gasto Nacional en Salud, crecieron un 3,0 % en 2023 ( gráfico 1 ), similar al aumento del 3,1 % en 2022 y al crecimiento anual promedio del 2,5 % durante 2020-22, pero claramente más rápido que la tasa promedio del 1,4 % para 2016-19. 3 La inflación en toda la economía, medida por el índice de precios del PIB, creció un 3,6 % en 2023, que fue una tasa mucho más lenta que sus aumentos del 4,5 % en 2021 y del 7,1 % en 2022 (la tasa de crecimiento más rápida desde 1981). 4
El fuerte crecimiento de la inscripción en seguros de salud privados, que comenzó en 2022, continuó en 2023 y contribuyó a un aumento de la proporción de asegurados de la población, que alcanzó el 92,5 por ciento en 2023, frente al 92,0 por ciento en 2022 ( gráfico 2 ). Gran parte del crecimiento en la inscripción a seguros médicos privados se debió al rápido crecimiento de la inscripción al Mercado de la Ley de Atención Médica Asequible, que aumentó en 5,8 millones de personas durante 2020-23 (datos no mostrados), principalmente como resultado de los subsidios mejorados que se pusieron a disposición mediante la Ley del Plan de Rescate Estadounidense de 2021 y se renovaron bajo la Ley de Reducción de la Inflación de 2022.5 Aunque la inscripción a Medicaid experimentó un crecimiento mucho más lento en 2023, principalmente debido a que los estados reanudaron la redeterminación de la elegibilidad de Medicaid después del final de las protecciones de cobertura de la era de la pandemia (también conocido como «desmantelamiento»), la inscripción aún se mantuvo alta, con 91,7 millones de beneficiarios, o, en promedio, 15,5 millones más de los inscritos en 2020 ( gráfico 2 ) .6
Entre los pagadores, la aceleración del crecimiento general del gasto en salud en 2023 se debió principalmente al gasto en seguros médicos privados, 7 que aumentó un 11,5 % en 2023 en comparación con un crecimiento del 6,8 % en 2022 ( gráfico 3 ). El gasto de Medicare también creció a un ritmo más rápido, un 8,1 % en 2023, en comparación con un crecimiento del 6,4 % en 2022. Para ambos pagadores, este crecimiento más rápido del gasto se atribuyó a los servicios de atención hospitalaria y a los medicamentos recetados al por menor (datos no mostrados).8 En cambio, para Medicaid, el crecimiento del gasto continuó siendo sólido, pero se desaceleró del 9,7 % en 2022 al 7,9 % en 2023 ( gráfico 3 ). Esta desaceleración se vio influenciada por un crecimiento mucho más lento de la inscripción, ya que la disposición de inscripción continua de Medicaid finalizó el 31 de marzo de 2023.9
| Origen de los fondos | 2017 a | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 |
| Monto del gasto (miles de millones) | |||||||
| Envenenamiento por hepatitis no alcohólica (NHE) | $3,446.4 | $3,603.8 | $3,762.1 | $4,153.9 | $4,327.7 | $4,525.8 | $4,866.5 |
| Gastos de consumo en salud | 3.263,1 | 3.411,0 | 3.563,8 | 3.953,9 | 4.109,2 | 4.298,6 | 4.627,7 |
| De su bolsillo | 370.3 | 386.2 | 403.0 | 398.1 | 440.9 | 471.5 | 505.7 |
| Seguro de salud | 2.493,4 | 2.609,0 | 2.717,5 | 2.811,9 | 3.028,4 | 3.245,6 | 3.558,6 |
| Seguro médico privado | 1.077,8 | 1.124,3 | 1.152,9 | 1.147,9 | 1.230,3 | 1.313,8 | 1.464,6 |
| Seguro médico del estado | 705.0 | 751.6 | 804.5 | 834.6 | 895.6 | 952.5 | 1.029,8 |
| Seguro de enfermedad | 578.5 | 596.5 | 615.1 | 672.3 | 736.2 | 807.5 | 871.7 |
| Federal | 361.4 | 372.3 | 387.7 | 460.6 | 514.5 | 570.7 | 591.4 |
| Estatal y local | 217.1 | 224.2 | 227.4 | 211.7 | 221.7 | 236.8 | 280.3 |
| Otros programas de seguro de salud b | 132.1 | 136.5 | 145.0 | 157.1 | 166.3 | 171.8 | 192.5 |
| Otros pagadores y programas de terceros | 304.0 | 316.6 | 335.0 | 503.1 | 428.5 | 374.7 | 403.3 |
| Otros programas federales c | 12.2 | 12.8 | 14.0 | 180.6 | 85.4 | 33.6 | 15.9 |
| Otros pagadores y programas de terceros menos otros programas federales | 291.8 | 303.8 | 320.9 | 322.5 | 343.1 | 341.1 | 387.4 |
| Actividad de salud pública | 95.4 | 99.3 | 108.2 | 240.8 | 211.4 | 206.8 | 160.2 |
| Federal d | 12.6 | 12.1 | 13.3 | 139.3 | 101.1 | 90.2 | 37.6 |
| Estatal y local | 82.8 | 87.2 | 94.9 | 101.5 | 110.3 | 116.6 | 122.6 |
| Inversión | 183.3 | 192.7 | 198.3 | 199.9 | 218.5 | 227.2 | 238.8 |
| Crecimiento anual | |||||||
| Envenenamiento por hepatitis no alcohólica (NHE) | 4,2% | 4,6% | 4,4% | 10,4% | 4,2% | 4,6% | 7,5% |
| Gastos de consumo en salud | 4.0 | 4.5 | 4.5 | 10.9 | 3.9 | 4.6 | 7.7 |
| De su bolsillo | 1.5 | 4.3 | 4.4 | −1.2 | 10.7 | 6.9 | 7.2 |
| Seguro de salud | 4.1 | 4.6 | 4.2 | 3.5 | 7.7 | 7.2 | 9.6 |
| Seguro médico privado | 4.8 | 4.3 | 2.5 | −0,4 | 7.2 | 6.8 | 11.5 |
| Seguro médico del estado | 4.3 | 6.6 | 7.0 | 3.7 | 7.3 | 6.4 | 8.1 |
| Seguro de enfermedad | 2.4 | 3.1 | 3.1 | 9.3 | 9.5 | 9.7 | 7.9 |
| Federal | 1.0 | 3.0 | 4.2 | 18.8 | 11.7 | 10.9 | 3.6 |
| Estatal y local | 4.9 | 3.3 | 1.4 | −6.9 | 4.7 | 6.8 | 18.4 |
| Otros programas de seguro de salud b | 5.3 | 3.4 | 6.2 | 8.3 | 5.9 | 3.3 | 12.1 |
| Otros pagadores y programas de terceros | 5.0 | 4.2 | 5.8 | 50.2 | −14.8 | −12.6 | 7.6 |
| Otros programas federales c | −1.1 | 5.2 | 9.3 | 1.186,8 | −52,7 | −60,7 | −52,6 |
| Otros pagadores y programas de terceros menos otros programas federales | 5.2 | 4.1 | 5.7 | 0.5 | 6.4 | −0.6 | 13.6 |
| Actividad de salud pública | 6.1 | 4.1 | 9.0 | 122.5 | −12.2 | −2.1 | −22.6 |
| Federal d | 7.0 | −4.3 | 10.3 | 947.8 | −27,4 | −10.8 | −58,4 |
| Estatal y local | 6.0 | 5.4 | 8.9 | 6.9 | 8.6 | 5.8 | 5.1 |
| Inversión | 8.4 | 5.1 | 2.9 | 0.8 | 9.3 | 4.0 | 5.1 |
| Impactos de la NHE por financiación suplementaria federal directa para la COVID-19 | |||||||
| NHE excluyendo los gastos de actividades de salud pública federal | $3,433.8 | $3,591.7 | $3,748.8 | $4,014.6 | $4,226.6 | $4,435.6 | $4,828.9 |
| NHE excluyendo los gastos de actividades de salud pública federales y otros programas federales | $3,421.6 | $3,578.9 | $3,734.7 | $3,834.0 | $4,141.2 | $4,402.1 | $4,813.0 |
| Impactos del NHE, crecimiento anual | |||||||
| NHE excluyendo los gastos de actividades de salud pública federal | 4,2% | 4,6% | 4,4% | 7,1% | 5,3% | 4,9% | 8,9% |
| NHE excluyendo los gastos de actividades de salud pública federales y otros programas federales | 4.2 | 4.6 | 4.4 | 2.7 | 8.0 | 6.3 | |
Entre los bienes y servicios de atención médica, la aceleración del crecimiento del gasto nacional total en salud en 2023 se debió principalmente a un crecimiento más rápido en las tres categorías más importantes: atención hospitalaria, servicios médicos y clínicos, y medicamentos recetados al por menor. El gasto hospitalario aumentó un 10,4 % en 2023, tras un crecimiento mucho más lento del 3,2 % en 2022, y el gasto en servicios médicos y clínicos aumentó un 7,4 % en 2023, tras un crecimiento del 4,6 % en 2022. En ambos casos, la aceleración reflejó un aumento de factores no relacionados con el precio, como el uso y la intensidad de los servicios, tras un crecimiento notablemente más lento en 2022 (datos no mostrados). El gasto en medicamentos recetados al por menor también contribuyó a la aceleración, aumentando un 11,4 % en 2023 desde una tasa del 7,8 % en 2022 ( gráfico 4 ), en gran medida debido a los cambios en la combinación de medicamentos dispensados hacia medicamentos de marca más nuevos y de mayor costo
10 y un crecimiento más rápido en los precios de los medicamentos recetados al por menor. 11
Las empresas privadas, los hogares y los gobiernos financian la atención médica en los EE. UU.; son los patrocinadores de las primas de seguros médicos privados, el gasto de bolsillo y los gastos de los programas gubernamentales (financiados a través de impuestos específicos o ingresos generales). En 2023, los gobiernos estatales y locales representaron una mayor proporción del gasto que en 2022, mientras que la participación del gobierno federal fue menor debido a que la financiación relacionada con la COVID-19 disminuyó y el crecimiento del gasto federal en Medicaid se desaceleró.
Sin embargo, de los $14,570 en gasto de salud per cápita en 2023, el gobierno federal representó la mayor parte, con un 32 por ciento ($4,689 por persona). Los hogares pagaron el 27 por ciento ($3,942 por persona), las empresas privadas representaron el 18 por ciento ($2,677 por persona), los gobiernos estatales y locales otro 16 por ciento ($2,279 por persona) y otros ingresos privados el 7 por ciento restante ($983 por persona)
n 2023, los gastos totales del gobierno federal para atención médica ($1.6 billones) aumentaron un 3.4 por ciento, luego de un crecimiento del 1.9 por ciento en 2022 ( gráfico 5 ). Los gastos federales de Medicare (una participación del 30 por ciento de los gastos de atención médica del gobierno federal) aumentaron un 12.9 por ciento en 2023, luego de un crecimiento del 1.1 por ciento en 2022. 12 Este crecimiento más rápido se debió en parte a los impactos iniciales en el gasto federal de Medicare de la Ley de Reducción de la Inflación, que redujo el costo compartido de las insulinas y las vacunas (aumentando la responsabilidad financiera de Medicare), 13 así como a un crecimiento más rápido en el gasto para atención hospitalaria de Medicare y servicios médicos y clínicos. Otro contribuyente al crecimiento del gasto federal en salud fue un aumento en los subsidios del Mercado (una participación del 6 por ciento), que crecieron un 25.5 por ciento en 2023, el tercer año consecutivo en que el crecimiento superó el 16 por ciento. 12 Estos subsidios llevaron a una mayor inscripción en los planes del Mercado. La parte federal de los pagos de Medicaid representó el mayor componente del gasto en salud del gobierno federal (38 %), <sup>12</sup> y estos pagos aumentaron un 3,6 % en 2023, tras un crecimiento del 10,9 % en 2022 ( gráfico 3 ). Este crecimiento más lento se debe en gran medida a la reducción gradual del porcentaje de asistencia médica federal (de abril de 2023 a enero de 2024), que se había incrementado en 6,2 puntos porcentuales durante el período 2020-22 como parte de la Ley de Respuesta al Coronavirus «Familias Primero» de 2020.<sup> 14</sup>
El gasto de atención médica de los hogares (1,3 billones de dólares) aumentó un 6,8 % en 2023 ( gráfico 5 ), una tasa de crecimiento más lenta que el aumento del 7,7 % en 2022, pero aún más rápida que la tasa promedio del 4,2 % durante 2016-19. 12 La mayor parte del gasto de atención médica de los hogares consistió en gastos de bolsillo (38 %), 12 que aumentaron un 7,2 % en 2023 después de un crecimiento del 6,9 % en 2022 ( gráfico 3 ) como resultado de un crecimiento más rápido del gasto en atención hospitalaria y servicios médicos y clínicos (datos no mostrados). Para Medicare y el seguro médico privado, las contribuciones de los hogares experimentaron tendencias divergentes. Las primas de Medicare y los impuestos sobre la nómina pagados por individuos (que representan una participación del 27 por ciento del gasto de salud de los hogares) experimentaron un crecimiento más lento del 4,0 por ciento en 2023, en comparación con el crecimiento del 11,8 por ciento en 2022.12 En contraste, las contribuciones de los hogares a las primas de seguros de salud privados patrocinados por el empleador (una participación del 26 por ciento) aumentaron un 8,9 por ciento en 2023 después de un crecimiento del 8,3 por ciento en 2022; el crecimiento más rápido resultó, en parte, de una mayor inscripción en planes de seguros de salud privados.12
El gasto en salud de las empresas privadas (894.000 millones de dólares) creció un 11,0 % en 2023, un ritmo superior al crecimiento del 6,8 % de la categoría en 2022 ( gráfico 5 ). La mayor parte del gasto en salud de las empresas privadas se compuso de las contribuciones a las primas de seguros médicos privados patrocinados por el empleador (77 %), que aumentaron un 13,0 % en 2023 tras un crecimiento del 6,7 % en 2022. <sup> 12</sup> Esta aceleración se debió, en parte, al aumento de la afiliación a seguros médicos privados y a un aumento en la proporción de seguros médicos privados patrocinados por el empleador que pagan las empresas privadas (del 71,4 % en 2022 al 72,1 % en 2023).<sup> 15</sup>
El gasto en salud de los gobiernos estatales y locales (US$761.300 millones) también mostró un crecimiento más rápido, aumentando un 11,6 % en 2023, en comparación con un crecimiento del 6,0 % en 2022 ( gráfico 5 ). La parte estatal de los pagos de Medicaid constituyó la mayor parte del gasto total en salud de los gobiernos estatales y locales (37 %) en 2023.<sup> 12</sup> Estos pagos crecieron un 18,4 % en ese año, aumentando a un ritmo más rápido que en 2022 (6,8 %) ( gráfico 3 ), y reflejan la eliminación gradual del porcentaje de asistencia médica federal temporalmente mejorado. Otro factor en la aceleración general fue el crecimiento más rápido de las contribuciones de los gobiernos estatales y locales a las primas de seguros médicos privados patrocinados por los empleadores (una participación del 28 %), que aumentaron un 9,0 % en 2023, tras un crecimiento del 4,4 % en 2022.<sup> 12</sup>
Seguro de salud privado
El gasto en seguros médicos privados alcanzó los 1,5 billones de dólares en 2023 (un 30 % del gasto nacional total en salud) y aumentó un 11,5 % con respecto a su nivel de 2022 ( gráfico 3 ). Esta tasa de crecimiento no solo fue superior al 6,8 % de 2022, sino que también fue la más alta desde 1990 (datos no mostrados). El sólido crecimiento en 2023 se debió al aumento de la afiliación a los planes de seguro médico privados del Mercado de Seguros Médicos y patrocinados por empleadores; un sólido crecimiento subyacente del gasto en bienes y servicios; y un sólido crecimiento del coste neto de los seguros, que incluye costes administrativos, impuestos, tasas y ganancias y pérdidas netas por suscripción.
En 2023, la afiliación a seguros médicos privados aumentó un 1,6 %, equivalente a 3,3 millones de personas, y el gasto por afiliado creció un 9,7 %, lo que representó una aceleración con respecto al crecimiento del 5,1 % en 2022 ( gráfico 2 ). Los planes del Mercado de Seguros Médicos continuaron experimentando un sólido aumento en la afiliación, con 2,7 millones de personas en 2023, tras un aumento de 1,7 millones en 2022. <sup> 12 </sup> La afiliación a seguros médicos privados patrocinados por empleadores aumentó un 0,3 % en 2023, equivalente a 0,5 millones de personas.<sup> 12</sup>
El gasto en atención médica personal, o los bienes y servicios pagados por seguros médicos privados, aumentó un 11,4 % en 2023, lo que representó una tasa de crecimiento mucho mayor que el aumento del 7,3 % en 2022.<sup> 12</sup> Esta aceleración se vio influenciada por un crecimiento más rápido del gasto en todos los bienes y servicios médicos, pero en particular en atención hospitalaria y medicamentos recetados al por menor. El costo neto de los seguros médicos privados aumentó un 12,5 % en 2023 y representó el 10,3 % del gasto total en seguros médicos privados.<sup> 12</sup>
Seguro médico del estado
El gasto de Medicare (que representó el 21 % del gasto nacional total en atención médica) alcanzó 1 billón de dólares en 2023, lo que representa un aumento del 8,1 %, tras un crecimiento del 6,4 % en 2022 ( gráfico 3 ). Este crecimiento más rápido se debió a un cambio de tendencia en el crecimiento del gasto tradicional en honorarios por servicio, que pasó de una disminución del 1,4 % en 2022 a un aumento del 1,7 % en 2023 (datos no mostrados). El gasto de los planes privados Medicare Advantage continuó experimentando un rápido crecimiento (aumentando un 14,7 % en 2023, tras un crecimiento del 15,7 % en 2022) y representó el 52 % del gasto total de Medicare en 2023 (frente a una participación del 39 % en 2019) (datos no mostrados).
La inscripción total a Medicare creció un 2,1 % en 2023, una ligera aceleración con respecto a 2022, cuando la inscripción aumentó un 1,9 % ( gráfico 2 ). La inscripción a pagos por servicio (52 % de la inscripción total) disminuyó por quinto año consecutivo, cayendo un 2,8 % en 2023 tras una disminución del 3,0 % en 2022 (datos no mostrados). Sin embargo, la inscripción a Medicare Advantage (una participación del 48 %) continuó experimentando un fuerte crecimiento en 2023, pero a un ritmo ligeramente más lento, aumentando un 7,9 % tras un crecimiento del 8,5 % en 2022 (datos no mostrados). El gasto total de Medicare por afiliado aumentó un 5,9 % en 2023, un ritmo más rápido que el aumento del 4,4 % en 2022 ( gráfico 2 ).
El gasto de Medicare en bienes y servicios experimentó un crecimiento más rápido en 2023, aumentando un 8,6 por ciento después del crecimiento del 5,4 por ciento en 2022.12 Un crecimiento más rápido en los gastos de atención hospitalaria y medicamentos recetados minoristas en 2023 contribuyó a esta tendencia ascendente, ya que el gasto hospitalario de Medicare creció un 6,0 por ciento (en comparación con el 1,5 por ciento en 2022) y los gastos de medicamentos recetados minoristas crecieron un 12,2 por ciento (en comparación con el 9,0 por ciento en 2022).12 Un aumento en el uso de hospitales ambulatorios, junto con aumentos en los precios tanto para pacientes hospitalizados como ambulatorios, impulsó la aceleración del gasto hospitalario de Medicare en 2023.16 En el caso de los gastos de medicamentos recetados minoristas de Medicare, que consisten principalmente en el gasto en medicamentos recetados de la Parte D, la aceleración fue parcialmente atribuible a un rápido aumento en el uso de medicamentos antidiabéticos de marca. Además, los impactos iniciales de la Ley de Reducción de la Inflación que aumentaron la generosidad del beneficio y ampliaron la responsabilidad financiera de Medicare, como los límites de costo compartido de las insulinas y las vacunas, contribuyeron a la aceleración. 16
Seguro de enfermedad
El gasto de Medicaid representó el 18 % del gasto total en atención médica en 2023 y alcanzó los 871 700 millones de dólares ( gráfico 3 ). El gasto total de Medicaid aumentó un 7,9 % en 2023, una tasa de crecimiento más lenta que en 2022 (9,7 %) y 2021 (9,5 %), pero más rápida que la tasa promedio del 3,2 % durante el período 2016-19. 12 En 2023, la inscripción promedio en Medicaid se desaceleró drásticamente, aumentando un 0,8 %, en comparación con el 7,5 % en 2022, y alcanzó los 91,7 millones de beneficiarios a medida que los estados reanudaron la redeterminación de la elegibilidad de Medicaid tras el fin de las protecciones de cobertura de la era de la pandemia ( gráfico 2 ). 9 Con un crecimiento del gasto ligeramente más lento y un crecimiento de la inscripción mucho más lento, el gasto de Medicaid por inscrito aumentó un 7,1 por ciento en 2023, en comparación con un aumento del 2,1 por ciento en 2022. Esta aceleración se debió, en parte, a aumentos de las tarifas o los costos de los proveedores, 17 así como al creciente uso de pagos dirigidos por el estado a los proveedores a través de organizaciones de atención administrada.18
El gasto de Medicaid en otros servicios de salud, residenciales y de cuidado personal (que representa el 19 % del gasto total de Medicaid) aumentó un 9,2 % en 2023, en comparación con un crecimiento del 13,2 % en 2022<sup> 12</sup> , influenciado por el sólido y continuo crecimiento del gasto en servicios domiciliarios y comunitarios (datos no mostrados). Si bien representa solo el 6 % del gasto total de Medicaid, el gasto en medicamentos recetados al por menor fue el componente de mayor crecimiento entre todos los bienes y servicios de Medicaid, con un aumento del 11,7 % en 2023, tras un crecimiento del 15 % en 2022<sup> 12 </sup>. En 2022 y 2023, el crecimiento del gasto en medicamentos antidiabéticos y para bajar de peso contribuyó a este sólido crecimiento<sup> 19</sup>
El gasto federal en Medicaid aumentó un 3,6 % en 2023, en comparación con las tasas de crecimiento de dos dígitos registradas durante el período 2020-22, resultado del aumento temporal del porcentaje de asistencia médica federal ( gráfico 3 ). Este mayor porcentaje se eliminó gradualmente en el segundo semestre de 2023, lo que devolvió algunos costos a los estados y contribuyó a un aumento del 18,4 % en el gasto estatal en Medicaid. En 2023, la participación del gobierno federal en el gasto de Medicaid se redujo al 68 %, en comparación con el 71 % en 2022, el 70 % en 2021 y el 63 % en 2019.<sup> 12</sup>
Atención hospitalaria
El gasto en atención hospitalaria alcanzó los 1,5 billones de dólares en 2023 (el 31 % del gasto total en salud) y aumentó un 10,4 %, en comparación con un crecimiento del 3,2 % en 2022 ( gráfico 4 ). La tasa de crecimiento en 2023 fue la más rápida desde 1990, cuando el gasto hospitalario aumentó un 10,8 %.<sup> 12</sup> La aceleración en 2023 se debió al fuerte crecimiento del gasto hospitalario de los seguros médicos privados (del 8 % en 2022 al 13 % en 2023) y de Medicare (del 1,5 % en 2022 al 6 % en 2023).<sup> 12</sup>
El sólido crecimiento de los gastos hospitalarios en 2023 reflejó una mayor demanda de procedimientos médicos20 y un sólido crecimiento de otros ingresos privados21. Las altas hospitalarias crecieron un 1,6 % en 2023, tras una disminución del 1,3 % en 202222, y el uso de la atención hospitalaria ambulatoria de Medicare aumentó en 202316, lo que contribuyó a un aumento en el uso de la atención hospitalaria en 2023. Otros ingresos privados (que representan el 7 % del gasto hospitalario total) se recuperaron de una disminución del 9,2 % en 2022 a un aumento del 27,8 % en 202312, en parte debido a la sólida rentabilidad de las inversiones durante el año23. El crecimiento de los precios hospitalarios se mantuvo relativamente estable, en un 2,7 %, en 2023, en comparación con el 2,8 % en 202224 .
Servicios médicos y clínicos
El gasto en servicios médicos y clínicos alcanzó los 978.000 millones de dólares (el 20 % del gasto total en atención médica) y aumentó un 7,4 % en 2023, un ritmo superior al del 4,6 % de 2022 ( gráfico 4 ). El crecimiento en 2023 se debió a factores no relacionados con el precio (como el uso y la intensidad de los servicios), mientras que el crecimiento de los precios se mantuvo bajo, en un 0,6 %. <sup> 25 </sup> Los gastos de los laboratorios de facturación independiente, clasificados en la categoría de servicios médicos y clínicos en las Cuentas Nacionales de Gastos en Salud, también experimentaron un crecimiento más rápido en 2023. <sup>26</sup>
El crecimiento del gasto en servicios médicos y clínicos se aceleró para tres de los cuatro principales pagadores: seguros médicos privados, gastos de bolsillo y Medicare. El gasto en seguros médicos privados para servicios médicos y clínicos creció un 9,4 % en 2023 (en comparación con un crecimiento del 8,5 % en 2022), y el gasto de bolsillo aumentó un 7,0 % (más rápido que su tasa de crecimiento del 4,6 % en 2022).<sup> 12</sup> Tras un crecimiento del 7,3 % en 2022, los gastos de Medicare para estos servicios aumentaron un 8,3 % en 2023, una tasa de crecimiento ligeramente superior, impulsada por un fuerte crecimiento del gasto en Medicare Advantage y un aumento (tras una disminución en 2022) del gasto en pagos por servicio de Medicare (datos no mostrados). Sin embargo, en el caso de Medicaid, la desaceleración del crecimiento de las inscripciones provocó un crecimiento más lento del gasto en médicos y servicios clínicos, que aumentó un 9,5 por ciento en 2023, en comparación con un crecimiento del 10,6 por ciento en 2022.12
Medicamentos recetados al por menor
El gasto en medicamentos recetados al por menor aumentó un 11,4 % hasta los 449 700 millones de dólares en 2023 (lo que representa el 9 % del gasto total en atención médica), acelerándose desde una tasa del 7,8 % en 2022 ( gráfico 4 ). El crecimiento más rápido lo experimentaron tanto el gasto en seguros médicos privados (una participación del 39 %), que creció un 13,8 % en 2023 tras un aumento del 3,5 % en 2022, como el gasto en Medicare (una participación del 32 %), que aumentó un 12,2 % en 2023 tras un crecimiento del 9,0 % en 2022. 12 Aunque el gasto general en medicamentos recetados al por menor aumentó a un ritmo más rápido en 2023, la tasa de crecimiento del número de recetas dispensadas (basada en un suministro de treinta días) fue ligeramente inferior en 2023 (2,9 % en comparación con el 3,6 % en 2022). 10
El rápido crecimiento del gasto en medicamentos utilizados para tratar la diabetes y la obesidad contribuyó a un crecimiento general más rápido de los gastos en medicamentos recetados al por menor, así como al crecimiento del gasto en seguros de salud privados y Medicare. 27 , 28 En el caso de Medicare (principalmente la Parte D), la aceleración también fue resultado de los impactos de la mejora de los beneficios de la Ley de Reducción de la Inflación, específicamente, la reducción de la participación de los beneficiarios en los costos de insulina y vacunas (lo que aumentó, a su vez, la responsabilidad financiera de Medicare). 29
El gasto de bolsillo (una participación del 13 por ciento) y de Medicaid (una participación del 11 por ciento) para medicamentos recetados minoristas también aumentó, pero a un ritmo más lento que en 2022. El gasto de bolsillo en medicamentos recetados aumentó un 2,8 por ciento en 2023, en comparación con un crecimiento del 12,0 por ciento en 2022.12 El crecimiento más lento del gasto de bolsillo se debió en parte a los ahorros por el uso de medicamentos genéricos, el mayor uso de cupones de fabricantes de medicamentos por parte de los consumidores y los límites de los seguros al gasto de bolsillo en medicamentos, incluidas las disposiciones de la Ley de Reducción de la Inflación que limitó los gastos de bolsillo para insulina y vacunas bajo Medicare, a partir de 2023.30 El crecimiento del gasto de Medicaid en medicamentos recetados se mantuvo sólido en 2023 (11,7 por ciento), pero fue más lento que en 2022 (15,0 por ciento), 12 en parte debido a la desaceleración del crecimiento de la inscripción.
Los precios de los medicamentos recetados al por menor aumentaron un 2,3 % en 2023, tras un crecimiento del 0,5 % en 2022 y cuatro años consecutivos de descensos durante 2018-21. 11 Los precios de los medicamentos de marca aumentaron a un ritmo más rápido que los precios de los medicamentos genéricos en 2023; sin embargo, el crecimiento de los precios de los genéricos se aceleró en 2023 en comparación con 2022, revirtiendo una tendencia de descenso de los precios de los medicamentos genéricos desde 2018. 31 Aunque la cuota de marca de todos los medicamentos recetados dispensados aumentó ligeramente en 2023, los medicamentos de marca representaron una proporción muy pequeña del total de recetas dispensadas (8,5 %). 10 Aun así, la cuota de mercado de marca (definida como porcentaje del gasto total) siguió aumentando de forma constante, alcanzando el 87,1 % en 2023, impulsada por los mayores costes de los medicamentos de marca en comparación con los medicamentos genéricos. 10
Conclusión
Una reflexión sobre las tendencias del crecimiento general de la economía y del sector salud durante el período 2020-23 revela un patrón interanual divergente, pero en promedio, su crecimiento fue similar.
En 2020, mientras que el PIB se contrajo (disminuyendo un 0,9 %), el gasto en salud aumentó considerablemente (un 10,4 %), debido al aumento de la financiación federal relacionada con la pandemia de COVID-19 y al incremento de la afiliación a Medicaid. En 2021 y 2022, el PIB experimentó un sólido crecimiento del 10,9 % y el 9,8 %, respectivamente, con un rápido aumento de los precios en toda la economía en ambos años. Al mismo tiempo, el gasto en salud creció a tasas más bajas (4,2 % en 2021 y 4,6 % en 2022), en parte debido a las reducciones en la financiación relacionada con la COVID-19. Estas tendencias se revirtieron nuevamente en 2023, cuando el gasto en salud creció un 7,5 % y el crecimiento del PIB fue más lento, del 6,6 %.
Esta reversión reflejó tanto una reducción de la diferencia en el crecimiento de los precios, ya que los precios de la atención médica aumentaron un 3,0 por ciento en 2023 en comparación con un crecimiento de precios del 3,6 por ciento en toda la economía, como una rápida aceleración de los factores no relacionados con los precios, como el uso y la intensidad de los servicios y bienes consumidos, ya que la proporción de asegurados de la población alcanzó un máximo histórico del 92,5 por ciento en 2023.
La proporción de la economía dedicada a la atención sanitaria en 2023 fue aproximadamente la misma que en 2019.
En promedio, durante el período 2020-23, el gasto en salud y el crecimiento económico general aumentaron un 6,6 % y un 6,5 % anual, respectivamente. Como resultado, la proporción de la economía dedicada a la salud en 2023 (17,6 %) fue aproximadamente la misma que en 2019 (17,5 %). Esta relación es similar a la del período prepandémico reciente, 2016-2019, cuando el gasto en salud y el PIB crecieron de forma comparable (en promedio, un 4,4 % y un 4,2 %, respectivamente), y la proporción de la salud en el PIB se mantuvo relativamente estable. <sup> 12</sup> Aunque existe incertidumbre sobre el futuro, se espera que los factores económicos y demográficos tradicionales del gasto en salud conduzcan al retorno de la atención médica a una mayor proporción de la economía.


































00303-7/asset/8f2c656e-0df3-4f1c-8797-2a50d3c38282/main.assets/gr1.jpg)
00303-7/asset/3a100ad6-ae96-4754-b21c-afc6252a83bd/main.assets/gr2.jpg)
00303-7/asset/ff4bc484-6655-4c27-ab34-c144b9df0911/main.assets/gr3.jpg)
00303-7/asset/669f048d-3e46-4b5c-a3cf-9c3f4f796a51/main.assets/gr4.jpg)