Dr. Carlos Alberto Diaz
Como Ustedes saben y he publicado en este blog, en la Asociación de Economía de la Salud España, y en los libros de mi autoría Innovación en la gestión hospitalaria, y Gestión clínica como vencer al despotismo ilustrado, sobre esta modalidad de gestión, Realice la capacitación black belt, siendo por tanto un gestor Lean, pero en terreno, no solo desde la autoría y tratando de difundir el método, sabiendo y reconociendo que no es el único camino de impulsar la calidad asistencial, por ello siempre este espacio tiene un lugar para la gestión lean. En este caso, quise recurrir a ser «Exegeta» de un gurú de la gestión Lean en Salud, prolífico autor, mejor expositor y muy abierto a la difusión de esta metodología, que se esta difundiendo en todo el planeta de la gestión hospitalaria.
Referencia Bibliográfica Mark Graban. Healthcare Kaizen. Lean Hospitals, The Mistakes That Make Us: Cultivating a Culture of Learning and Innovation.
Visión general de Lean para hospitales y sistemas de salud
¿Qué es Lean?
Se han escrito numerosos libros sobre Lean, creando varios marcos y definiciones
Es complicado tener una definición única y completa, pero podemos aprender algo de cada una y explorarlas.
Lean es Principalmente una forma de hacer las cosas mediante una filosofía por la calidad, por eliminar desperdicios, por mejorar el flujo de pacientes, el valor de las prestaciones, y las personas que trabajan y reciben el servicio, tanto un conjunto de herramientas como un sistema de gestión. Lean es un método para la mejora continua y el compromiso de los empleados.
Lean es un enfoque que permite resolver problemas importantes para líderes y organizaciones.
Una definición utilizada por muchos instructores en el Lean Enterprise Institute es:
«Lean es un conjunto de conceptos, principios y herramientas que se utilizan para crear y entregar el mayor valor desde la perspectiva de los clientes, consumiendo la menor cantidad de recursos y utilizando plenamente el conocimiento y las habilidades de las personas que realizan el trabajo».
¿Cómo puede la atención médica ofrecer el mayor valor a los pacientes utilizando la menor cantidad de recursos posible y maximizando el uso de las habilidades y conocimientos de nuestra gente? Esa es la pregunta principal cuando se trata de atención médica Lean.
Definición de Lean de Ohno
Taiichi Ohno, junto con Shigeo Shingo, fue uno de los creadores del Sistema de Producción Toyota (TPS). Ohno definió Lean enfocándose en objetivos empresariales que iban más allá de la fábrica.
Ohno escribió: «Todo lo que hacemos es observar la línea temporal desde que un cliente hace un pedido hasta que recogemos el pago. Reducimos ese tiempo eliminando los residuos sin valor añadido».
En este contexto, el desperdicio se define como cualquier problema que impida a las personas trabajar eficazmente o cualquier actividad que no aporte valor al cliente.
En un hospital, la línea temporal mencionada por Ohno podría ser el periodo desde que un paciente siente síntomas hasta que recibe atención y se paga al hospital. Se puede aplicar una definición similar a países o situaciones con presupuestos establecidos o sistemas de pago capitados.
«Todo lo que estamos haciendo es mirar la línea de tiempo desde el momento en que un paciente necesita atención hasta el momento en que recibe esa atención. Y estamos reduciendo ese plazo al eliminar los residuos sin valor añadido».
La definición de Ohno muestra que Lean se basa en el tiempo; reducir retrasos mejora la calidad y reduce costos. Según Toyota, el Sistema de Producción Toyota tiene dos pilares: «justo a tiempo», para mejorar el flujo y brindar atención adecuada, y «jidoka», para construir calidad en la fuente.
Un mejor flujo conduce a una mejor calidad y viceversa.
Definición del marco
Triángulo Toyota
Lean es un sistema integrado de desarrollo humano, herramientas técnicas, enfoques de gestión y filosofía que crea una cultura organizacional Lean.
Pilares de Toyota Way
Lean tiene que ver con la mejora continua («kaizen») y mostrar «respeto por las personas».
«Arreglando la atención médica desde adentro, hoy» (Spear)
1. El trabajo está diseñado como una serie de experimentos continuos que revelan problemas de inmediato.
2. Los problemas se abordan inmediatamente a través de la experimentación rápida.
3. Las soluciones se difunden de forma adaptativa a través de la experimentación colaborativa.
4. A las personas de todos los niveles de la organización se les enseña a convertirse en experimentalistas.
Los resultados ideales requieren comportamientos ideales; las creencias y los sistemas impulsan los comportamientos; Los principios informan los comportamientos ideales, siendo los principios rectores:
1. Liderar con humildad
2. Respeta a cada individuo
3. Enfócate en el proceso
4. Adopta el pensamiento científico
5. Valor de flujo y tracción
6. Asegurar la calidad en la fuente
7. Busca la perfección
8. Crea constancia de propósito
9. Piensa sistémicamente
10. Crear valor para el cliente
Lean es muy diferente de la reducción de costos tradicional, que a menudo se realiza recortando los presupuestos de los hospitales, el número de empleados y los servicios.
Ohno se centraba en el flujo, no en la eficiencia, per se, donde la eficiencia se define como la relación entre los productos y los insumos. Los sistemas de gestión basados en la eficiencia se centran en hacer más o mantener a todos y cada uno de los recursos lo más ocupados posible, lo que interfiere con el flujo, como se discutirá más adelante.
El flujo no mejora trabajando más rápido, sino reduciendo el desperdicio.
El libro Lean Thinking define el término Lean de la siguiente manera: «En resumen, el pensamiento Lean es Lean, porque proporciona una forma de hacer más y más con menos y menos: menos esfuerzo humano, menos equipo, menos tiempo y menos espacio, mientras se acerca cada vez más a proporcionar a los clientes exactamente lo que quieren».
Los cinco principios clave del Lean Thinking son:
1. «Especificar qué es lo que crea valor desde la perspectiva del cliente “
2. Identificar todos los pasos a lo largo de todo el flujo de valor
3. Hacer fluir aquellas acciones que crean valor
4. Solo haga lo que es tirado por el cliente justo a tiempo
5. Esfuérzate por alcanzar la perfección eliminando continuamente las capas sucesivas de desechos».
Es importante definir Lean en términos de las metas y objetivos de un sistema de salud.
Al igual que otros tipos de organizaciones, los hospitales necesitan realizar más trabajo con menos recursos o con la misma cantidad de personal. Proporcionar a los pacientes lo que necesitan incluye brindar una atención adecuada y hacerlo bien desde el principio. Los pacientes también esperan un ambiente acogedor y muchos desean un servicio similar al de un hotel. Buscan una atención eficiente y rentable, pero también quieren una atención segura que no cause daño durante su estancia en el hospital. Desde una perspectiva más amplia, los pacientes desean que sus proveedores de atención médica los mantengan saludables, lo cual presenta nuevos desafíos para la integración de los hospitales en el sistema de salud más amplio.
Lean no se enfoca únicamente en hacer «cada vez menos»; a veces implica «más y más»: es importante recordar el objetivo de proporcionar más valor y mejor servicio a los pacientes y a nuestras comunidades.
El Triángulo Toyota: Herramientas, Cultura y Sistema de Gestión
El diagrama indica que el TPS es un sistema integrado de tres elementos clave: filosofía, funciones técnicas y gerenciales, todos enfocados en el desarrollo de las personas, según Jamie Bonini, vicepresidente del Centro de Apoyo al Sistema de Producción de Toyota (TSSC), que colabora con fabricantes, organizaciones sin fines de lucro y sistemas de salud.
El modelo se centra en las personas y el desarrollo humano en el medio, ya que «las personas son el recurso más valioso», afirma Bonini.
Esto está rodeado de un enfoque equilibrado que combina herramientas técnicas (lo que se hace), herramientas de gestión (cómo se gestiona) y filosofía (lo que se cree). Todo esto, en conjunto, forma la cultura organizacional o una cultura de mejora de TPS.
Desarrollo Humano
En primer lugar, observe el centro del triángulo en la figura 2.1. No es casualidad que diagramas como este de Toyota coloquen a las personas en el centro. A los líderes de Toyota les gusta usar la frase «Construye personas, no solo autos».

lo que significa que el desarrollo de sus empleados es la clave para mejorar sus productos y procesos.
Al visitar una planta de Toyota u otras organizaciones en Japón, es común escuchar a los líderes enfatizar que el principal objetivo del trabajo de mejora es el aprendizaje y el desarrollo del personal, mientras que el impacto en el rendimiento es un objetivo secundario. Este enfoque contrasta con las prioridades de la mayoría de las organizaciones occidentales, que tienden a centrarse primero (o principalmente) en el retorno de la inversión (ROI). En el enfoque Lean, el desarrollo humano implica establecer «un marco sólido para cultivar líderes capaces y proporcionar a los empleados las habilidades prácticas necesarias».
Un desafío fundamental para los hospitales es desarrollar habilidades de liderazgo amplias en toda la organización, más allá de nuestra capacidad con los métodos Lean. ThedaCare ejemplifica un sistema de salud que ha proporcionado formación y entrenamiento sobre habilidades básicas de supervisión y fundamentos de liderazgo, además de la capacitación en «liderazgo Lean». Muchos sistemas de salud enfrentan dificultades porque asignan a personas talentosas a funciones de gestión sin ofrecerles la capacitación necesaria para gestionar eficazmente o entrenarlas a lo largo del tiempo.
Filosofía
La base del triángulo es la filosofía: ¿En qué creemos como organización y cuál es nuestro propósito? La filosofía TPS a menudo se deriva de lo que hemos aprendido sobre Toyota: describimos su cultura empresarial.
Bonini establece que el núcleo de esta filosofía se compone de cuatro puntos:
1. El cliente primero; Proveer a los clientes lo que desean, cuando lo desean y en la cantidad deseada.
2. Las personas son el recurso más valioso; Respetar, involucrar y desarrollar plenamente a las personas.
3. Mejora continua (kaizen); Involucrar a todos diariamente.
4. Enfoque en el piso de producción (gemba); Ir al lugar donde se realiza el trabajo para identificar y resolver problemas.
La filosofía de Toyota también incluye compromisos con sus «contribuciones a largo plazo a la sociedad» y con el «desempeño económico y el crecimiento de la empresa». Tener una visión a largo plazo es un tema recurrente, ya que el principio 1 del Toyota Way establece que una empresa debe «basar sus decisiones de gestión en una filosofía a largo plazo, incluso a expensas de los objetivos financieros a corto plazo».
ThedaCare ha adoptado la visión a largo plazo como parte de su transformación Lean. Dean Gruner, MD, MMM, su presidente y director ejecutivo (CEO), dice que «la forma más sencilla de hacerlo es a través de nuestras métricas del ‘norte verdadero’, donde incluimos objetivos de uno y cinco años», comenzando cada revisión bimensual con una mirada a su progreso.
Las declaraciones de misión y valores de los hospitales a menudo se asemejan a las de Toyota, ya que muchos afirman que sus principales prioridades incluyen la seguridad, el compromiso de los empleados, la mejora continua y la administración de sus comunidades y el medio ambiente. Sin embargo, es importante considerar si estos valores se practican efectivamente en el día a día por los empleados del hospital y si la seguridad del paciente se mantiene como una prioridad absoluta, tal como declaran públicamente muchos sistemas de salud.
Cumplir con estos ideales puede ser un desafío en cualquier organización, incluido Toyota, ya que todos somos humanos y no siempre actuamos acorde con nuestros estándares establecidos. El liderazgo tiene la responsabilidad de dar un buen ejemplo e insistir en que otros también cumplan con los ideales y la filosofía de la organización diariamente. Si los valores establecen que se respeta y valora a las personas, un sistema de gestión tradicional de mando y control de arriba hacia abajo, que emite órdenes sin espacio para la retroalimentación de los empleados, no es coherente con esos valores. Un hospital debe decidir si va a implementar métodos Lean de manera aislada o limitada dentro del contexto de su cultura existente, o si va a examinar lo que debe cambiar en su cultura. Los sistemas de salud que han transformado tanto su sistema de gestión como su cultura tienden a tener un éxito mayor y más sostenido que aquellos que solo ejecutan unos pocos proyectos o implementan una o dos herramientas Lean.
ThedaCare en Appleton, Wisconsin, y Virginia Mason Medical Center en Seattle, Washington, son ejemplos de hospitales que han logrado grandes resultados con una cultura Lean durante más de doce años. Muchos hospitales ya tienen una filosofía que facilita adoptar herramientas y sistemas Lean. Sin embargo, los hospitales que no cumplen sus propios valores pueden encontrar difícil implementar Lean si buscan soluciones rápidas para problemas culturales. Aun así, probar herramientas Lean puede ofrecer nuevas perspectivas y métodos de trabajo.
Como se dice: «Es mucho más probable que las personas actúen de manera en una nueva forma de pensar, que piensen en una nueva forma de actuar». Decir que «nuestra cultura no es como la de Toyota» no justifica evitar Lean. Los sistemas de salud deben saber que cambiar la cultura toma tiempo, liderazgo y esfuerzo. Aunque los conceptos Lean son simples, una transformación lleva años.
El Dr. W. Edwards Deming dijo: «[El cambio] no ocurre de una sola vez. No hay pudín instantáneo». Un arquitecto señaló que no puede diseñar mágicamente un hospital Lean para ellos.
Herramientas técnicas
El componente técnico de Lean incluye las herramientas y métodos implementados y utilizados. Es posible que haya oído hablar de Lean a través de algunos de los métodos específicos empleados en hospitales, que se presentan en la Tabla 2.2, entre ellos kanban, 5S, A3, detección de errores y gestión visual. El desarrollo de estas herramientas se basa en la filosofía subyacente, que incluye la idea de facilitar el trabajo del personal y priorizar al cliente. Como señala Womack, estas herramientas son «necesarias, pero insuficientes» para transformar una organización.

Lean hospitals. Mark Graban 2019
Definir Lean solo como un conjunto de herramientas es incorrecto. Lean es más que «una caja de herramientas». Para lograr el impacto completo de Lean, se debe adoptar y practicar todo el sistema de gestión. Las herramientas adecuadas en una cultura equivocada no dan los resultados correctos. Una nueva herramienta en una vieja cultura puede causar frustración o disfunción.
El Dr. Jack Billi, Decano Asociado de Asuntos Clínicos de la Facultad de Medicina de la Universidad de Michigan, comentó: «Todos queremos utilizar el pensamiento Lean como una estrategia empresarial fundamental… Por supuesto, todo el mundo [normalmente] se centra en las herramientas. Queremos que Lean sea más que la aplicación de herramientas simples. Formamos a la gente en las herramientas para que entiendan cómo encajan en un modelo holístico de resolución de problemas. Las herramientas son poderosas, pero solo pueden llegar hasta cierto punto».
Métodos gerenciales
Lean no solo abarca filosofía y herramientas técnicas, sino también la gestión de personas y sistemas. Las habilidades de liderazgo son clave para implementar Lean. Sin liderazgo, los empleados pueden no ver la importancia de mejorar ni cómo Lean puede ayudar. Una vez adoptados, se necesita liderazgo constante y un sistema de gestión para mantener y mejorar.
Bonini dice que un líder debe «desarrollar a las personas para identificar y resolver problemas, y servir mejor al cliente». Los cuatro roles de un líder en una transformación Lean incluyen:
- Mostrar un compromiso apasionado por la mejora y el TPS
- Aprenda los principios de TPS lo suficientemente bien como para enseñarlos a otros (los principios básicos y los detalles)
- Construir una cultura organizacional que surja y resuelva los problemas
- Gary Convis, un vicepresidente senior retirado de Toyota que había sido uno de los estadounidenses de mayor rango en la compañía, escribió que la «cultura gerencial para TPS se basa en varios factores, incluido el desarrollo y el mantenimiento de un sentido de confianza, un compromiso de involucrar a los afectados por la primera vez, el trabajo en equipo, el trato igualitario y justo para todos y, por último, la toma de decisiones basada en hechos y el pensamiento a largo plazo».
Los líderes de ThedaCare han implementado nuevos métodos de gestión como parte de su cultura Lean. Este cambio incluye pasar de un entorno de mando y control, en el que «los líderes comunican sus directrices a los empleados», a un lugar de trabajo donde se muestra respeto por cada individuo, se escucha, se pide la opinión de los empleados, se busca su ayuda cuando hay problemas y se proporciona capacitación para que el personal pueda mejorar en sus propias áreas.
Kim Barnas, presidenta del ThedaCare Center for Healthcare Value, señala: «El líder [en el nuevo sistema] actúa como un maestro zen. Incluso si creemos conocer la respuesta, nuestra conclusión es menos valiosa que la investigación de un equipo sobre la causa raíz, el aprendizaje de las herramientas, la aplicación de la lógica y la implementación de su propia solución. En lugar de dar respuestas, ahora escuchamos. Podemos sugerir herramientas para aplicar y ofrecer insumos, pero no proporcionamos la respuesta final. Las soluciones son responsabilidad de los equipos, que aplican herramientas en un proceso estandarizado».
La filosofía «Toyota Way» define Lean de manera simple y elegante en dos partes.
1. Mejora continua
2. Respeto por las personas
Ohno describió esto: «El objetivo más importante del sistema Toyota ha sido eliminar de manera consistente y completa el desperdicio. El concepto y el respeto igualmente importante por la humanidad que ha transmitido el venerable Sakichi Toyoda (1867-1930) son la base del sistema de producción de Toyota».
Este respeto se extiende a todas las partes interesadas: clientes, empleados, proveedores y las comunidades en las que opera Toyota. Estos principios están interrelacionados. Debido al respeto por las personas, se fomenta la mejora continua. Este respeto implica involucrar al personal, los médicos y los pacientes en el proceso de mejora. El respeto a las personas es tanto la razón como el medio para lograr la mejora continua.
Estos no son conceptos nuevos en el enfoque Lean; sin embargo, muchas organizaciones que han intentado adoptar Lean se han centrado únicamente en la eliminación del desperdicio. Los líderes no logran mucho obligando a la gente a cambiar. Para tener éxito, debemos centrarnos en ambos aspectos por igual: la mejora continua y el respeto por las personas. Utilizar Lean para realizar mejoras de calidad y productividad que resulten en despidos sería un ejemplo de no mantener este equilibrio. Un número creciente de organizaciones de atención médica han declarado públicamente políticas sobre no usar Lean para impulsar despidos. Es comprensiblemente difícil lograr que los empleados adopten Lean si temen por sus puestos de trabajo.
Mejora Continua
Aunque muchos asocian Lean con proyectos o eventos de una semana, el mayor potencial se logra cuando todas las personas de la organización se dedican a mejorar los procesos todos los días. La palabra japonesa kaizen se usa para describir la mejora continua, traducida a veces como pequeños cambios o cambios para bien. Estos esfuerzos de mejora se centran regularmente en reducir el desperdicio que existe en la atención al paciente o en el trabajo de las personas.
Masaaki Imai define kaizen simplemente como «mejora cotidiana de todos, en todas partes». Esto contrasta con las organizaciones donde la mejora es solo responsabilidad de expertos, consultores o gerentes, o donde la mejora ocurre únicamente a través de proyectos o comités esporádicos.
El término residuo (también descrito con la palabra japonesa muda) tiene su propia definición única cuando se usa en asociación con Lean. En los entornos sanitarios, los residuos pueden definirse como cualquier actividad que no ayuda a los pacientes o que no los mueve hacia el diagnóstico, el tratamiento, o el alta. Un ejemplo de residuo es el tiempo que se pasa esperando, ya sea una cita o el siguiente paso en el tratamiento del paciente. Otro ejemplo de residuo serían las actividades o errores que dañan a un paciente. En el capítulo 3 se profundiza en el tema de los residuos.
El Dr. Donald Berwick, ex presidente y director ejecutivo del Instituto para el Mejoramiento de la Atención Médica y ex administrador de los Centros de Servicios de Medicare y Medicaid, indicó que los hospitales contienen una cantidad considerable de residuos, aunque el alcance exacto no está claro.
Berwick afirmó que entre el 20% y el 30% del gasto total en atención médica en los Estados Unidos, aproximadamente medio billón de dólares, es residuo.25
David Sharbaugh, director de mejora de la calidad en el Hospital Shadyside (Pittsburgh, Pensilvania), señaló: «No es irreal considerar el 40% y el 50% de residuo en el sistema de atención médica».
El desperdicio está presente en todos los procesos hospitalarios. Esto no es una acusación, sino un reconocimiento del sistema. Las metodologías de mejora continua se aplican en sistemas estables y libres de residuos. Los principales hospitales utilizan los principios de Lean para rediseñar o revisar sus procesos y espacios, creando estabilidad. Además, las organizaciones de atención médica Lean fomentan la mejora continua mediante mentalidades de gestión y mecanismos para involucrar al personal. Respeto por las personas Una exposición en un centro de visitantes de Toyota en Japón destaca el «respeto por las personas» y dice: «No hay límite para el grado en que se puede desarrollar la sabiduría humana. Nuestro objetivo es lograr entendimiento mutuo, cumplir responsabilidades y combinar el poder de nuestros empleados. El respeto por las personas valora la capacidad de pensar de cada individuo». Cuando los líderes de Toyota hablan de tener respeto por las personas (o, originalmente, «respeto por la humanidad»), esto podría tener un significado diferente al que las organizaciones tradicionales podrían entender por respeto; después de todo, ¿qué líder diría que no respetan a su gente? El respeto no significa que los gerentes den a los empleados libertad para hacer su trabajo como les plazca, por un sentido de confianza, siempre y cuando los resultados sean buenos.
En un hospital que aplica los principios de Lean, los gerentes y líderes revisan con frecuencia los detalles de cómo se ha realizado el trabajo. Esta práctica se lleva a cabo para garantizar resultados adecuados y de calidad, demostrando así respeto hacia el paciente. Además, es posible realizar estas verificaciones de manera que también se muestre respeto por los empleados.
En las organizaciones Lean, el respeto no implica necesariamente que los gerentes y líderes sean siempre amables con sus empleados, ni que las personas eviten los conflictos entre sí.
Nuestro objetivo no es solo tener empleados felices, ya que eso podría lograrse de maneras superficiales y costosas que no mejoren la atención al paciente.
En Lean, el respeto significa desafiar a las personas para que rindan al máximo de su capacidad de forma constructiva. También reconoce nuestras limitaciones humanas, como la fatiga y distracción, que llevan a errores y defectos.
Un líder Lean analiza primero el sistema y los procesos ante un problema, en lugar de culpar a una persona. Gary Convis, ex presidente de la planta de Toyota en Kentucky, dijo: «Respetas a las personas, las escuchas, trabajas juntas. No los culpas. Tal vez el proceso no estaba bien organizado, por lo que era fácil cometer un error». Sir Liam Donaldson, ex director médico de Inglaterra, afirmó: «El error humano es inevitable. Podemos eliminar los problemas en el sistema que lo hacen más probable». El respeto implica apoyar a los empleados sin sobrecargarlos. Lean demanda lo mejor de ellos, creando confianza y promoviendo eficiencia junto con relajación.
En japonés, existen términos específicos para describir diversos tipos de ineficiencias y problemas laborales: «muda» para el desperdicio, «muri» para el exceso de trabajo y «mura» para las cargas de trabajo desiguales.
Respetar a las personas implica evitar la sobrecarga laboral y asegurarse de que los empleados no estén abrumados. El enfoque Lean no se centra en exigir a las personas que trabajen a un ritmo acelerado o que se encuentren en múltiples lugares simultáneamente. Un empleado de un hospital mencionó de manera humorística la idea de necesitar patines para moverse más rápido al conocer Lean por primera vez. Los pensadores Lean, en cambio, indagarían sobre las razones detrás de la necesidad de recorrer largas distancias y buscarían soluciones para eliminar esa necesidad.
Parte del compromiso con el respeto hacia las personas es confiar en nuestros empleados y fomentar su participación en la resolución de problemas y la eliminación de desperdicios. No corresponde únicamente a los líderes resolver todos los problemas, sino que la mejora debe ser una colaboración entre empleados y gerentes. No buscamos crear un sistema donde los gerentes sean los únicos en pensar, resolver problemas y diseñar el sistema, mientras que los empleados simplemente sigan instrucciones sin aportar sus ideas.
Los empleados de hospitales se sienten más satisfechos cuando pueden dedicar más tiempo a su trabajo de atención al paciente, ya sea directa o indirectamente. Nuestra gran ventaja en el cuidado de la salud es la motivación intrínseca de nuestros empleados por ayudar a las personas, un deseo que los llevó a la atención médica.
Como líderes, debemos asegurar que la motivación intrínseca no se pierda debido a la frustración y el agotamiento. El fallecido Peter Scholtes criticaba cómo contratábamos empleados motivados (madera viva) y los desmotivábamos (madera muerta). Para respetar a las personas, trabajamos para crear un entorno donde nuestros empleados, nuestros activos más valiosos, crezcan en vez de frustrarse y abandonar la organización o irse a la competencia. 33
Los nuevos empleados pueden sugerir soluciones al enfrentar problemas, como la falta de instrumentos quirúrgicos. Si sus sugerencias no se escuchan o no se resuelven los problemas, pueden desmotivarse y dejar de intentar solucionarlos, convirtiéndose en «madera muerta».
La mejora continua y el respeto por las personas son esenciales en Lean, especialmente en la salud. Respetar a las personas impacta en la seguridad y resultados del paciente. Un estudio sugiere que los pacientes que sienten falta de respeto del personal tienen dos veces y media más probabilidades de experimentar un error médico prevenible comparado con aquellos que se sienten tratados con respeto.
El Dr. John Toussaint, ex director ejecutivo de ThedaCare, describió cómo Paul O’Neill, ex director ejecutivo de Alcoa, le enseñó tres preguntas clave para evaluar si su entorno es propicio para el respeto hacia las personas:
- ¿Son tratados mi personal y mis médicos con dignidad y respeto por todos en la organización?
- ¿Tienen mi personal y mis médicos la capacitación y el estímulo necesarios para realizar un trabajo que les proporcione sentido a sus vidas?
- ¿He reconocido a mi personal y a mis médicos por su labor?
Cuatro capacidades organizativas para Lean
El profesor Steven J. Spear describió Lean como un enfoque racional y científico, que los empleados del hospital pueden adoptar fácilmente debido a su formación científica. Si respetamos a las personas y las involucramos plenamente en la mejora continua, en lugar de depender de unos pocos expertos, este debería ser el caso. Spear detalló cuatro capacidades organizativas en el artículo «Fixing Healthcare from the Inside, Today» y las desarrolló en su libro, The High-Velocity Edge.
Capacidad 1: El trabajo se diseña como experimentos continuos que revelan problemas de inmediato. Hay tres elementos clave:
Primero, «el trabajo está diseñado» implica que nuestras acciones no son azarosas ni inconsistentes. El concepto Lean de trabajo estandarizado (visto en el Capítulo 5) sugiere que tanto empleados como líderes deben diseñar el trabajo, evitando prácticas comunes no planificadas. Un director de seguridad del paciente en un hospital comentó: «Nuestro sistema de administración de sangre es complejo y simplemente evolucionó por sí solo. Hay muchas ineficiencias y oportunidades de error».
Los empleados de los hospitales deben estandarizar los procesos y tareas clave para mejorar la seguridad del paciente, evitar retrasos, facilitar el trabajo del personal y reducir costos. La estandarización no se realiza simplemente por cumplir normativas o porque «Lean lo recomienda». Cuando diferentes enfermeras atienden al mismo paciente en distintos días, contar con métodos estandarizados garantiza una atención y experiencia consistentes para dicho paciente.
Un ejemplo destacado surge de la queja de un paciente en un entorno de tratamiento ambulatorio contra el cáncer: «Las cosas funcionan de manera diferente cada vez que vengo aquí». Algunos miembros del personal permitían que los pacientes llegados con retraso fueran atendidos de inmediato, mientras que otros les hacían esperar hasta que hubiera un espacio disponible para quimioterapia, incluso si los retrasos no eran culpa del paciente. Aunque esto no afectara la calidad clínica de la atención recibida, causaba frustración y podía afectar negativamente las puntuaciones de satisfacción de los pacientes.
En segundo lugar, estandarizar nuestro trabajo no significa que los procedimientos sean inmutables. El concepto Lean de kaizen implica mejorar constantemente nuestro trabajo.
Toyota tiene una expresión que dice que cada persona debe hacer su trabajo y encontrar mejores formas de hacerlo. Sin embargo, los «experimentos en curso» no deben causar caos ni cambios desordenados. Por ejemplo, si tenemos un método estandarizado para insertar un catéter central, debemos mejorarlo cuidadosamente y de manera controlada.
El tercer elemento es estructurar el trabajo para que los problemas sean visibles y se solucionen rápidamente.
Los métodos simples, como la gestión visual, proporcionan herramientas para que los problemas sean evidentes. Permiten identificar cuándo los suministros o equipos necesarios no están en su lugar, lo que facilita resolver y prevenir problemas de manera proactiva. En lugar de esperar a que se agoten los suministros en una unidad de hospitalización, los indicadores y controles visuales pueden mostrar que se están agotando debido a un uso mayor de lo habitual o a retrasos en la entrega de nuevos suministros. A menudo no se tiene visibilidad de estos problemas porque los suministros están ocultos detrás de puertas cerradas de gabinetes o en cajones.
Cuando sea posible, los conceptos de Lean sugieren mantener los suministros visibles y tener un proceso estandarizado para verificar los niveles de inventario, lo cual puede prevenir desperdicios, problemas y frustraciones. La gestión visual y el sistema kanban para la gestión de suministros se analizan en el Capítulo 6. También hay un componente de liderazgo importante en esto, ya que es necesario crear un entorno seguro donde el personal pueda comunicar los problemas y hacerlos visibles en lugar de ocultarlos o ignorarlos.
Capacidad 2: Los problemas se abordan rápidamente mediante experimentación
En un entorno Lean, se hace que los problemas sean visibles y evidentes porque se reconoce que es normal tener problemas, siempre y cuando se esté trabajando para solucionarlos.
Anteriormente, en la industria automotriz, era común no revelar problemas a los supervisores por temor a recibir críticas o intervenciones de la gerencia que podrían no ser útiles. Existe una historia conocida de Toyota sobre ejecutivos japoneses que visitaron a los gerentes estadounidenses en su fábrica en Georgetown, Kentucky.
Los ejecutivos japoneses preguntaron cuáles eran los principales problemas, y un gerente estadounidense respondió: «No hay problemas». Un ejecutivo japonés respondió: «Si no hay Ningún problema es un problema». 37
Si un gerente dice que no hay problemas, probablemente no esté al tanto de ellos o tenga miedo de hablar. Este es un problema de gestión que buscamos cambiar con la transformación Lean.
Cuando surge un problema, se resuelve inmediatamente en el lugar donde ocurre, confiando en las personas que lo enfrentan. Hay una expresión Lean que dice que los problemas no se resuelven en las salas de conferencias; se resuelven en el gemba, el lugar real del trabajo.
Por ejemplo, si las enfermeras olvidan enviar medicamentos a casa con pacientes dados de alta, el equipo no solo colgaría carteles. Cambiarían la ubicación de los medicamentos para hacerlos más visibles durante el alta y desarrollarían una lista de verificación estándar para recordar a las enfermeras incluir los medicamentos.
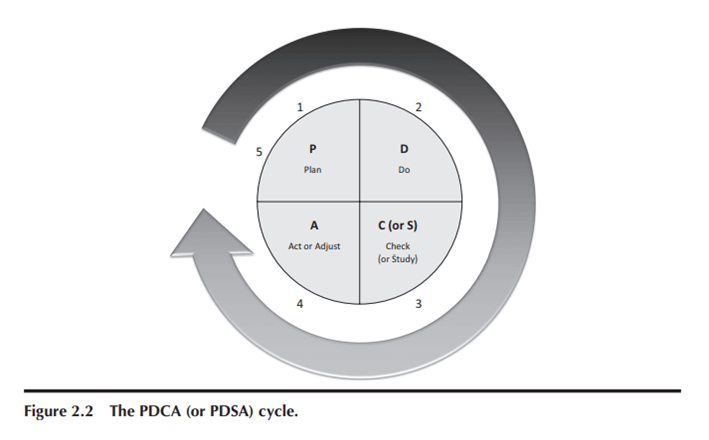
Pueden imprimir la lista de verificación en el sobre que guarda la información y pertenencias del paciente. Con el enfoque Lean, los problemas se resuelven más rápido y es más probable que encontremos una solución efectiva mediante experimentación rápida, siguiendo el ciclo de planificar-hacer-verificar-actuar (PDCA) de W. Edwards Deming.
Cuando surgen problemas, es mejor probar algo rápidamente en lugar de buscar la solución «perfecta». El enfoque de mejora continua se basa en el ciclo PDCA (también llamado planificar-hacer-estudiar-ajustar, o PDSA) que Deming enseñó a los japoneses después de la Segunda Guerra Mundial.
En el enfoque PDCA, cualquier mejora es el punto de partida para futuras mejoras, sin conformarnos nunca. El ciclo PDCA, visto en la Figura 2.2, se asemeja al método científico: cualquier cambio propuesto es una hipótesis que probamos. A través de ensayos pequeños, verificamos si el cambio logra los resultados esperados y actuamos según corresponda.
Si los resultados no son los esperados, cuestionamos la hipótesis inicial y descartamos el cambio o probamos otra alternativa (o regresamos al proceso original). Si obtenemos los resultados deseados, formalizamos el nuevo proceso y extendemos los cambios a otras áreas.
El ciclo PDCA requiere volver a la planificación para encontrar nuevas mejoras o problemas. Los métodos tradicionales de gestión asumen éxito garantizado con cambios y no prueban resultados, racionalizando la falta de éxito por miedo al fracaso. Una cultura Lean saludable no espera un éxito del 100% siempre.
fomenta una cultura de rechazo al riesgo donde el miedo al fracaso impide la experimentación y la mejora.
Capacidad 3: Las soluciones se difunden de forma adaptativa a través de la experimentación colaborativa
Las mejoras locales realizadas en una área deben ser compartidas con otros departamentos o áreas, para evitar la duplicidad de esfuerzos. Este concepto es aplicable a nuestras distintas unidades de hospitalización y pisos del hospital. Aunque puedan existir diferencias entre las unidades especializadas, ciertos procesos básicos, como la gestión de los pedidos de farmacia, pueden estandarizarse. Cuando se implementa una mejora kaizen en una unidad, es fundamental contar con un mecanismo para compartir dicha mejora con todas las demás unidades. La difusión adaptativa se diferencia de la implementación tradicional de una nueva práctica óptima desarrollada en una sola unidad. A menudo, el personal manifiesta su descontento al verse obligado a adoptar prácticas nuevas que podrían no ajustarse a las necesidades específicas de su unidad.
Los sistemas de salud, como ThedaCare, están adoptando el modelo Lean para mejorar su enfoque. En lugar de duplicar esfuerzos, una unidad puede utilizar el proceso de otra como punto de partida y adaptarlo según las necesidades de sus pacientes. Si descubren mejoras, deben compartirlas con la unidad original. Esta colaboración puede extenderse a otros hospitales del sistema o de la misma ciudad. La Iniciativa Regional de Atención Médica de Pittsburgh es un ejemplo de hospitales que comparten información sobre seguridad del paciente. La industria global de la salud tiene la oportunidad de crear métodos de comunicación para que los hospitales colaboren más allá de fronteras. Desde 2009, Healthcare Value Network ha facilitado este intercambio entre más de 60 hospitales y sistemas de salud en América del Norte.
Capacidad 4:
A las personas de todos los niveles de la organización se les enseña a ser experimentalistas.
Aunque Spear y otros expertos en Lean han mencionado que los empleados en niveles más bajos de la organización deben resolver problemas, no es suficiente simplemente agrupar a las personas en equipos sin proporcionarles las habilidades y métodos necesarios para resolver problemas de manera eficaz.
Muchos sistemas hospitalarios, como Avera McKennan (Sioux Falls, Dakota del Sur), están impartiendo formación inicial en Lean, incluyendo métodos de resolución de problemas, a todos sus empleados. Se requiere capacitación, entrenamiento y mentoría continuos, ya sea proporcionados por consultores externos, líderes internos de mejora de procesos, gerentes directos o líderes del propio equipo.
Reunir a un grupo de empleados para encontrar soluciones puede resultar en propuestas similares a las ya intentadas anteriormente, o simplemente sugerir que se tenga más cuidado o se aumente el esfuerzo. La metodología Lean permite a los empleados observar su trabajo y sus procesos desde una nueva perspectiva, lo que facilita la identificación de problemas previamente no detectados y ofrece nuevas formas de resolverlos. Esto no es una crítica a la inteligencia o creatividad de los empleados, sino un reconocimiento de que es responsabilidad de los líderes de hospitales proporcionar capacitación y desarrollo continuo a su personal. Un número creciente de hospitales está utilizando conceptos del artículo anterior de Spear, escrito con H. Kent Bowen, llamado «Decodificando el ADN del Sistema de Producción Toyota». Las reglas también se presentan en la metodología de mejora de la atención médica llamada «diseño adaptativo».




00303-7/asset/8f2c656e-0df3-4f1c-8797-2a50d3c38282/main.assets/gr1.jpg)
00303-7/asset/3a100ad6-ae96-4754-b21c-afc6252a83bd/main.assets/gr2.jpg)
00303-7/asset/ff4bc484-6655-4c27-ab34-c144b9df0911/main.assets/gr3.jpg)
00303-7/asset/669f048d-3e46-4b5c-a3cf-9c3f4f796a51/main.assets/gr4.jpg)
































































02352-3/asset/9c02f13a-4d93-4cec-a539-4b2ad5772f0f/main.assets/gr2.jpg)
02352-3/asset/3eb52a6b-6c33-4ea4-b19f-c77d79d2ed54/main.assets/gr3.jpg)
02352-3/asset/8d09c552-802d-42d2-abec-329854d0aecc/main.assets/gr4.jpg)
02352-3/asset/3eed69ae-d8ac-4899-bb34-cc6304efe215/main.assets/gr5.jpg)
02352-3/asset/ed3dbb78-d30b-4946-a664-0e42f6fc926d/main.assets/gr6.jpg)

