9 parte de 10.
Autor Dr. Carlos Alberto Díaz. Profesor Titular Universidad ISALUD.
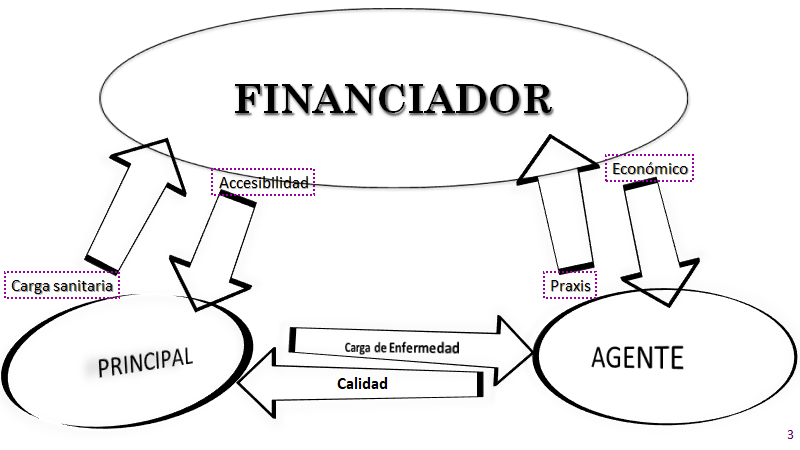
El concepto de dualidad, en la gestión de la complejidad, son los pares duales contradictorios, dialógicos, la asignación de recursos en una prestación sustrae de otros, al ser recursos escasos. Los pares duales en las organizaciones de salud son el orden y el desorden, organización abierta pero que tiende al enclaustramiento, hay que darle todo a todos, y hay un límite presupuestario; por último es necesario innovar, pero esta en riesgo la sustentabilidad por la innovación.
Los recursos son escasos, son insuficientes. La innovación está poniendo en riesgo la sustentabilidad del sistema de salud, cuando debería ser lo inverso. Los proveedores de innovación y del complejo industrial médico, avanzan sobre el gasto en salud, sin piedad, sin visión global, como si habitaran otro planeta, otro país, otro sistema, llevando el precio de los medicamentos, a que con su aplicación o empleo se “apropien de años de vida con Calidad de otros habitantes” exigiendo primero una solidaridad entre pobres (los que tienen trabajo formal con los monotributistas), entre pobres aportantes y el estado ausente. Pero cuidado, por este camino, van a vaciar las instituciones, luego de vaciar al estado no quedará nada y lo van a lograr. Entonces se irán, hacia otras latitudes, dejando nuestras miserias al descubierto, como bien lo simbolizan los Frescos de Lorenzetti en el ayuntamiento de Siena, del buen o mal gobierno.
La política de salud de un país la debe dictar quienes estén en condiciones de preservar la equidad. No puede ser el mercado. Los sistemas de salud no tienden naturalmente a la equidad. Mientras tanto, inconscientes del naufragio al que vamos encaminados, dejamos que los medicamentos cuesten más caros, y que los recursos sean insuficientes, endeudando al sistema, endeudamiento que es más social que económico. Están destruyendo ellos mismos el mercado, su mercado, porque no quedarán compradores para esos productos, pero si enfermos huérfanos y sin chances de cura. Entonces que pasará, irán a otros países, nos quedaremos al margen de esa parte del planeta que habitan 3000 millones de personas, que pertenecen a estados o sistemas que pueden acceder a esas nuevas tecnologías. Esto ya ocurrió con la epidemia de HIV.
Según una publicación reciente se estima que la innovación tecnológica explica entre el 33 y el 50% del incremento del gasto en salud. [i]
El tratamiento de un paciente con cáncer de colón ha permitido duplicar su sobrevida respecto a una década atrás pero también resulta 320 veces más costoso que en el pasado. Hecho que no es infrecuente que nuevos tratamientos oncológicos tengan costos muy superiores a los anteriores. Lo mismo se repite en otras líneas terapéuticas como la artritis reumatoidea[ii], la hemofilia o la hepatitis C, solo para mencionar algunos ejemplos.
La rápida aparición de tecnologías farmacéuticas, de diagnóstico y el aumento del volumen de la evidencia disponible han transformado los umbrales del costo efectividad, esfumándose los conceptos a partir del cual la misma era “rentable” para la sociedad. El desafío claramente está en mitigar el aumento de los costos y en lograr el uso apropiado de estas tecnologías, encontrando el marco lógico para determinar la adecuación, la pertinencia, la apropiabilidad y la asequibilidad.[iii]
- El crecimiento del gasto en salud es inflacionario[i] con respecto al crecimiento del PBI, en Australia es un 0,5 % por año, en España aumento en los últimos tres años uno por ciento del PBI, a pesar de todas las medidas de racionamiento. Otro tanto ocurre en EEUU, que año tras año, aumenta el gasto en salud. Si esto sigue ocurriendo el sistema se volverá insostenible. La pregunta ¿es si estos aumentos valen lo que cuestan?. El 43% de pacientes encuestados por el barómetro del Instituto de Estudios Fiscales de España, opinaron que hacían mal uso de la sanidad, muy por encima de cualquier otra prestación pública.
- La política de identificación y evaluación de las prácticas ineficaces o no rentables, la reducción de su uso actuó y la acentuación de los recursos que se liberan genera una sensación de utilidad.
- Se puede decir que el 30-40% de los pacientes está recibiendo tratamiento con fármacos de escaso valor terapéutico, entonces reciben tratamientos no suficientemente probados. Mediante medicamentos me too (con agregados en la molécula que carecen de valor terapéutico) evergreening (cuando la comercialización y la patente se están expirando, se patenta una modificación). Generar nuevas indicaciones o indicaciones ampliadas, para incrementar el mercado.
- Esta problemática entonces queda situada entre:
- la innovación en salud no regulada,
- el aumento del gasto,
- el déficit económico,
- en el financiamiento insuficiente,
- ausencia de evaluación independiente y
- la falta de transparencia en precios de este Mercado
Inculpamos alternativamente como tipificadores parcelares de demonios en esta problemática a:
1- Los medicamentos para enfermedades raras y las que no tenían tratamiento,
2- La industria farmacéutica imponiendo nuevas moléculas biológicas basados en la personalización de las alteraciones genómicas, no generar mecanismos de competencia. La protección de las patentes.
3- La obesidad-diabetes-sedentarismo-el hábito tabáquico,
4- El aumento de la cantidad de pacientes en diálisis, falta de una política nacional que sigan los lineamientos españoles para los trasplantes.
5- la tecnología diagnóstica, en imágenes, bioquímica y de biología molecular.
6-Los implantes o prótesis, las suturas mecánicas, las prótesis vasculares autoexplandibles, los resincronizadores cardíacos,
7-la judicialización, los amparos, la modificación del marco normativo legal, sin financiamiento correspondiente, como la fertilización o reproducción asistida,
8-Los profesionales con sus prescripciones, inducidas, entusiastas y conflictivas, repletas de conflictos de intereses.
9-Los consensos de las sociedades científicas, etc. Tendríamos que agregar a los actores sociales que participan, forman e integran este sistema.
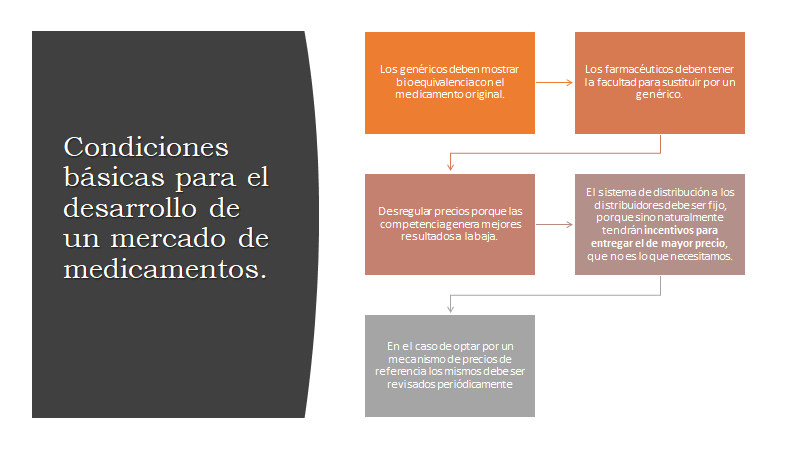
10- la carencia de una política de precios de medicamentos, el objetivo de una política nacional de medicamentos radica en el acceso a los mismos, la calidad de los medicamentos y el uso racional. El acceso implica la selección de medicamentos esenciales. Accesibilidad económica. Financiación de medicamentos. Sistemas de suministro.
11- Las prepagas con su modelo asistencial de medicalización de la vida
12.- la ausencia de una agencia de tecnologías sanitarias. Cuya característica principal es que sus dictámenes sean vinculantes.
Los factores que probablemente han aumentado gastos de los ensayos clínicos, que luego se trasladan a los precios, incluyen: la complejidad creciente de ensayos clínicos, necesidad de ensayos clínicos grandes, mayor costo de insumos del sector médico utilizado para el desarrollo, mayor atención e innovaciones dirigidos a la cronicidad y enfermedades degenerativas, cambios en el diseño de protocolos, crecientes esfuerzos para recopilar información de evaluación de tecnología médica y pruebas contra las drogas de referencia para satisfacer la necesidad de contar con datos de efectividad comparada. Sobre este aspecto debemos trabajar y gestionar, sumando las áreas de modernización de los gobiernos.[i] [ii]
En Argentina Los medicamentos con patente representan una proporción importante del gasto total en medicamentos, a pesar de que haya un número bastante pequeño de ellos. Es por lo que entre el 15% y el 20% del número total de moléculas representa entre el 70% y el 80% del gasto total en medicamentos. Mientras que los medicamentos genéricos constituyen entre el 70% y 80% del volumen total de medicamentos y representan alrededor del 30% del gasto total.
Somos un país de transición epidemiológica tardía e híbrida, con una media de cáncer, media alta, de 216/100.000 con 60.000 muertes por año por esta enfermedad. Un diez por ciento de pacientes con diabetes con muy mal control. Eso sí, con la insulina más cara del continente. Tenemos unos 28.572 dializados y los trasplantes renales no crecen, pero si la cifra de dializados[i]. Cada vez los argentinos tienen más sobre peso[ii]. La inversión pública en salud está en una meseta, cubriéndose con el aumento del gasto de la seguridad social y de bolsillo de la población. [iii]
Gasto – inversión – gestión- compras-transparencia de precios-desperdicios de los procesos e ineficiencia, son aspectos de esta realidad compleja, donde debemos direccionar la inversión, mejorar la gestión de compra[iv], la transparencia del mercado informar precios, la competencia y su resultados, desarrollar fortalezas locales de producción para poder contener el aumento del gasto, mejorar los procesos de gestión clínica, la continuidad de atención, los modelos de prestación integrados y los sistemas de información para disminuir la variabilidad de la prestación médica, para prescribir sabiamente “choosing wisely”.
Tenemos que establecer cuáles serán las oportunidades para encaminarnos estratégicamente a soluciones posibles. A eso dedicaré la última parte del documento.
Surgen en paralelo otro concepto innovador desde EE. UU, que debemos incorporar en este análisis la medicina basada en el valor, el país liberal por excelencia, potencia económica mundial, dice que la salud debe tener en cuenta la generación de valor con lo que invierte[v]. Cuando lo que se observa es un comportamiento inflacionario del gasto, poniendo a la prestación de los servicios de salud como un bien de lujo, que en las proyecciones de diversos autores superará el 20,5 del PBI para el 2025. [vi]
El gasto en desperdicios en los sistemas de salud de la OCDE, de acuerdo con una reciente publicación esta entre el 20-40%, esa es la fuente de obtención de recursos, desde nuestro sistema para financiar la innovación tecnológica. [i]
Lo fundamental es recortar la sobre utilización de pruebas diagnósticas, internaciones innecesarias y medicamentos sintomáticos de efectividad limitada o cuestionada. [ii]
The Advisory Board Company (2012)[iii], en un artículo conceptualizó que “La recesión económica mundial ha creado un futuro financiero incierto para las organizaciones de salud alrededor del mundo. Dadas las posibles diferencias de presupuesto entre la demanda de servicios de salud y los recursos financieros disponibles, muchos líderes de hospitales se ven obligados a encontrar una “capacidad virtual”, para proporcionar más servicios con la misma cantidad de recursos (o menos). De hecho, muchos hospitales se han visto obligados a detener proyectos de construcción o disminuir la cantidad de camas con los que se presupuestaba ofrecer una mayor cobertura a la demanda. Estos recortes no podrían estar apareciendo en un momento más complicado, ya que las previsiones demográficas para la próxima década y el futuro pronostican un repunte significativo de la población de tercera edad y, a su vez, un fuerte aumento en la utilización de camas en los hospitales”. Es indispensable reducir los costos para mejorar la sustentabilidad financiera de los próximos años, porque la inversión en salud aumento más que el crecimiento de las economías.[iv]
Explicar el valor en salud es un concepto complejo, con muchas aristas y ángulos de observación. Se concluye en lo que necesita el usuario, la comunidad, con el acuerdo social y la administración más eficaz, efectiva y eficiente de los recursos. Se genera valor no solo en la calidad, sino en la oportunidad de recibir el tratamiento, en el acceso, en la pertinencia, en la equidad, allí generamos valor, disminuyendo la desigualdad injusta, intentando lograr la cobertura universal de salud.
Valor es desempeño en términos de justicia social, de equidad, de costo efectividad. No es valor, darle todo a todos, porque no hay sistema en el mundo que pueda otorgar esa respuesta, porque no es sustentable y corresponde a la demagogia social. No es posible dar valor sin ahorros, sin desinversión, sin “choosing wisely”, sin reducir los costos de la ineficiencia y de la no calidad. Sin compromisos en cumplimiento de los propios pacientes, de los que ejercen la profesión y que integran el sistema de salud.[i]
El objetivo primordial de la innovación es acrecentar la salud de la población, entonces el valor viene dado por las ganancias de salud que esta proporciona.
El valor adicional que aporta una nueva tecnología no puede costearse a cualquier precio, tenemos que desarrollar un umbral.
El valor umbral debe reflejar por tanto la cantidad máxima que se considera apropiada invertir por unidad de efectividad en salud en un sistema sanitario, y facilita la posibilidad de realizar recomendaciones en base a la evidencia proporcionada por el ACE. Dicho valor será mayor cuanto mayor sean las ganancias en salud por dólar invertido.
El indicador que permitiría medir dicho valor es la razón incremental de la coste-efectividad (RICE), que se calcula como el costo incremental de la nueva tecnología dividido por el incremento en salud, respecto de la tecnología adoptada como comparador. Esto nos debería otorgar el umbral costo efectividad.
Esto tampoco puede ser un umbral rígido o duro, como único punto de corte o censura, que delimite estrictamente lo financiable y lo financiable. Además, se debe tener en cuenta los valores adicionales que estas tecnologías tienen.
En una revisión metodológica reciente llevada a cabo por la Red Europea para la Evaluación de Tecnologías Sanitarias (EuNetHTA, 2015), señala que, de los 25 países europeos con guías metodológicas de evaluación económica, nada menos que 21 de ellos recomiendan el uso del Análisis Coste-Utilidad (ACU) y los AVAC como unidad de efectividad.[i]
En España, Vallejo-Torres et al. (2016), a partir de un panel de datos comprendidos entre 2008 y 2012 para las 17 Comunidades Autónomas, estiman un coste por AVAC promedio de 24.222€. Cuando se consideran los diferentes grupos etarios, puede obtenerse la media del coste por AVAC a diferentes edades, que ascendería a 22.314€. Ambos umbrales se hallan por debajo del valor usualmente referenciado como umbral coste-efectividad para España, que son 30.000€ por AVAC/Año de Vida.[i] [ii]
En Suecia y Holanda, autoridades gubernamentales, así como importantes consejos asesores han recomendado umbrales de aproximadamente 57.000 Euros y 80.000 Euros respectivamente. [iii][iv]
El coste por año de vida ajustado por calidad (AVAC) al que opera actualmente en el Sistema Nacional de Salud de España ofrece una aproximación de este coste de oportunidad, y sirve de guía para fijar el umbral de coste-efectividad en contextos de presupuestos fijos.
Este comportamiento inflacionario en costos, no relacionado con el progreso de la efectividad o del coste efectividad incremental, pone en riesgo la sustentabilidad del sistema[v], y la equidad, por la apreciación de un sector público recortado presupuestariamente, fijando presupuestos históricos, girados y gastados a espaldas de la población, que no tienen en cuenta sus necesidades, o un programa de salud, o bien la responsabilidad poblacional. Ese presupuesto público constituye la base de la equidad de los sistemas sociales. La equidad es claramente asintótica, pero más lejana es si no hay incremento de la inversión pública en salud. Para los que menos tienen, los pobres, conserven el mejor estado de salud, para mejorar el ingreso en sus hogares y perfeccionar las posibilidades como país. [vi]
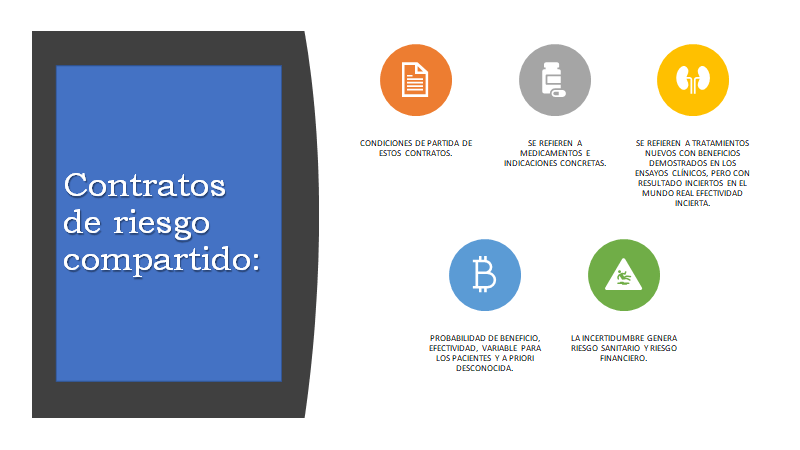
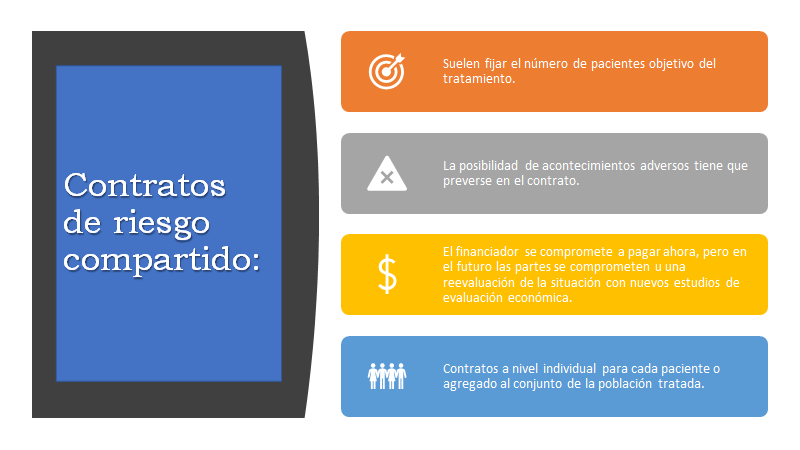
Para evaluar una nueva tecnología en salud, especialmente los fármacos, deberíamos tener a disposición la ratio de coste efectividad incremental, como dice Beatriz González López Valcárcel, este número es “la quintaesencia económica de la eficiencia del nuevo fármaco”. Que en realidad nos dirá cuánto cuesta ganar una unidad de salud con el nuevo tratamiento, comparado con el que se viene utilizando en la práctica clínica habitual. Esto es sencillo, pero socialmente el coste efectividad no es el único valor que entra en la consideración. También están la equidad, la valoración extra de la salud ganada a quien tiene una enfermedad rara, o cáncer, o a quién la medicina aplica la regla del rescate. Pero si, sería como razonable que un año de vida ganado con calidad, debería costar un producto bruto interno, dependiendo del lugar donde se realice la evaluación, los alcances pronósticos de esa enfermedad y el reto de la equidad. Si es en EE. UU serán 50.000 dólares, si es en UK será 30.000 libras. Si es en España 22.000 Euros. Pero resulta que en Argentina sería de 15.000 dólares, y los medicamentos en nuestro país, como se dijo, son más costosos. Entonces nuestro costo efectividad es foránea, porque no la medimos, entonces la inversión que nos corresponde seguramente resultará entre dos-cuatro o más veces el PBI, por cada año de vida en el uso de las nuevas tecnologías. Es imperioso, entonces, que agencias locales y autoridades del Ministerio de Salud y de la Superintendencia de Servicios de Salud, puedan emitir dictámenes vinculantes sobre las nuevas tecnologías, para decir que se cubre, para qué patologías y cuál es el precio de referencia o reintegro en la seguridad social. Que estas recomendaciones se enmarquen en un régimen tutelado, para poder realizar un seguimiento. Pudiendo agregar algunos otros recursos de innovación contractual, como acuerdos de riesgo compartido, para amortiguar el impacto que genera este aumento de los costos. .[vii]
Esta dualidad entonces queda situada entre:
- la innovación en salud no regulada,
- el aumento del gasto,
- el déficit económico,
- en el financiamiento insuficiente,
- ausencia de evaluación independiente y
- la falta de transparencia en precios de este Mercado.
[i] Vallejo-Torres-Torres L, García-Lorenzo B, Castilla I, Valcárcel Nazco C, GarcíaPérez L, Linertová R, Polentinos-Castro E, Serrano-Aguilar P. On the Estimation of the Cost-Effectiveness Threshold: Why, What, How? Value in Health 2016. 19: 558-566.
[ii] Vallejo-Torres-Torres L, García-Lorenzo B, Castilla I, Valcárcel Nazco C, GarcíaPérez L, Linertová R, Serrano-Aguilar P. Valor Monetario de un Año de Vida Ajustado por Calidad: Estimación empírica del coste de oportunidad en el Sistema Nacional de Salud. Ministerio de Sanidad, Servicios Sociales e Igualdad. Servicio de Evaluación del Servicio Canario de la Salud; 2015. Informes de Evaluación de Tecnologías Sanitarias
[iii] Bobinac A. Van Exel NJA. Tutten FFH. Brouwer WBF. Willingness to pay for a quality adjusted life year: the individual perspective. Value Health 2010. 13.1046-1055
[iv] Ryen L Svensson M. The willingness top ay for a quality adjusted life year: a review of the empirical literatura. Health Econ. 2015. 24;1289-1301.
[v] González López Valcárcel B. Ortún V. Evaluar no es de compañeros. ¿O sí? Editorial. Rev Esp. Salud Pública. 89.2.2015.
[vi] Culyer AJ Cost-effectiveness thresholds in health care: a bookshelf guide to their meaning and use. Health Economics, Policy and Law / FirstView Article / February 2016, pp 1 – 18, doi: 10.1017/S1744133116000049
[vii] Claxton K, Martin S, Soares M, Rice N, Spackman S, Hinde S, Devlin N, Smith P, Sculpher M (2015). Methods for the estimation of the National Institute for Health and Care Excellence cost-effectiveness threshold. Health Technology Assessment, 2015.
[i] European Network for Health Technology Assessment (2015). Methods for health economic evaluations – A guideline based on current practices in Europe, EUnetHTA, May 2015
[i] Ebbevi D. Value Based Health care: challenges in moving forward. 2017. Karolinska Institutet tesis. https://openarchive.ki.se/xmlui/handle/10616/45470
[i] Organisation for Economic Cooperation and Development. Tackling wasteful spending on health. OECD, 2017.
[ii] Brownlee S, Chalkidou K, Doust J, et al. Evidence for overuse of medical services around the world. Lancet 2017 Jan 6 [Epub ahead of print.] doi:10.1016/S0140-6736(16)32585- 5. pmid:28077234.
[iii] THE ADVISORY BOARD COMPANY. Next Generation Capacity Management. 2012. http://www.jhsph.edu/offices-and-services/career-services/for-students/career-resources/Public%20Health%20Employers/2012-13_Employer_Information_Sessions/Advisory_Board
[iv] Global burden of Disease Health financing collaborat network. Evolution and patterns of global health financing 1995-2014 development assistance for health, and government, prepaid private, and out of pocket healh spending in 184 countries. Lancet. 2017. Published Online April 19, 2017 http://dx.doi.org/10.1016/S0140-6736(17)30874-7
[i] Marinovich S. Lavorato C. Bisignano L Hansen Krogh D y col. Registro nacional de Diálisis Crónica 2014-2015 publicado en 2016. http://san.org.ar/2015/docs/registros/REGISTRO_ARGENTINO_dialConica2014_2015.pdf
[ii] Ministerio de salud. Tercera encuesta nacional de factores de riesgo para enfermedades no transmisibles. 2015 http://www.msal.gob.ar/images/stories/bes/graficos/0000000544cnt-2015_09_04_encuesta_nacional_factores_riesgo.pdf
[iii] Ministerio de Hacienda y finanzas públicas. Secretaria de Política Económica y planificación del desarrollo. Informes de Cadenas de Valor. Salud Farmacia y equipamiento médico. Diciembre 2016.
[iv] Kanavos P. Políticas de adquisición de medicamentos: la experiencia internacional. Breve 18. 2017. https://publications.iadb.org/bitstream/handle/11319/8407/Breve-18-Politicas-de-adquisici%c3%b3n-de-medicamentos-la-experiencia-internacional.PDF?sequence=1&isAllowed=y
[v] Porter ME What is value in health care? N Engl J Med 2010. 363:2477–81
[vi] Berdwick DM. Hackbarth AD. Eliminating Waste in US health care. JAMA. 2012 307. (14):1513-1516.
[i] Oliva J, Brosa M, Espín J, Figueras M, Trapero M y Key Value-Grupo I. Cuestiones controvertidas en evaluación económica (I): Perspectiva y costes en la evaluación económica de intervenciones sanitarias. Rev Esp Salud Pub. 2015; 89: 5-14
[ii] Trapero-Bertrán M, Brosa M, Espín J, Oliva J y Key Value-Grupo II. Cuestiones controvertidas en evaluación económica (II): Perspectiva y costes en la evaluación económica de intervenciones sanitarias. Rev Esp Sal Pub. 2015; 89: 125-135. Disponible en: http://www.msssi.gob.es/biblioPublic/publicaciones/recursos_propios/resp/revista_cdrom/vol89/vol89_2/RS892C_MTB.pdf
[i] Del Llano J. 2011. Desinvertir en lo que no añade salud sin dañar el sistema.
[i] Giedion Ú, Muñoz AL, Ávila A. Serie de notas técnicas sobre procesos de priorización en salud: Nota 1: Introducción: Serie de notas técnicas sobre procesos de priorización en salud. InterAmerican Development Bank; 2015.
[ii] Román Ivorra JA. Ivorra J. Monte Boquet E. Canal C. Oyagüez I. Gómez Barrera M. Análisis de costes de la utilización de fármacos biológicos para la artritis reumatoide en primera línea de tratamiento tras respuesta inadecuada a metrotrexato en función del peso de los pacientes. Reumatología clínica 2016;12 (3):123-129
[iii] EFPIA – Improving patient access to innovative medicines – the framework in which differentiated pricing may offer a solution[Internet]. [March 14, 2016]. http://www.efpia.eu/documents/102/
48/Improving-patient-access-to-innovative-medicines-the-frameworkin-which-differentiated-pricing-may-offer-a-solution