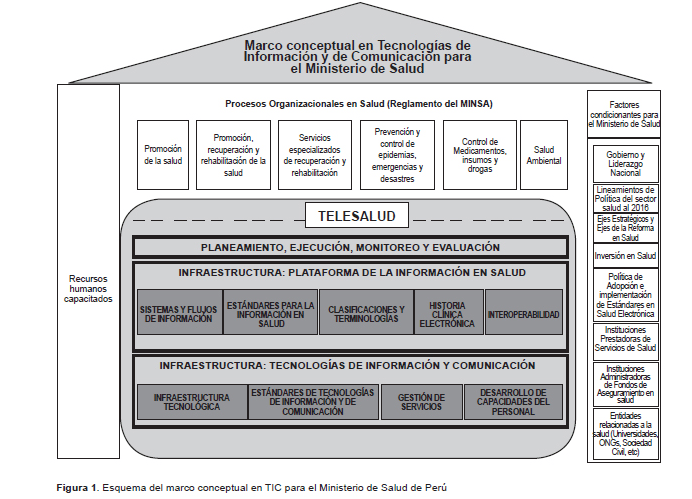
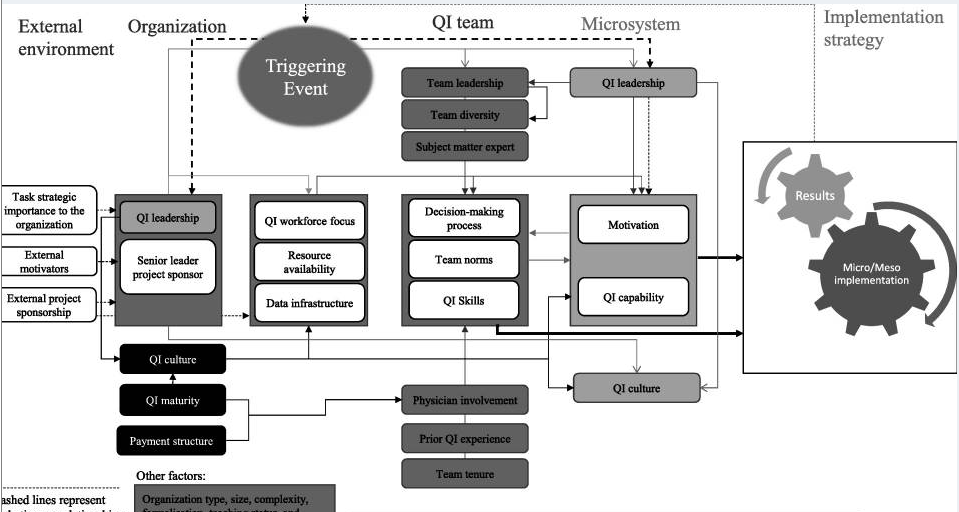
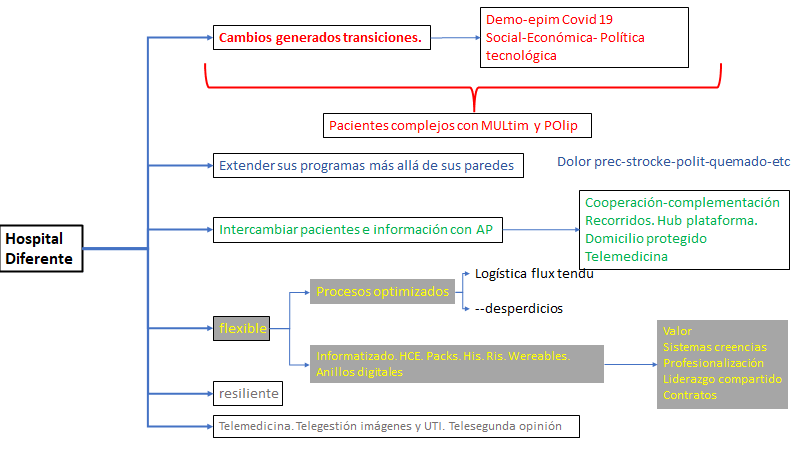
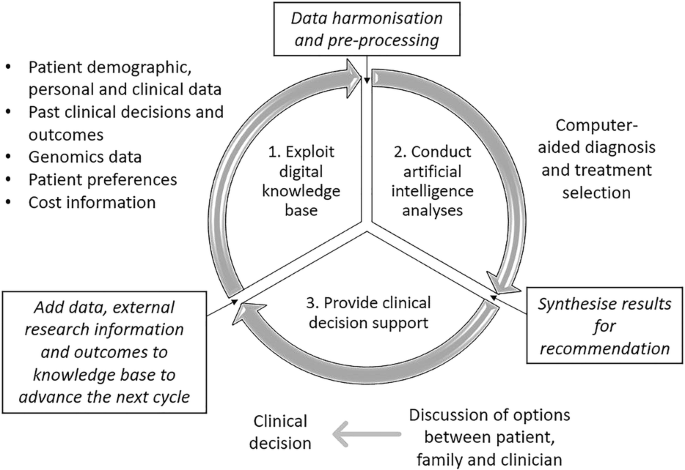
Propongo desde el blog iniciar un recorrido de varias intervenciones por la implementación de procesos de cambio, impulsado por la evidencia de eficacia, y observar las dificultades que tenemos con la efectividad al llevarlo a la práctica. Para ello recorreré algunos clásicos, para continuar hasta la actualidad por la bibliografía publicada, por ello empiezo por un artículo del Lancet de 2003, que le da el título a la intervención de este posteo. Incursiono en estos aspectos porque me parece sumamente práctico para los procesos de cambio, usando, herramientas de las ciencias de la implementación. La principal preocupación radica en que los pacientes no reciban la atención adecuada.
çProf. Richard Grol PhDaProf. Jeremy Grimshaw MDb
Surgen grandes dificultades a la hora de introducir la evidencia y las guías clínicas en la práctica diaria habitual. Los datos muestran que muchos pacientes no reciben la atención adecuada o reciben una atención innecesaria o perjudicial. Muchos enfoques pretenden ofrecer soluciones a este problema; no está claro cuáles son hasta ahora los más eficaces y eficientes. Nuestro objetivo es proporcionar una descripción general del conocimiento actual sobre las iniciativas para cambiar la práctica médica. Evidencia sustancial sugiere que es posible cambiar el comportamiento, pero este cambio generalmente requiere enfoques integrales en diferentes niveles (médico, práctica de equipo, hospital, entorno más amplio), adaptados a entornos específicos y grupos destinatarios. Los planes de cambio deben basarse en las características de la evidencia o la guía en sí misma y las barreras y facilitadores del cambio. En general,
Lo que sabemos sobre el diseño de una intervención de mejora eficaz (pero con demasiada frecuencia no lo ponemos en práctica)
Martin Marshall Debra de Silva 2 ,Lesley Cruickshank 3 ,Jenny Shand 2 ,Li Wei 4 ,James Anderson 2
Intervenir para mejorar el desempeño del sistema de salud
Es tentadoramente fácil tratar las intervenciones de mejora como si fueran medicamentos: técnicas, estables y no influidas por el entorno en el que funcionan. Hacerlo hace la vida mucho más fácil para todos. Permite a los profesionales de la mejora planificar su trabajo con un alto grado de certeza, a los financiadores estar seguros de que saben lo que están comprando y a los evaluadores centrarse en lo que realmente importa, si «funciona» o no.
El desafío es que, si bien la mayoría de los mejoradores (incluidos los autores) aprecian la importancia de diseñar cuidadosamente una intervención de mejora, rara vez lo hacemos de una manera lo suficientemente inteligente.
En este artículo, describimos nuestros intentos como un equipo experimentado de profesionales, mejoradores, comisionados y evaluadores para diseñar una intervención eficaz para mejorar la seguridad de las personas que viven en hogares de ancianos en Inglaterra.
Destacamos cómo el diseño de la intervención, como se describe en la propuesta de subvención original, cambió significativamente a lo largo de la iniciativa. Describimos cómo los cambios que se realizaron dieron como resultado una intervención más eficaz, pero cómo nuestra incapacidad para diseñar una mejor intervención desde el principio redujo el impacto general del proyecto. Basándonos en la literatura en rápida expansión en el campo y nuestra propia experiencia,
Un estudio de caso práctico: una iniciativa para mejorar la seguridad de las personas que viven en residencias.
Un número creciente de personas mayores vulnerables viven en residencias y corren un mayor riesgo de sufrir daños prevenibles. Llevamos a cabo un programa de mejora de la seguridad con una evaluación multimétodo participativa vinculada 2 en residencias de ancianos del sureste de Inglaterra. Se reclutaron noventa hogares en cuatro cohortes separadas durante un período de 2 años. Nuestro objetivo fue reducir la prevalencia de tres de los eventos de seguridad más comunes en el sector —caídas, úlceras por presión e infecciones del tracto urinario— y así reducir las asistencias innecesarias a los servicios de urgencias y los ingresos hospitalarios.
En la propuesta original presentada al organismo de financiación, describimos una intervención multifacética que comprende tres elementos principales:
- La medición y evaluación comparativa de (i) la prevalencia de los incidentes de seguridad objetivo utilizando una herramienta diseñada a nivel nacional llamada Termómetro de seguridad 3 del NHS y (ii) las tasas de asistencia al departamento de emergencias e ingresos hospitalarios utilizando datos recopilados de forma rutinaria.
- Formación en métodos de mejora de la calidad proporcionada inicialmente por un equipo de asesores de mejora del NHS y luego, utilizando un modelo de «formación de formadores», por profesionales que trabajan con o en los hogares de ancianos.
- El uso de una versión especialmente adaptada del Marco de Seguridad del Paciente de Manchester, 4 (Marshall M, de Silva D, Cruickshank L, et al . uso en el sector de hogares de ancianos (presentado a BMJ Qual Saf , agosto de 2016), una herramienta de evaluación formativa que proporciona información sobre la cultura de seguridad para los equipos de primera línea.
La intervención se basó en un fuerte énfasis en el apoyo y el aprendizaje compartido utilizando comunidades de práctica y recursos en línea facilitados por el equipo de mejora.
La teoría del programa planteó la hipótesis de que los tres elementos principales de la intervención (evaluación comparativa, habilidades de mejora del aprendizaje y conciencia cultural) reducirían la prevalencia de eventos de seguridad, que esto conduciría a una reducción en las asistencias al departamento de emergencias y las admisiones hospitalarias y que ambos resultados reducirían costos del sistema, así como mejorar la calidad de la atención a los residentes. La intervención fue codiseñada por los investigadores de mejora del equipo de evaluación, el equipo de mejora del organismo del gobierno local responsable de encargar los servicios de los hogares de ancianos y un gerente superior de uno de los hogares de ancianos participantes. El diseño fue influenciado por una combinación de teoría, evidencia empírica publicada y el conocimiento personal y la experiencia de los comisionados y el administrador del hogar de cuidados.
Construimos un período preparatorio de 6 meses al inicio del programa, antes de implementar la intervención con la primera cohorte de residencias. Este período se utilizó para contratar personal, establecer la infraestructura del proyecto y construir relaciones entre las residencias y los equipos de mejora y evaluación. Solo cuando el programa comenzó formalmente, comenzamos a exponer algunas de las deficiencias en la intervención planificada. La Tabla 1 describe los diferentes componentes de la intervención, si fue parte del plan original o se introdujo en una etapa posterior y, según nuestra evaluación participativa, cómo se implementó y en qué medida se utilizó.
Pero, por supuesto, la mayoría de la gente sabe que la vida no es tan simple. Los mejoradores experimentados han reconocido desde hace mucho tiempo que las intervenciones (las herramientas y actividades específicas introducidas en un sistema de salud con el objetivo de cambiar su desempeño para mejorar 1) se flexionan y se transforman. Los mejoradores inteligentes observan y describen cómo sucede esto. Incluso los mejoradores más inteligentes planifican y gestionan activamente el proceso de una manera que optimiza el impacto de la iniciativa de mejora.
No hay escasez de teoría cada vez más sofisticada, evidencia empírica y comentarios aprendidos que podrían haber guiado nuestras decisiones de diseño. Gran parte del pensamiento sobre las intervenciones es relativamente nuevo; una revisión de vanguardia de las mejoras publicada en The Lancet hace más de 15 años no hizo ninguna referencia específica a las formas en que las intervenciones se transforman cuando se aplican en la práctica. 6 Por el contrario, las orientaciones internacionales más recientes sobre el diseño, la realización y la redacción de proyectos de mejora destacan la importancia de describir cómo cambian las intervenciones de mejora. 7 En resumen, una serie de temas relacionados con el diseño de intervenciones efectivas están surgiendo en la literatura.
En primer lugar, se destaca la importancia de utilizar la teoría (‘una cadena de razonamiento’) para optimizar el diseño y la eficacia de las intervenciones. 8 Se está defendiendo un enfoque teórico de sentido común en lugar de un enfoque demasiado académico como una forma de reducir el riesgo del « pensamiento mágico », que alienta a los mejoradores a utilizar intervenciones que parecen superficialmente atractivas pero para las que los mecanismos de acción no están claros. 8 , 9 Junto al uso de la teoría, existe un interés creciente en la aplicación del ‘pensamiento de diseño’ como una estrategia para asegurar que el problema ha sido claramente identificado y una forma de abordar problemas complejos en entornos que cambian rápidamente. 10
En segundo lugar, se describe la importancia de tener un método explícito, como el Modelo de mejoramiento del Instituto para la Mejora de la Atención de la Salud mediante ciclos Planificar-Hacer-Estudiar-Actuar, y también comprender cómo utilizar los métodos en todo su potencial. 11
En tercer lugar, existe un énfasis creciente en la medida en que las intervenciones de mejora son de naturaleza social y técnica, y cómo su eficacia es consecuencia de una interacción compleja entre personas, estructuras organizativas y procesos. 12 , 13
En cuarto lugar, la literatura describe cómo lo que las personas hacen (intervención), cómo lo hacen (implementación) y el entorno más amplio (contexto) son interdependientes y algunas personas sugieren que la diferenciación tradicional entre esta tríada clásica ya no es útil. 14
En quinto lugar, existe un consenso cada vez mayor de que los esfuerzos de mejora se están evaluando demasiado pronto en su desarrollo y, como consecuencia, se juzgan injustamente como ineficaces. 15 , 16
En cambio, se pide que las intervenciones se categoricen de acuerdo con el ‘grado de creencia’ de que funcionarán 16 y cómo esta creencia se fortalece a medida que avanza el proyecto.
Las intervenciones en la fase inicial de «innovación» deben evaluarse utilizando métodos diferentes de los de las fases posteriores de «prueba» o «difusión». También pueden tener una intención diferente, por ejemplo, los cambios en el comportamiento pueden verse como «éxito» antes de que se logren cambios mensurables en el resultado.
En sexto lugar, aprovechando el campo en expansión de la movilización de conocimientos, 17 , 18 Los expertos están pidiendo un proceso más activo de co-diseño de iniciativas de mejora que involucren a los usuarios del servicio, profesionales y mejoradores, y también académicos, con todas estas partes interesadas contribuyendo a los modelos participativos de evaluación. 19
¿Qué haríamos de manera diferente?
Después de revisar la literatura, llegamos a la conclusión de que cada una de las hipótesis post hoc eran explicaciones razonables de lo que en el campo de la mejora no eran resultados infrecuentes, pero que, sin embargo, eran decepcionantes. En el futuro, nos esforzaremos más en diseñar la intervención desde el principio. Pensaremos en los problemas de diseño con suficiente detalle para no solo persuadir al financiador del proyecto, sino también para persuadirnos a nosotros mismos de que funcionará en la práctica. Describiremos una teoría del programa con mayor detalle basándonos en una mejor comprensión de los factores contextuales que podrían afectar la viabilidad y eficacia de la iniciativa, y usaremos el pensamiento de diseño para enmarcar rigurosamente el problema desde el principio.
Trabajaremos con más detalle y de manera más sistemática cómo utilizar el pensamiento actual sobre el diseño de intervenciones y su aplicabilidad a nuestro proyecto. Incorporaremos un período preparatorio similar o incluso más largo y usaremos ese período para probar y refinar la intervención. No confiaremos en un solo administrador del hogar de ancianos para brindar una visión del profesional para la propuesta original y buscaremos una amplia gama de puntos de vista del personal de primera línea y de los residentes del hogar de cuidados de una manera inclusiva e iterativa. No asumiremos que la intervención se puede implementar como se describe en la propuesta y seremos más sensibles a las limitaciones de recursos bajo las cuales están operando el equipo de mejora y las residencias.
Si hacemos todo esto, es casi seguro que el resultado será mejor.
Reflexiones finales
A veces se planifican iniciativas de mejora en terrenos elevados y duros, pero se ponen en práctica en las tierras bajas pantanosas. 20Como somos más que conscientes, la práctica de primera línea es complicada. Y como hemos descrito en este artículo, nunca es posible hacer las cosas a la perfección y los buenos mejoradores siempre están aprendiendo. Pero a medida que madura el movimiento de mejora, estamos llegando a la etapa en la que podríamos y deberíamos hacerlo mejor. Necesita ser visto como un deporte profesional más que como un aficionado. La importancia de comprender que las intervenciones de mejora no son como medicamentos o dispositivos médicos, y que la flexibilidad debe incorporarse en su diseño y entrega, es indiscutible. Pero ya no es aceptable utilizar la necesidad de flexibilidad como excusa para la falta de pensamiento y planificación. A medida que la mejora se vuelve más rigurosa, tal vez los profesionales de la mejora podrán planificar su trabajo con un mayor grado de certeza.




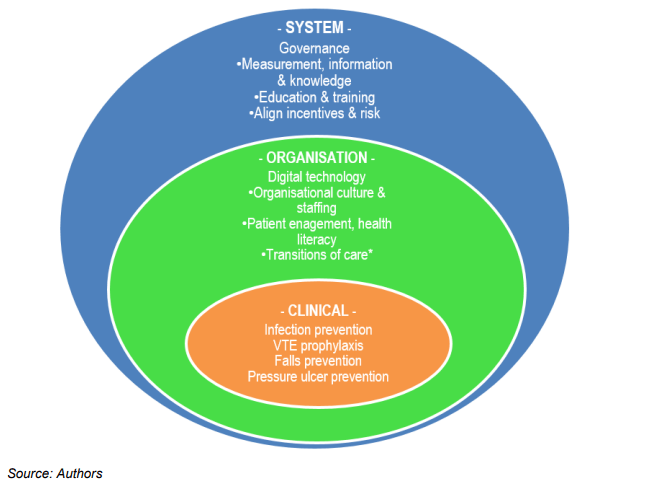


 Características de las personas con Covid-19 en el Reino Unido, según variante
Características de las personas con Covid-19 en el Reino Unido, según variante